【备考2024年】从巩固到提高 高考化学二轮微专题11 氧化还原反应
试卷更新日期:2024-02-23 类型:二轮复习
一、选择题
-
1. 关于反应4CO2+SiH44CO+2H2O+SiO2 , 下列说法正确的是( )A、CO是氧化产物 B、SiH4发生还原反应 C、氧化剂与还原剂的物质的量之比为1∶4 D、生成1molSiO2时,转移8mol电子2. 工业上以铜阳极泥(主要成分是)为原料提取碲(第五周期VIA族),涉及反应:
① ②
以下说法正确的是 ( )
A、中元素的化合价是价 B、氧化性强弱顺序为: C、反应②中氧化剂是SO2 , 氧化产物是H2SO4 D、每制备理论上共转移12mol电子3. 关于反应 , 下列说法正确的是A、消耗 , 转移电子 B、在此条件下,氧化性: C、既是氧化剂又是还原剂 D、氧化产物和还原产物的物质的量比为21∶84. 电极材料制备的反应为 , 下列说法正确的是A、生成0.1 mol , 转移的电子数为0.1 B、还原产物为和CO C、标准状况下,生成20.16L CO时,被还原的为0.1 mol D、还原剂与氧化剂的物质的量之比为1∶65. 下列物质在空气中久置会变质,变质过程不涉及氧化还原反应的物质是 ( )A、Na B、Na2O C、Na2O2 D、Na2SO36. 关于反应K2H3IO6+9HI=2KI+4I2+6H2O,下列说法正确的是A、生成12.7g I2时,转移0.1mol电子 B、KI是还原产物 C、还原剂与氧化剂的物质的量之比为7:1 D、K2H3IO6发生氧化反应7. 氮氧化物是大气污染物之一,如图为科研人员探究消除氮氧化物的反应机理,下列说法错误的是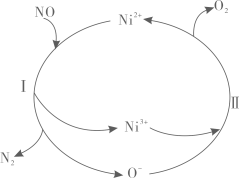 A、过程I中NO既作氧化剂又作还原剂 B、过程II中每生成1molO2时,转移电子的数目约为4×6.02×1023 C、过程中涉及的反应均为氧化还原反应 D、整个过程中Ni2+作催化剂8. 关于反应 , 下列说法正确的是A、生成 , 转移电子 B、是还原产物 C、是氧化剂 D、氧化产物与还原产物的物质的量之比为9. 一种新型人工固氮的原理如图所示,下列叙述错误的是( )
A、过程I中NO既作氧化剂又作还原剂 B、过程II中每生成1molO2时,转移电子的数目约为4×6.02×1023 C、过程中涉及的反应均为氧化还原反应 D、整个过程中Ni2+作催化剂8. 关于反应 , 下列说法正确的是A、生成 , 转移电子 B、是还原产物 C、是氧化剂 D、氧化产物与还原产物的物质的量之比为9. 一种新型人工固氮的原理如图所示,下列叙述错误的是( ) A、反应①中每生成1molLi3N转移电子数为3NA B、反应①②③均为氧化还原反应 C、反应③中O2为氧化产物 D、整个过程的总反应可表示2N2 + 6H2O = 4NH3 + 3O210. 关于反应4CO2+SiH44CO+SiO2+2H2O,下列说法正确的是( )A、CO是氧化产物 B、SiH4发生还原反应 C、氧化剂与还原剂的物质的量之比为1∶4 D、还原性:SiH4>CO11. 纯净物状态下的标准电极电势,可用来比较对应氧化剂的氧化性强弱,现有5组标准电极电势数据如表所示:
A、反应①中每生成1molLi3N转移电子数为3NA B、反应①②③均为氧化还原反应 C、反应③中O2为氧化产物 D、整个过程的总反应可表示2N2 + 6H2O = 4NH3 + 3O210. 关于反应4CO2+SiH44CO+SiO2+2H2O,下列说法正确的是( )A、CO是氧化产物 B、SiH4发生还原反应 C、氧化剂与还原剂的物质的量之比为1∶4 D、还原性:SiH4>CO11. 纯净物状态下的标准电极电势,可用来比较对应氧化剂的氧化性强弱,现有5组标准电极电势数据如表所示:氧化还原电对(氧化型/还原型)
电极反应式
标准电极电势
0.77
0.54
1.36
1.07
0.151
下列分析错误的是
A、氧化性: B、往淀粉溶液中滴加溶液,溶液不变蓝 C、往含有的溶液中滴加少量溴水,溶液变红色 D、溶液与溶液反应的离子方程式为:12. 已知反应: , 。下列关于该反应的说法错误的是A、可以对水体进行杀菌消毒、净化 B、在该反应中既是氧化剂又是还原剂 C、 D、每生成 , 转移4mol电子13. 氨基钠()是重要的化学试剂,其与氧气的反应如下:。下列说法正确的是A、 B、每消耗 , 转移电子数是 C、是氧化产物 D、中N的化合价部分发生变化14. 关于反应 , 下列说法正确的是A、可以和反应,生成 B、是氧化产物 C、既是氧化剂又是还原剂 D、生成 , 转移个电子15. 碘在地壳中主要以形式存在,在海水中主要以形式存在,几种粒子之间的转化关系如图所示。下列说法正确的是 A、由题图可知氧化性的强弱顺序: B、可利用与在一定条件下反应制备 C、途径III中若反应 , 则反应中转移电子 D、在淀粉碘化钾溶液中逐滴滴加氯水,不能观察到溶液变蓝现象16. 食盐中的常用作补碘剂,通过碘单质和氯酸钾反应制备,该方法的第一步反应为 , 下列说法正确的是A、产生时,反应中转移 B、反应中氧化剂和还原剂的物质的量之比为 C、是还原产物 D、发生还原反应
A、由题图可知氧化性的强弱顺序: B、可利用与在一定条件下反应制备 C、途径III中若反应 , 则反应中转移电子 D、在淀粉碘化钾溶液中逐滴滴加氯水,不能观察到溶液变蓝现象16. 食盐中的常用作补碘剂,通过碘单质和氯酸钾反应制备,该方法的第一步反应为 , 下列说法正确的是A、产生时,反应中转移 B、反应中氧化剂和还原剂的物质的量之比为 C、是还原产物 D、发生还原反应二、非选择题
-
17. 资料显示,可以将氧化为。某小组同学设计实验探究被氧化的产物及铜元素的价态。
已知:易溶于溶液,发生反应红棕色;和氧化性几乎相同。
(1)、将等体积的溶液加入到铜粉和的固体混合物中,振荡。实验记录如下:
实验现象
实验Ⅰ
极少量溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验Ⅱ
部分溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验Ⅲ
完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
初始阶段,被氧化的反应速率:实验Ⅰ填“”“”或“”实验Ⅱ。
实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有蓝色或无色 , 进行以下实验探究:
步骤取实验Ⅲ的深红棕色溶液,加入 , 多次萃取、分液。
步骤取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
步骤的目的是。
查阅资料, , 无色容易被空气氧化。用离子方程式解释步骤的溶液中发生的变化:。
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 , 实验Ⅰ中铜被氧化的化学方程式是。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓溶液,填实验现象 , 观察到少量红色的铜。分析铜未完全反应的原因是。
(2)、上述实验结果,仅将氧化为价。在隔绝空气的条件下进行电化学实验,证实了能将氧化为。装置如图所示,分别是。 (3)、运用氧化还原反应规律,分析在上述实验中被氧化的产物中价态不同的原因:。18. 某小组根据硫元素的化合价,预测SO2既有还原性又有氧化性,并设计实验进行探究。(1)、I.探究SO2的还原性:向试管中通入足量SO2 (尾气处理装置已略) ,记录如下。
(3)、运用氧化还原反应规律,分析在上述实验中被氧化的产物中价态不同的原因:。18. 某小组根据硫元素的化合价,预测SO2既有还原性又有氧化性,并设计实验进行探究。(1)、I.探究SO2的还原性:向试管中通入足量SO2 (尾气处理装置已略) ,记录如下。装置
编号
试剂
实验现象

a
碘水
溶液的棕黄色褪去
b
Fe2(SO4)3溶液
a中反应的离子方程式为。
(2)、b中的实验现象为。将b所得溶液分成三份,进行如下实验。实验①向第一份溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀。
实验②向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
实验③向第三份溶液中先加入稀盐酸酸化,再加入BaCl2溶液,产生白色沉淀。
上述实验不能证明SO2与Fe3+发生了氧化还原反应的是 , 原因是。
(3)、II.探究SO2的氧化性:向试管中通入足量SO2 (尾气处理装置已略) ,记录如下。装置
编号
试剂
实验现象

c
3mol·L-1稀硫酸
始终无明显变化
d
3 mol·L-1稀盐酸
铜片表面变黑,溶液变为棕色
已知:i.水合Cu+既易被氧化也易被还原,因此水溶液中无法生成水合Cu+。
ii.CuCl为白色固体,难溶于水,可溶于c(Cl-)较大的溶液生成[CuCl3]2-。
证明d所得棕色溶液含有[CuCl3]2- :用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因是。
(4)、与c对比,d能发生反应的原因是。(5)、由实验II可推知,该条件下SO2、CuCl、Cu2+的氧化性由强到弱的顺序为。19. 水体中过量的抗生素会对环境造成极大危害,零价铁(Fe)及耦合技术在处理抗生素废水中应用广泛。(1)、I.还原法零价铁作为一种还原剂可以提供电子,水中的得电子生成(氢自由基),通过双键加成、单电子还原与抗生素发生反应。
氧化反应:。
还原反应:(电中性)。
(2)、与阿莫西林(抗生素的一种)发生多步反应,第一步如下图所示,请在图中标出阿莫西林断裂的化学键(参考示例“ ”),用“O”在中间产物圈出一个手性碳原子。
”),用“O”在中间产物圈出一个手性碳原子。 (3)、纳米零价铁5分钟去除甲硝唑接近100%,相同条件下非纳米零价铁去除率约为0%,试解释原因。(4)、II.氧化法
(3)、纳米零价铁5分钟去除甲硝唑接近100%,相同条件下非纳米零价铁去除率约为0%,试解释原因。(4)、II.氧化法酸性条件Fe可与溶解氧生成 , 和作用生成羟基自由基和 , 氧化抗生素。和生成的离子方程式是。
(5)、下图为酸性条件零价铁−电芬顿耦合法(电化学氧化法)原理示意图的一部分,左侧连接电源 , 结合阴极电极反应说明该法生成的原理。 20. 利用电极反应可探究物质氧化性、还原性的变化规律。
20. 利用电极反应可探究物质氧化性、还原性的变化规律。已知:酸性介质中,1mol/L不同电对的电极电势见下表。电极电势越高,其氧化型物质的氧化性越强;电极电势越低,其还原型物质的还原性越强。
电对(氧化型/还原型)
电极电势/V
0.771
1.776
0.695
1.224
0.536
回答下列问题:
(1)、I.探究的分解反应催化分解反应过程包括i、ii两步:
反应i: (未配平)
反应ii:
反应i的离子方程式为。
(2)、验证生成:反应过程中,加入溶液,产生蓝色沉淀,证明有生成。(3)、酸性条件下也可催化分解。结合表中数据判断,上述条件下、、的氧化性由强到弱的顺序为。(4)、Ⅱ.探究物质氧化性变化对电化学反应方向的影响用可逆反应设计电池,按图a装置进行实验,测得电压E()随时间t的变化如图b所示:

电池初始工作时,正极的电极反应式为。
(5)、某小组从还原型物质浓度、氧化性变化的角度分析图b,提出以下猜想:猜想1:增大,的氧化性减弱,正极的电极电势降低。
猜想2:减小,的氧化性增强,负极的电极电势升高。
①时间后,按图a装置探究,验证上述猜想的合理性,完成表中填空。
实验
实验操作
电压E/V
结论
i
往烧杯A中加入适量Fe
E0
猜想1成立
ii
往烧杯B中加入适量
E<0
猜想2成立
②有同学认为,上述实验不足以证明猜想1成立。利用上述反应,从化学平衡移动的角度解释猜想1不足以成立的理由。
③为进一步验证猜想1,进行实验Ⅱi,完成表中填空。
实验
实验操作
电压E/V
结论
iii
往烧杯A中加入适量
E<0
猜想1成立
结论:可逆氧化还原反应中,浓度的变化引起电对氧化性变化,从而改变电池反应方向。
21. 某小组探究氧化性、还原性的变化规律。资料:、
(1)、制备:将溶于冰水中,产生少量气泡,得溶液A。向A中加入过量稀 , 得溶液B。溶用冰水,目的是。(2)、检验:向溶液A、B中分别滴加适量酸性溶液。Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
发生还原反应:
发生氧化反应:。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含 , 对其产生的原因提出猜想:
猜想1.有氧化性,能被还原为
猜想2.有性,能与反应产生
猜想3.……
(3)、探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:序号
实验
试剂
现象
ⅰ
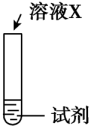
a
生成棕褐色固体,产生大量气泡
ⅱ
b
有少量气泡
ⅲ
溶液
有少量气泡
ⅲ是ⅱ和ⅰ的对照实验。
①X是。
②a是、b是。
③取ⅰ中棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体。
(4)、向一定浓度的溶液中加入少量 , 迅速产生大量气泡;随后加入 , 固体溶解,气泡产生明显减弱。结合方程式解释原因。(5)、综上,做氧化剂还是做还原剂,与等因素有关。22. 某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。(1)、浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中存在盐酸和MnO2。①反应的离子方程式是。
②电极反应式:
i还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii氧化反应:。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱.
ii随c(Cl-)降低,。
④补充实验证实了③中的分析。
实验操作
试剂
产物
I
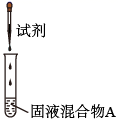
较浓H2SO4
有Cl2
II
a
有Cl2
III
a+b
无Cl2
a是 , b是。
(2)、利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是 , 从原子结构角度说明理由。(3)、根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是。(4)、Ag分别与1mol·L1的盐酸、氢溴酸、氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:。(5)、总结:物质氧化性和还原性变化的一般规律是。