【备考2024年】从巩固到提高 高考化学二轮微专题10 元素周期律
试卷更新日期:2024-02-22 类型:二轮复习
一、选择题
-
1. 为原子序数依次递增的短周期元素,最外层电子数均为奇数。只有X为金属元素,W的核外电子数等于Y的最外层电子数,且W、Y处在不同周期,Z的单质常温下为气体。下列说法错误的是( )A、X单质可与氢氧化钠溶液反应 B、分子与分子均为三角锥形 C、W的第一电离能比同周期相邻两元素的低 D、Z的最高价氧化物对应的水化物为强酸2. 某种快速充电器所使用的半导体材料是氮化镓(GaN),半导体材料还有GaY、GaZ、XW等。W、X、Y、Z在周期表中相对位置如下所示,其中W的一种同位素可用于文物年代测定。下列说法正确的是( )
W
X
Y
Ga
Z
A、原子半径:Z>Ga B、XW属于共价晶体 C、简单氢化物的稳定性:X>Y D、最高价氧化物对应水化物的酸性:Z>Y3. 某离子液体结构如下图所示。W、X、Y、Z原子序数依次增大,W、X和Y的原子序数之和为14,X和Y基态原子的核外未成对电子数之和为5,Z是第四周期元素。下列说法错误的是( )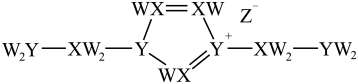 A、X、Z的简单氢化物均可溶于水 B、电负性: C、第一电离能: D、W、Y、Z可形成既含离子键又含共价键的化合物4. 化合物是一种无机盐药物。已知为原子序数依次递增的短周期元素,同主族,同周期,基态原子轨道总电子数是轨道电子数的4倍,基态原子的未成对电子数相等。下列说法正确的是( )A、离子半径: B、电负性: C、简单氢化物沸点: D、难溶于水5. 某含铜催化剂的阴离子的结构如图所示。是原子序数依次增大的短周期元素,其中位于同一周期,基态原子的价电子排布式为。下列说法错误的是( )
A、X、Z的简单氢化物均可溶于水 B、电负性: C、第一电离能: D、W、Y、Z可形成既含离子键又含共价键的化合物4. 化合物是一种无机盐药物。已知为原子序数依次递增的短周期元素,同主族,同周期,基态原子轨道总电子数是轨道电子数的4倍,基态原子的未成对电子数相等。下列说法正确的是( )A、离子半径: B、电负性: C、简单氢化物沸点: D、难溶于水5. 某含铜催化剂的阴离子的结构如图所示。是原子序数依次增大的短周期元素,其中位于同一周期,基态原子的价电子排布式为。下列说法错误的是( ) A、该阴离子中铜元素的化合价为 B、元素电负性: C、基态原子的第一电离能: D、均位于元素周期表的区6. 某种锂盐的结构如图所示,其阴离子由W、X、Y、Z四种同周期主族元素构成,X原子的最外层电子数是W原子的次外层电子数的3倍,化合物中除Li+外其它原子均满足8电子稳定结构。下列说法正确的是( )
A、该阴离子中铜元素的化合价为 B、元素电负性: C、基态原子的第一电离能: D、均位于元素周期表的区6. 某种锂盐的结构如图所示,其阴离子由W、X、Y、Z四种同周期主族元素构成,X原子的最外层电子数是W原子的次外层电子数的3倍,化合物中除Li+外其它原子均满足8电子稳定结构。下列说法正确的是( )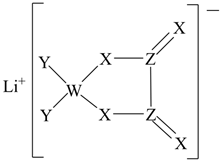 A、W位于第2周期IVA族 B、原子半径:Z>X>Y C、元素电负性:Y>Z>X D、最高化合价:Y>Z>W7. 前四周期主族元素X、Y 、Z、W的原子序数依次增大,它们形成的一种物质的结构如图所示,其中所有原子都形成了8电子稳定结构,四种元素中仅X、Y在同周期。下列推断中错误的是
A、W位于第2周期IVA族 B、原子半径:Z>X>Y C、元素电负性:Y>Z>X D、最高化合价:Y>Z>W7. 前四周期主族元素X、Y 、Z、W的原子序数依次增大,它们形成的一种物质的结构如图所示,其中所有原子都形成了8电子稳定结构,四种元素中仅X、Y在同周期。下列推断中错误的是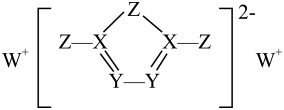 A、简单离子半径:W> Z> Y B、Z单质可溶于由X、Z形成的化合物中 C、第一电离能:Y> X D、Y与氧元素形成的化合物不止三种8. 一种由前20号主族元素组成的化合物A的结构如图所示,其中元素X、Y、Z、W的核电荷数依次增大,且位于不同周期。下列说法正确的是
A、简单离子半径:W> Z> Y B、Z单质可溶于由X、Z形成的化合物中 C、第一电离能:Y> X D、Y与氧元素形成的化合物不止三种8. 一种由前20号主族元素组成的化合物A的结构如图所示,其中元素X、Y、Z、W的核电荷数依次增大,且位于不同周期。下列说法正确的是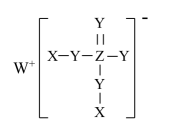 A、原子半径:W>Z>X>Y B、最简单氢化物的沸点:Z>Y C、W的最高价氧化物对应的水化物不能与A发生反应 D、Y与其他三种元素均可形成两种或两种以上的二元化合物9. 物质A因其受热分解(反应如下图所示)产生W2而受到新能源汽车行业的关注。X、Y形成的一种晶体的晶胞如图M,已知X的价电子构型为nsnnpn−1(n−1>0),Y的基态原子单电子数目在短周期中是最多的元素之一,且X、Y同周期。下列有关说法正确的是
A、原子半径:W>Z>X>Y B、最简单氢化物的沸点:Z>Y C、W的最高价氧化物对应的水化物不能与A发生反应 D、Y与其他三种元素均可形成两种或两种以上的二元化合物9. 物质A因其受热分解(反应如下图所示)产生W2而受到新能源汽车行业的关注。X、Y形成的一种晶体的晶胞如图M,已知X的价电子构型为nsnnpn−1(n−1>0),Y的基态原子单电子数目在短周期中是最多的元素之一,且X、Y同周期。下列有关说法正确的是 A、A分子是乙烷 B、最高价氧化物对应的水化物酸性:X>Y C、T分子所有原子共平面 D、M的化学式为X2Y710. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的核外电子数与X、Z的最外层电子数之和相等,Y元素的族序数与Z的最外层电子数之和等于X的原子序数,由X、W、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是 ( )
A、A分子是乙烷 B、最高价氧化物对应的水化物酸性:X>Y C、T分子所有原子共平面 D、M的化学式为X2Y710. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的核外电子数与X、Z的最外层电子数之和相等,Y元素的族序数与Z的最外层电子数之和等于X的原子序数,由X、W、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是 ( )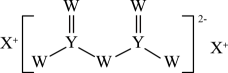 A、元素非金属性强弱的顺序为W>Y>Z B、W与X形成的二元化合物中阴阳离子数目之比为1:2 C、Y与W形成的二元化合物可用作半导体材料 D、电解饱和XZ水溶液可以制得X单质和Z单质11. 部分短周期元素的原子半径及主要化合价如表所示。
A、元素非金属性强弱的顺序为W>Y>Z B、W与X形成的二元化合物中阴阳离子数目之比为1:2 C、Y与W形成的二元化合物可用作半导体材料 D、电解饱和XZ水溶液可以制得X单质和Z单质11. 部分短周期元素的原子半径及主要化合价如表所示。元素
X
Y
Z
W
T
原子半径/nm
0.160
0.143
0.102
0.071
0.099
主要化合价
+2
+3
+6、-2
-1
-1
下列有关说法正确的是
A、第一电离能:X比Y小 B、简单离子半径:T>X>Y C、W的气态氢化物沸点比T气态氢化物沸点低 D、T的氧化物对应水化物的酸性一定比Z的氧化物对应水化物的酸性强12. 离子液体是室温下呈液态的离子化合物。由原子序数依次增大的短周期主族元素X、Y、Z、W、R组成的一种离子液体的结构如图所示,W的简单氢化物易液化,可用作制冷剂,R的简单阴离子含10个电子。下列说法正确的是 A、电负性:R>X>Z B、氢化物的沸点:R>Z C、分子YR3的空间构型为三角锥形 D、最高价含氧酸的酸性:W>Z13. 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是
A、电负性:R>X>Z B、氢化物的沸点:R>Z C、分子YR3的空间构型为三角锥形 D、最高价含氧酸的酸性:W>Z13. 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是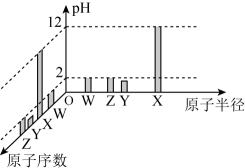 A、第一电离能: B、含有极性共价键和非极性共价键 C、工业上通过电解XZ的水溶液来制取X的单质 D、Z的单质具有强氧化性和漂白性14. R、X、Y、Z、M五种短周期主族元素,原子序数依次增大。基态R原子每个能级上电子数相等,基态X原子的价层电子排布为 , Y与M同主族,Z是同周期元素中原子半径最大的元素,Z核电荷数等于X、M原子的最外层电子数之和。下列说法不正确的是A、电负性:Y>X>R B、原子半径:Z>M>Y C、氢化物的沸点:R<Y D、Z与Y可形成两种常见的离子化合物,且晶体中的阴阳离子个数比均为1∶215. 石棉尾矿中主要含有 , 可用作润滑油添加剂。其中X、Y、Z、W为原子序数依次增大的短周期主族元素;X的原子半径在周期表中最小;Y的p轨道上自旋方向不同的电子数之比为3∶1;W是地壳中含量第二的元素。下列说法正确的是A、离子半径: B、Y和W形成的化合物不与酸反应 C、X和Z形成的化合物能与水反应生成一种不溶物和气体 D、X和Y两元素形成的化合物中,一定不含非极性键16. X、Y、Z、Q、T五种元素,原子序数依次增大。X原子轨道上有1个空轨道,Y原子的轨道只有一对成对电子,Z原子M层上有两个未成对电子,Q最高价氧化物对应水化物是常见的三元酸,微粒的价电子构型是。下列说法不正确的是A、第一电离能: B、X和Q各有一种单质的结构单元是正四面体 C、Y和Z形成的化合物为分子晶体 D、T与Y可形成阴离子17. 化合物甲()是制药工业和电池制造业等的原料,其组成元素W、X、Y、Z是原子序数依次增大的前四周期元素:其中W、X、Y为短周期主族元素,W是元素周期表中原子半径最小的元素,X、Y同周期,且X原子和Y原子的最外层电子数之比为2∶3,的电子数比Z原子的电子数多20。化合物甲在加热分解过程中剩余固体的质量随温度变化的曲线如图所示。
A、第一电离能: B、含有极性共价键和非极性共价键 C、工业上通过电解XZ的水溶液来制取X的单质 D、Z的单质具有强氧化性和漂白性14. R、X、Y、Z、M五种短周期主族元素,原子序数依次增大。基态R原子每个能级上电子数相等,基态X原子的价层电子排布为 , Y与M同主族,Z是同周期元素中原子半径最大的元素,Z核电荷数等于X、M原子的最外层电子数之和。下列说法不正确的是A、电负性:Y>X>R B、原子半径:Z>M>Y C、氢化物的沸点:R<Y D、Z与Y可形成两种常见的离子化合物,且晶体中的阴阳离子个数比均为1∶215. 石棉尾矿中主要含有 , 可用作润滑油添加剂。其中X、Y、Z、W为原子序数依次增大的短周期主族元素;X的原子半径在周期表中最小;Y的p轨道上自旋方向不同的电子数之比为3∶1;W是地壳中含量第二的元素。下列说法正确的是A、离子半径: B、Y和W形成的化合物不与酸反应 C、X和Z形成的化合物能与水反应生成一种不溶物和气体 D、X和Y两元素形成的化合物中,一定不含非极性键16. X、Y、Z、Q、T五种元素,原子序数依次增大。X原子轨道上有1个空轨道,Y原子的轨道只有一对成对电子,Z原子M层上有两个未成对电子,Q最高价氧化物对应水化物是常见的三元酸,微粒的价电子构型是。下列说法不正确的是A、第一电离能: B、X和Q各有一种单质的结构单元是正四面体 C、Y和Z形成的化合物为分子晶体 D、T与Y可形成阴离子17. 化合物甲()是制药工业和电池制造业等的原料,其组成元素W、X、Y、Z是原子序数依次增大的前四周期元素:其中W、X、Y为短周期主族元素,W是元素周期表中原子半径最小的元素,X、Y同周期,且X原子和Y原子的最外层电子数之比为2∶3,的电子数比Z原子的电子数多20。化合物甲在加热分解过程中剩余固体的质量随温度变化的曲线如图所示。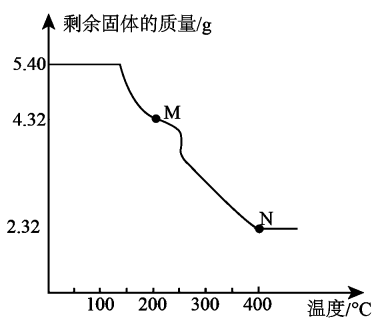
下列叙述正确的是
A、电负性:X>Y>W B、若M点时所得产物化学式为 , 则n为2 C、M到N的过程中只有一种气体生成 D、可由与足量酸性溶液反应得到18. X、Y、Z为原子序数依次增大的主族元素,Y与Z同主族。W为第四周期元素,最外层电子数为1,价层电子数为11,四种元素组成的某蓝色晶体基本结构单元的结构简式如下图所示。下列说法错误的是 A、原子半径Z>Y>X B、Y的第一电离能比同周期相邻元素小 C、单质W和Z在加热条件下生成化合物WZ D、Y的简单氢化物的热稳定性强于Z的简单氢化物
A、原子半径Z>Y>X B、Y的第一电离能比同周期相邻元素小 C、单质W和Z在加热条件下生成化合物WZ D、Y的简单氢化物的热稳定性强于Z的简单氢化物二、多选题
-
19. 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是
 A、W与X的化合物为极性分子 B、第一电离能 C、Q的氧化物是两性氧化物 D、该阴离子中含有配位键
A、W与X的化合物为极性分子 B、第一电离能 C、Q的氧化物是两性氧化物 D、该阴离子中含有配位键三、非选择题
-
20. 如图所示为元素周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)、表中属于d区的元素是 ( 填编号);④⑤⑥⑦⑧五种元素形成的稳定离子中,离子半径最小的是( 填离子符号)。(2)、表中元素①的6个原子与元素③的6个原子形成的某种环状分子的空间结构为 。(3)、某元素原子的价电子排布式为nsnnpn+1 , 该元素原子的最外层电子的孤电子对数为 , 该元素的第一电离能(填“大于”“等于”或“小于")原子的价电子排布式为nsnnpn+2的元素。(4)、某些不同族元素的性质也有一定的相似性,如表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:。(5)、上述10种元素形成的最高价氧化物对应水化物中,酸性最强的是(填化学式)。(6)、下列各组微粒的空间结构相同的是 (填序号)。①NH3和H2O②和H3O+③NH3和H3O+④O3 和SO2⑤CO2 和BeCl2⑥、和⑦BF3和AI2Cl6
21. 一种新型漂白剂(结构如图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,Z原子的核外电子排布为1s1 , W、Y、Z的最外层电子数之和等于X的最外层电子数,X基态原子核外有两个单电子,W、X对应的简单离子核外电子排布相同。
回答下列问题:
(1)、写出元素X在周期表中的位置。(2)、写出基态W离子的核外电子排布式:。(3)、Y元素基态原子的核外电子的运动状态有种,占据的原子轨道有个。(4)、W、X、Y电负性由大到小的顺序为(用元素符号表示)。22. 如图是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题。
(1)、元素p为26号元素,请写出其基态原子的电子排布式:。(2)、c、d、e、f四种元素的第一电离能由大到小的顺序为(填元素符号)。(3)、h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:。(4)、o、p两元素的部分电离能数据列于下表:元素
o
p
电离能kJ·mol-1
I1
717
759
I2
1509
1561
I3
3248
2957
比较两元素的I2、I3可知,气态基态o2+再失去一个电子比气态基态p2+再失去一个电子难。对此,你的解释是。
(5)、第三周期8种元素按单质熔点高低的顺序排列如图甲所示,其中电负性最大的是 (填图中的序号)。(6)、表中所列的某主族元素的电离能情况如图乙所示,则该元素是(填元素符号)。 23. 有八种短周期主族元素 ,其中 随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。 的最高价氧化物对应水化物溶液(浓度均为 )的 与原子序数的关系如图2所示。
23. 有八种短周期主族元素 ,其中 随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。 的最高价氧化物对应水化物溶液(浓度均为 )的 与原子序数的关系如图2所示。
根据上述信息回答下列问题:
(1)、g在元素周期表中的位置是。(2)、比较 的简单离子半径大小为<<(用离子符号表示); 的最高价氧化物对应的水化物酸性较强的是(用化学式表示)。(3)、下列可作为比较e和f金属性强弱的依据是___________(填字母)。A、测等浓度相应氯化物水溶液的 B、测两种元素单质的硬度和熔、沸点 C、比较单质作还原剂时失去的电子数目的多少 D、比较单质与同浓度盐酸反应的剧烈程度(4)、由元素 组成的剧毒化合物 不慎泄露时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为。24. 有8种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示,z、e、g、h的最高价氧化物对应水化物溶液(浓度均为0.01mol/L)的pH与原子序数的关系如图2所示。
根据判断出的元素回答下列问题:
(1)、f在周期表中的位置是;(2)、y、z、d的氢化物中最稳定的是(写化学式);(3)、x与y形成的多种化合物中,最简单的化合物的空间构型是;(4)、描述e的单质在空气中燃烧的现象:;(5)、锌元素对婴儿及青少年的智力和身体发育有重要的作用,被称为生命火花。利用恒电势电解e的溴化物(eBr)的水溶液间接将葡萄糖[ ]氧化为葡萄糖酸[ ],进而制取葡萄糖酸锌,装置如图所示。
①钛网与直流电源的极相连;
②石墨电极的电极反应式为;
③写出生成葡萄糖酸的化学反应方程式:。
25. 化学工业为疫情防控提供了强有力的物质支撑。氯及其化合物既是重要化工原料,又是广泛使用的高效灭菌消毒剂。回答下列问题:(1)、用氯气制备漂白液的离子方程式是。(2)、TCCA是一种高效含氯消毒漂白剂,贮运稳定,在水中释放有效氯时间长,应用于游泳池等公共场合,其分子结构如图所示:
已知:X、Y、Z、W属于原子序数递增的短周期元素,Z核外最外层电子数是电子层数的3倍。
①TCCA的分子式是。
②X、Y、Z对应简单氢化物中热稳定性最强的是(用氢化物的化学式表示)。
(3)、ClO2和NaClO2均为重要的杀菌消毒剂,将ClO2通入到NaOH和H2O2混合溶液中,可制备NaClO2。资料:NaClO2晶体易溶于水,难溶于乙醇。NaClO2饱和溶液在温度低于38 ℃时析出NaClO2·3H2O晶体,高于38 ℃时析出NaClO2晶体,高于60 ℃时NaClO2分解成NaClO3和NaCl。
① 写出由ClO2制备NaClO2的离子方程式。
② 从上述NaClO2溶液获得干燥的NaClO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后, , , 低于60℃干燥,得到NaClO2晶体 (补全实验步骤)。
26. 已知A、B、C、D、E、F为前4周期的6种元素,原子序数依次增大,其中A位于周期表中s区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn , B和E同主族,D原子的最外层电子数是其内层电子数的3倍;F元素位于元素周期表的第4行、第11列。试回答下列问题:(1)、基态F原子的核外电子排布式为 。(2)、下列关于B2A2的说法中正确的是(填选项序号)①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中σ键和π键数目比为1:1
③B2A2是含极性键和非极性键的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)、B、C、D三种元素第一电离能由大到小的顺序为(用元素符号表示)。(4)、C的简单气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型有(填选项符号)①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)、基态E原子的最高能层具有的原子轨道数为;B和E的最高价氧化物中,熔沸点较高的是(写化学式)。(6)、F单质的晶体堆积方式为面心立方最密堆积(如下图),其配位数为 ;若F的相对原子质量为M,它的晶胞棱长为a cm,则F晶体的密度为g·cm-3 。(阿伏加德罗常数为NA)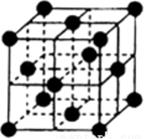 27. A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
27. A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。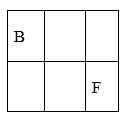 (1)、BF2的结构式为。(2)、D和F的氢化物中沸点较高的是(填化学式)。(3)、实验室制取G2气体的离子方程式为。(4)、在微电子工业中,C的最简单气态氢化物可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为。(5)、FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为。(6)、火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为。28. 、 、 、 、 五种元素的原子序数依次递增。已知:① 位于周期表中第四周期 族,其余的均为短周期主族元素:② 的氧化物是光导纤维的主要成分;③ 原子核外 层电子数为奇数;④ 是形成化合物种类最多的元素;⑤ 原子 轨道的电子数为4。请回答下列问题:(1)、写出一种 元素形成氢化物的化学式。(2)、在1个由 与 形成的 晶胞中(结构如图所示)所包含的 原子数目为个。
(1)、BF2的结构式为。(2)、D和F的氢化物中沸点较高的是(填化学式)。(3)、实验室制取G2气体的离子方程式为。(4)、在微电子工业中,C的最简单气态氢化物可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为。(5)、FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为。(6)、火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为。28. 、 、 、 、 五种元素的原子序数依次递增。已知:① 位于周期表中第四周期 族,其余的均为短周期主族元素:② 的氧化物是光导纤维的主要成分;③ 原子核外 层电子数为奇数;④ 是形成化合物种类最多的元素;⑤ 原子 轨道的电子数为4。请回答下列问题:(1)、写出一种 元素形成氢化物的化学式。(2)、在1个由 与 形成的 晶胞中(结构如图所示)所包含的 原子数目为个。 (3)、在[F(NH3)4]2+离子中, 的空轨道接受 的氮原子提供的形成配位键。(4)、常温下 、 和氢元素按原子数目1:1:2形成的气态常见物质 是(写名称), 物质分子中 原子轨道的杂化类型为 , 分子中 键的数目为 。(5)、 、 、 三种元素的第一电离能数值由小到大的顺序为(写元素符号)。29. 已知①~⑩号元素在周期表中的位置如图。试回答下列问题:
(3)、在[F(NH3)4]2+离子中, 的空轨道接受 的氮原子提供的形成配位键。(4)、常温下 、 和氢元素按原子数目1:1:2形成的气态常见物质 是(写名称), 物质分子中 原子轨道的杂化类型为 , 分子中 键的数目为 。(5)、 、 、 三种元素的第一电离能数值由小到大的顺序为(写元素符号)。29. 已知①~⑩号元素在周期表中的位置如图。试回答下列问题: (1)、上述元素中属于d区的有:(填编号)。(2)、②、③、④三种元素的第一电离能由大到小的顺序为(用元素符号表示)。(3)、请根据等电子体原理,写出由②、③两种元素组成的带有一个单位负电荷离子的电子式:。(4)、⑧号元素在元素周期表中的位置是 , ⑩号原子处于基态时核外电子排布式为 , 已知元素⑩和⑦的电负性分别为1.9和2.5,则⑩与⑦形成的化合物属于(填“离子”或“共价”)化合物。(5)、③号元素原子与①号元素原子形成的原子个数比为1∶3的分子X的空间构型为 , X在①与④形成的化合物Y中的溶解度很大,其主要原因是 , X分子中中心原子为杂化,X分子与⑩号元素对应的二价阳离子形成的配离子的化学式为。(6)、⑤号元素原子与Tl元素形成的晶体的晶胞如图所示,该物质的化学式为 , 若忽略Tl原子,则此晶体中⑤的空间结构跟哪种常见物质的晶体结构一样?。已知该晶体的密度为ρ g·cm-3 , 阿伏加德罗常数为NA , 则该晶体中晶胞边长为 pm(只写计算式)。
(1)、上述元素中属于d区的有:(填编号)。(2)、②、③、④三种元素的第一电离能由大到小的顺序为(用元素符号表示)。(3)、请根据等电子体原理,写出由②、③两种元素组成的带有一个单位负电荷离子的电子式:。(4)、⑧号元素在元素周期表中的位置是 , ⑩号原子处于基态时核外电子排布式为 , 已知元素⑩和⑦的电负性分别为1.9和2.5,则⑩与⑦形成的化合物属于(填“离子”或“共价”)化合物。(5)、③号元素原子与①号元素原子形成的原子个数比为1∶3的分子X的空间构型为 , X在①与④形成的化合物Y中的溶解度很大,其主要原因是 , X分子中中心原子为杂化,X分子与⑩号元素对应的二价阳离子形成的配离子的化学式为。(6)、⑤号元素原子与Tl元素形成的晶体的晶胞如图所示,该物质的化学式为 , 若忽略Tl原子,则此晶体中⑤的空间结构跟哪种常见物质的晶体结构一样?。已知该晶体的密度为ρ g·cm-3 , 阿伏加德罗常数为NA , 则该晶体中晶胞边长为 pm(只写计算式)。 30. A,B,C,D,E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。(1)、E元素形成的氧化物对应的水化物的化学式为。(2)、元素C、D、E形成的简单离子半径大小关系是(用离子符号表示)。(3)、用电子式表示化合物D2C的形成过程:。C、D还可形成化合物D2C2 , D2C2中含有的化学键类型是。(4)、由A、B、C三种元素形成的离子化合物的化学式为 , 它与强碱溶液共热,发生反应的离子方程式是。(5)、某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为(化学式用具体的元素符号表示)。
30. A,B,C,D,E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。(1)、E元素形成的氧化物对应的水化物的化学式为。(2)、元素C、D、E形成的简单离子半径大小关系是(用离子符号表示)。(3)、用电子式表示化合物D2C的形成过程:。C、D还可形成化合物D2C2 , D2C2中含有的化学键类型是。(4)、由A、B、C三种元素形成的离子化合物的化学式为 , 它与强碱溶液共热,发生反应的离子方程式是。(5)、某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为(化学式用具体的元素符号表示)。
-