【备考2024年】从巩固到提高 高考化学二轮微专题09 常见金属工艺流程
试卷更新日期:2024-02-22 类型:二轮复习
一、选择题
-
1. 从废铅膏(主要成分为、、和 , 含少量、等元素)中获取高纯的工艺流程如图。下列说法错误的是
 A、“煅烧”过程利用沸点低进行分离提纯 B、“溶浸”过程主要用于氧化 C、“溶铅”过程的离子方程式为 D、“沉铅”过程的化学方程式为2. 稀土永磁材料——高性能钕铁硼合金为新能源汽车提供核心原材料。从制钕铁硼的废料中提取氧化钕(Nd2O3)的工艺流程如图1所示,草酸钕晶体的热重曲线如图2所示。
A、“煅烧”过程利用沸点低进行分离提纯 B、“溶浸”过程主要用于氧化 C、“溶铅”过程的离子方程式为 D、“沉铅”过程的化学方程式为2. 稀土永磁材料——高性能钕铁硼合金为新能源汽车提供核心原材料。从制钕铁硼的废料中提取氧化钕(Nd2O3)的工艺流程如图1所示,草酸钕晶体的热重曲线如图2所示。
已知:ⅰ.与酸反应生成离子,草酸钕晶体[]的摩尔质量是;
ⅱ.生成 , 开始沉淀时 , 完全沉淀时
生成 , 开始沉淀时 , 完全沉淀时
下列说法错误的是( )
A、气体1的主要成分是 , 滤渣1是硼和其他不溶性杂质 B、“氧化”时会发生反应: C、若“调”与“氧化”顺序颠倒,的利用率无影响 D、由图2可知,时剩余固体的主要成分是3. 某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4。某实验小组以废催化剂为原料,进行回收利用。设计实验流程如图: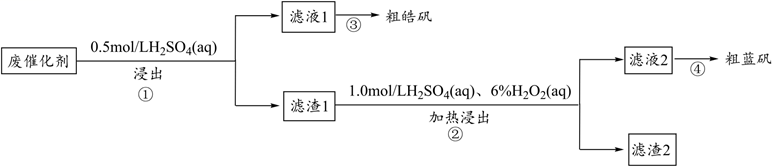 已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是( )A、步骤①操作中,生成的气体可用碱液吸收 B、滤液1中是否含有Fe2+ , 可以选用KSCN和新制的氯水检验 C、滤渣1成分是SiO2和CuS,滤渣2成分一定是SiO2 D、步骤④要滴加稀硫酸防止CuSO4水解4. 某废催化剂含 、 、 及少量的 .某实验小组以该废催化剂为原料,回收锌和铜,设计实验流程如图:
已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是( )A、步骤①操作中,生成的气体可用碱液吸收 B、滤液1中是否含有Fe2+ , 可以选用KSCN和新制的氯水检验 C、滤渣1成分是SiO2和CuS,滤渣2成分一定是SiO2 D、步骤④要滴加稀硫酸防止CuSO4水解4. 某废催化剂含 、 、 及少量的 .某实验小组以该废催化剂为原料,回收锌和铜,设计实验流程如图:
下列说法正确的是( )
A、步骤①操作中,生成的气体可用 溶液吸收 B、检验滤液1中是否含有 ,可以选用 和新制的氯水 C、步骤③和④操作中,均采用蒸发结晶方式从溶液中获得溶质 D、滤渣2成分是5. 金属材料的发展极大地促进了人类社会的文明程度。如图是两种金属及其化合物的转化关系。下列说法错误的是( ) A、根据反应③可知氧化性:Fe3+>H2O2 B、向X溶液中滴入K3[Fe(CN)6]溶液,生成蓝色沉淀 C、反应③中稀硫酸仅表现酸性 D、反应①的离子方程式为Cu+H2O2+2H+=Cu2++2H2O6. 废旧电池的回收利用对保护环境、节约资源意义重大。某化学兴趣小组利用废旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO,部分实验过程如图所示。下列叙述错误的是( )
A、根据反应③可知氧化性:Fe3+>H2O2 B、向X溶液中滴入K3[Fe(CN)6]溶液,生成蓝色沉淀 C、反应③中稀硫酸仅表现酸性 D、反应①的离子方程式为Cu+H2O2+2H+=Cu2++2H2O6. 废旧电池的回收利用对保护环境、节约资源意义重大。某化学兴趣小组利用废旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO,部分实验过程如图所示。下列叙述错误的是( ) A、“溶解”过程中发生的反应有2Cu+O2+4H+=2Cu2++2H2O B、“溶解”操作中的空气可以用双氧水代替 C、“调节pH”过程中NaOH溶液的作用是使Cu2+转化为Cu(OH)2 D、“过滤II”所得滤渣只需洗涤,无需干燥7. 利用废铝箔(主要成分为 ,含少量 、 等)制明矾 的一种工艺流程如图:
A、“溶解”过程中发生的反应有2Cu+O2+4H+=2Cu2++2H2O B、“溶解”操作中的空气可以用双氧水代替 C、“调节pH”过程中NaOH溶液的作用是使Cu2+转化为Cu(OH)2 D、“过滤II”所得滤渣只需洗涤,无需干燥7. 利用废铝箔(主要成分为 ,含少量 、 等)制明矾 的一种工艺流程如图:
下列说法错误的是( )
A、①中生成了 : B、操作 是过滤,以除去难溶于 溶液的杂质 C、②③中加入稀硫酸的作用均是除去杂质 D、由④可知,室温下明矾的溶解度小于 和 的溶解度8. 金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成分为FeO·Cr2O3 , 含有少量Al2O3)为原料制备金属铬的流程如下图。下列说法错误的是( ) A、①中需持续吹入空气作氧化剂 B、②中需加入过量稀硫酸 C、③中发生了置换反应 D、溶液A为橙色
A、①中需持续吹入空气作氧化剂 B、②中需加入过量稀硫酸 C、③中发生了置换反应 D、溶液A为橙色二、非选择题
-
9. 钴属于稀缺性金属。利用“微波辅助低共熔溶剂”浸取某废旧锂离子电池中钴酸锂粗品制备产品,实现资源的循环利用。主要工艺流程如下:

已知:①氯化胆碱是一种铵盐;
②在溶液中常以(蓝色)和(粉红色)形式存在;
③时,。
回答下列问题:
(1)、中的化合价为。(2)、下图为“微波共熔”中氯化胆碱-草酸和粗品以不同的液固比在下微波处理后锂和钴的浸取率图,则最佳液固比为。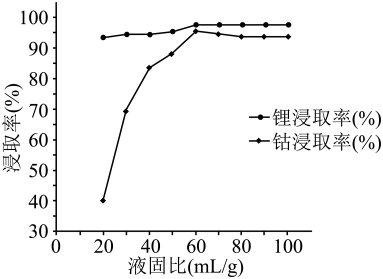 (3)、“水浸”过程中溶液由蓝色变为粉红色,该变化的离子方程式为。(4)、时,“沉钴”反应完成后,溶液 , 此时。(5)、“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是。(6)、“高温烧结”中需要通入空气,其作用是。(7)、锂离子电池正极材料在多次充放电后由于可循环锂的损失,结构发生改变生成 , 导致电化学性能下降。
(3)、“水浸”过程中溶液由蓝色变为粉红色,该变化的离子方程式为。(4)、时,“沉钴”反应完成后,溶液 , 此时。(5)、“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是。(6)、“高温烧结”中需要通入空气,其作用是。(7)、锂离子电池正极材料在多次充放电后由于可循环锂的损失,结构发生改变生成 , 导致电化学性能下降。①晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为(用离子符号表示)。
②使用和溶液可以实现的修复,则修复过程中的化学反应方程式为。
 10. 是一种重要的含锶化合物,广泛应用于许多领域。以天青石(主要成分为)为原料制备的一种工艺方法如下:
10. 是一种重要的含锶化合物,广泛应用于许多领域。以天青石(主要成分为)为原料制备的一种工艺方法如下:
天青石主要元素质量分数如下:
元素
质量分数()
36.4
2.0
4.0
0.5
5.0
。
回答下列问题:
(1)、天青石与碳粉在一定投料比下“煅烧”生成和碳氧化物,据矿样成分分析结果计算得出,生成、时失重率分别为、 , 实际热重分析显示失重率为32.6%,则“煅烧”中主要生成的碳氧化物为(填“”或“”)。(2)、“煅烧”过程中还可能产生少量对环境有危害的气体,化学式为和。(3)、“水浸”后滤渣的主要成分除和C外,还有两种氧化物,化学式为和。(4)、“水浸”时需加热,与热水作用后的溶液呈碱性的主要原因为(用化学方程式表示)(5)、“水浸”后的滤液中 , “除杂”过程中(忽略溶液引起的体积变化),为使不沉淀,应控制溶液中 , 每升滤液中篇加入溶液的体积。(6)、“沉锶”过程中,可溶性发生反应的离子方程式为。11. 钢渣是钢铁行业的固体废弃物,含有和等物质。一种以钢渣粉为原料固定并制备的工艺流程如图所示。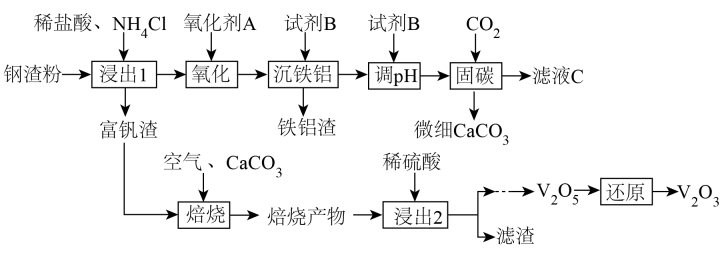
已知钢渣中元素质量分数为在稀盐酸和混合溶液中不易被浸出。该工艺条件下,有关金属离子开始沉淀和沉淀完全的如下表所示:
金属离子
开始沉淀的
1.9
7.2
3.5
12.4
沉淀完全的
2.9
8.2
5.1
13.8
回答下列问题:
(1)、浸出1过程生成的“包裹”在钢渣表面形成固体膜,阻碍反应物向钢渣扩散。提高浸出率的措施有(除粉碎外,举1例)。该浸出过程不使用稀硫酸代替稀盐酸的原因是。(2)、为避免引入杂质离子,氧化剂应为(举1例)。(3)、滤液的溶质可循环利用,试剂应为。(4)、若的浸出率为 , 理论上1吨钢渣在“固碳”中可固定。(5)、富钒渣焙烧可生成钒钙盐,不同钒钙盐的溶解率随变化如图所示。已知浸出2的pH约为2.5,则应控制焙烧条件使该钒钙盐为。该培烧反应的化学方程式是。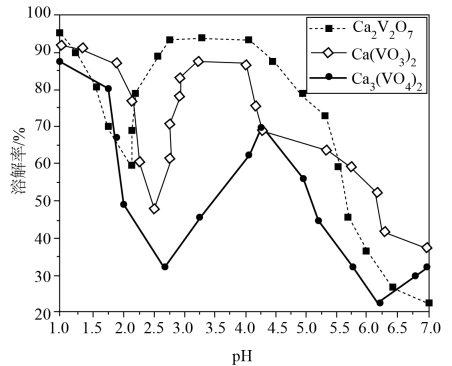 (6)、微细碳酸钙广泛应用于医药、食品等领域,某种碳酸钙晶胞如图所示。已知 , 该晶体密度为(列出计算式,阿伏加德罗常数的值为)。
(6)、微细碳酸钙广泛应用于医药、食品等领域,某种碳酸钙晶胞如图所示。已知 , 该晶体密度为(列出计算式,阿伏加德罗常数的值为)。 12. 钼()及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以和形式存在,从镍钼矿中分离钼,并得到的一种工艺流程如下:
12. 钼()及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以和形式存在,从镍钼矿中分离钼,并得到的一种工艺流程如下: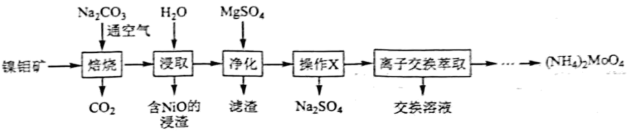
回答下列问题:
(1)、位于元素周期表第周期第族。中钼元素的化合价为。(2)、“焙烧”中生成的化学方程式为。(3)、用量对钼浸出率和浸取液中浓度的影响如图1所示,分析实际生产中选择用量为理论用量1.2倍的原因:。 (4)、的溶解度曲线如图2所示,为充分分离 , 工艺流程中的“操作”应为____(填标号)。
(4)、的溶解度曲线如图2所示,为充分分离 , 工艺流程中的“操作”应为____(填标号)。 A、蒸发结晶 B、低温结晶 C、蒸馏 D、萃取(5)、为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“”步骤。(6)、分解可得。高温下,用铝粉还原得到金属钼的化学方程式为。13. 层状结构薄膜能用于制作电极材料。薄膜由辉钼矿(主要含及少量FeO、)制得后再与S经气相反应并沉积得到,其流程如下。
A、蒸发结晶 B、低温结晶 C、蒸馏 D、萃取(5)、为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“”步骤。(6)、分解可得。高温下,用铝粉还原得到金属钼的化学方程式为。13. 层状结构薄膜能用于制作电极材料。薄膜由辉钼矿(主要含及少量FeO、)制得后再与S经气相反应并沉积得到,其流程如下。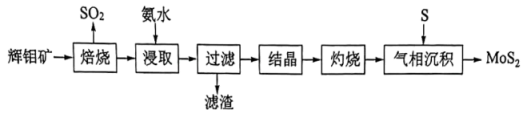
回答下列问题:
(1)、“焙烧”产生的用溶液吸收生成的离子方程式为。(2)、“焙烧”后的固体用氨水“浸取”得到重钼酸铵溶液,为提高“浸取”速率,可采用的措施是(举一例)。(3)、“灼烧”过程中需回收利用的气体是(填化学式)。(4)、在650℃下“气相沉积”生成的反应需在特定气流中进行,选用Ar而不选用形成该气流的原因是。(5)、层状晶体与石墨晶体结构类似,层状的晶体类型为。将嵌入层状充电后得到的可作电池负极,该负极放电时的电极反应式为。结合原子结构分析,能嵌入层间可能的原因是。14. 利用含锌废料(主要成分是氧化锌,含有少量铁、铝、铜、锰等金属氧化物或盐)制备氯化锌的一种工艺流程如下: (1)、为了提高盐酸浸取效率,可采取的措施有。(2)、浸取温度不宜超过60℃,原因是。(3)、为优化工艺流程,盐酸浸取后直接进行高锰酸钾氧化除杂。结合下列图表选择浸取工艺最佳范围为 , 理由是。
(1)、为了提高盐酸浸取效率,可采取的措施有。(2)、浸取温度不宜超过60℃,原因是。(3)、为优化工艺流程,盐酸浸取后直接进行高锰酸钾氧化除杂。结合下列图表选择浸取工艺最佳范围为 , 理由是。A.1.5~2.0 B.2.0~3.0 C.3.0~4.0 D.4.5~5.0

金属离子
开始沉淀的
沉淀完全的
6.8
8.3
3.7
4.7
1.8
2.8
5.2
6.7
8.6
10.1
6.7
8.2
(4)、滤渣的主要成分有、和 , 该工艺中去除锰的离子方程式为。(5)、最适宜使用的还原剂是 , 理由为。(6)、氯化锌溶液在蒸发浓缩过程中如操作不当将有碱式盐生成,该反应方程式为 , 产品中含量与蒸发温度关系如图所示,工艺要求含量不超过2.30%,降低产品中含量的方法有。 15. 碱式氧化镍(NiOOH)是镍氢电池的正极材料,工业上可由铜冶炼过程中产生的粗硫酸镍废液(含有Cu2+、Fe2+、Al3+、Ca2+、H3AsO3等杂质微粒)为原料制备,某兴趣小组模拟该制备过程并设计如下流程:
15. 碱式氧化镍(NiOOH)是镍氢电池的正极材料,工业上可由铜冶炼过程中产生的粗硫酸镍废液(含有Cu2+、Fe2+、Al3+、Ca2+、H3AsO3等杂质微粒)为原料制备,某兴趣小组模拟该制备过程并设计如下流程:
已知:Ksp(FeAsO4)=5.7×10-21 , H3AsO3的还原性比Fe2+强。
回答下列问题:
(1)、“萃取”时需充分振荡,目的是。(2)、“氧化1”中H2O2的作用是 , 若该废液中H3AsO3和Fe2+的浓度分别是0.02 mol·L-1和0.12 mol·L-1 , 除去砷后的废液中c()=mol·L-1(不考虑反应过程中溶液体积的微小变化)(3)、“沉钙”时,若溶液酸度过高,Ca2+沉淀不完全,原因是。(4)、“氧化2”反应的离子方程式为。(5)、“洗涤”时,检验产品是否洗涤干净的方法是。(6)、已知某镍氢电池的离子导体为KOH溶液,电池反应为MH+NiOOHM+Ni(OH)2 , 则放电时,OH-移向电极(填“MH”或“NiOOH”),充电时NiOOH电极上的电极反应式为。16. 镁菱锌矿(主要成分为ZnCO3、MgCO3等,含有少量FeCO3、CaCO3等杂质)可用于生产媒染剂、防腐剂ZnSO4·7H2O以及耐火材料MgO。制备工艺流程如下:
已知:65℃时Ksp[Mg(OH)2]= 1.8×10-11 Ksp[Zn(OH)2]=2.0×10-17 Kw=10-13 lg2≈0.3
回答下列有关问题:
(1)、浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是 , 还可采用(写出一种)等方式达到此目的。(2)、“氧化除铁”在90℃,控制溶液pH在4.0-5.0,得到针铁矿渣的离子方程式为。(3)、“沉锌”前,滤液(65℃)中含有0.50 mol·L-1 Zn2+和1.8 mol·L-1 Mg2+ , 保持该温度,则应加入氨水调节pH在范围(c≤1.0×10-5mol·L-1 , 沉淀完全)。利用平衡移动原埋说明“沉锌”时加入氨水的作用是。(4)、“酸解”后获得ZnSO4·7H2O的操作依次经过蒸发浓缩、、过滤、洗涤、干燥。制得的ZnSO4·7H2O在烘干时需减压烘干的原因是。(5)、“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀。写出“灼烧”步骤的化学方程式。17. 为充分利用金属资源,某研究团队利用生产钴电极材料生的铜锰渣(含、、等物质)回收金属的一种流程如图所示:
回答下列问题:
(1)、、中Mn元素的化合价为 .(2)、写出铜锰渣中与稀硫酸反应的化学方程式 .(3)、研究团队认为该工艺可能利用了如下反应原理沉淀滤液1中的Cu2+: , . 析出的Cu沉淀中还混有少量的S单质,原因是(用离子方程式解释).(4)、依据反应萃取滤液2中的并进行操作Ⅱ,操作Ⅱ的名称是;所得有机相中加入硫酸能进行反萃取的原因是(结合平衡移动原理解释).(5)、控制反应温度为 , 向滤液1中加入溶液,不同金属沉淀率与用量倍数的关系如下图所示.
当用量倍数为2.0时,水相中的金属阳离子主要含、(填离子符号).
(6)、用作电池材料,使用KOH溶液作电解液,充电时转化为的电极反应式为 .18. 锂在新能源等领域应用广泛。从粉煤灰(含Al2O3、Fe2O3、Li2O、SiO2等)中回收提取铝、锂元素的化合物的流程如图所示:
已知:碳酸锂的溶解度(g·L-1)见表。
温度/℃
0
10
20
30
40
50
60
80
100
Li2CO3
1.54
1.43
1.33
1.25
1.17
1.08
1.01
0.85
0.72
回答下列问题
(1)、“粉碎”的目的是 , 滤渣1的成分主要是。(填化学式)(2)、“调pH”的目的是沉淀Fe3+、Al3+。当离子浓度≤1.0×10-5mol·L-1时表示该离子沉淀完全。常温下,如果溶液pH=4,Fe3+、Al3+ (填“能”或“否”)均沉淀完全,若沉淀完全,此时溶液中c(Fe3+)、c(Al3+)之比为。(已知:Ksp[Fe(OH)3]=8.0×10-38 , Ksp[Al(OH)3]=2.0×10-33)(3)、从滤渣2中分离出Al(OH)3 , 可用如图所示方法,试剂X是 , “步骤2”中主要发生的离子反应方程式有OH-+CO2=HCO、。 (4)、“沉锂”中的“一系列操作”依次为蒸发浓缩、、洗涤、干燥。检验母液主要溶质的阴离子所用的试剂为。母液的用途(任写一种)。(5)、太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图所示。电池总反应式为LixC6 + Li1−xFePO4 LiFePO4 + 6C。试写出充电时,该电池正极材料上的反应式:。
(4)、“沉锂”中的“一系列操作”依次为蒸发浓缩、、洗涤、干燥。检验母液主要溶质的阴离子所用的试剂为。母液的用途(任写一种)。(5)、太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图所示。电池总反应式为LixC6 + Li1−xFePO4 LiFePO4 + 6C。试写出充电时,该电池正极材料上的反应式:。 19. 从铬锰矿渣(主要成分为、MnO,含少量、、)中分离铬、锰的一种工艺流程如图所示:
19. 从铬锰矿渣(主要成分为、MnO,含少量、、)中分离铬、锰的一种工艺流程如图所示:
已知:焙烧时MnO不发生反应。
回答下列问题:
(1)、加快酸浸速率的措施有(写两条)。(2)、滤渣2的成分是(写化学式)。(3)、焙烧中转化为的化学方程式为。(4)、某温度下,Cr(Ⅲ)、Mn(Ⅱ)的沉淀率与pH关系如图所示,则“沉铬”过程最佳的pH为。计算“沉铬”后滤液中c(Cr3+)为mol/L[已知在此条件下,KW=1×10-14 , Ksp(Cr(OH)3)=1×10-30] (5)、流程中加入Na2S2O3的作用为: , “转化”的离子方程式为。20. 钪(Sc)元素在国防、航天、激光、核能、医疗等方面有广泛应用。我国某地的矿山富含铜多金属矿(主要含Cu2S、Sc2S3、FeS、CaS和SiO2),科研人员从矿石中综合回收金属钪的工艺流程设计如下:
(5)、流程中加入Na2S2O3的作用为: , “转化”的离子方程式为。20. 钪(Sc)元素在国防、航天、激光、核能、医疗等方面有广泛应用。我国某地的矿山富含铜多金属矿(主要含Cu2S、Sc2S3、FeS、CaS和SiO2),科研人员从矿石中综合回收金属钪的工艺流程设计如下:
已知:①"萃取"时发生反应有:Sc3++3H2A2(有机液) Sc(HA2)3(有机相)+3H+Fe3++3H2A2(有机液) Fe(HA2)3+3H+
②常温下,“萃取”前溶液中c(Sc3+)=0.60mol·L-1 , Ksp[Sc(OH)3]=6.0×10-31;请回答下列问题:
(1)、“加热酸溶”产生的气体直接排放到空气中,容易形成;滤渣I的主要成分为。(2)、溶解FeS发生反应的化学方程式为。(3)、“还原”工序的目的为。(4)、“萃取"过程中有机试剂的Se3+萃取率与“萃取”前溶液pH的关系如图。当pH大于a时随着pH增大Sc3+萃取率减小,a=。 (5)、“沉钪"过程中发生反应的离子方程式为。过量焦炭、Sc2O3、Cl2混合物在高温下反应的化学方程式为。(6)、“电解”过程中,用石墨和液态锌作电极,KCl、LiCl、ScCl3熔融物作电解液,钪在电极上得到(选填:石墨或液态锌)。21. 镍及其化合物在工业上有广泛应用,红土镍矿是镍资源的主要来源。以某地红土镍矿[主要成分Mg3Si2O5(OH)4、Fe2MgO4、NiO、FeO、Fe2O3]为原料,采用硫酸铵焙烧法选择性提取镍,可减少其他金属杂质浸出,工艺流程如图所示。
(5)、“沉钪"过程中发生反应的离子方程式为。过量焦炭、Sc2O3、Cl2混合物在高温下反应的化学方程式为。(6)、“电解”过程中,用石墨和液态锌作电极,KCl、LiCl、ScCl3熔融物作电解液,钪在电极上得到(选填:石墨或液态锌)。21. 镍及其化合物在工业上有广泛应用,红土镍矿是镍资源的主要来源。以某地红土镍矿[主要成分Mg3Si2O5(OH)4、Fe2MgO4、NiO、FeO、Fe2O3]为原料,采用硫酸铵焙烧法选择性提取镍,可减少其他金属杂质浸出,工艺流程如图所示。
已知:①2[Mg3Si2O5(OH)4]+9(NH4)2SO43(NH4)2Mg2(SO4)3+12NH3↑+4SiO2+10H2O↑;
②2Fe2MgO4+15(NH4)2SO4(NH4)2Mg2(SO4)3+16NH3↑+4(NH4)3Fe(SO4)3+8H2O↑
③常温下,NiSO4易溶于水,NiOOH不溶于水。
(1)、“焙烧”前将“矿样”与(NH4)2SO4混合研磨的目的是。(2)、经分析矿样中大部分铁仍以氧化物形式存在于“浸渣”中,只有部分FeO在空气中焙烧时与(NH4)2SO4反应生成Fe2(SO4)3 , 该反应的化学方程式为 , “浸渣"的主要成分除铁的氧化物外还有(填化学式)。(3)、焙烧温度对浸出率的影响如图所示,最佳焙烧温度是____(填序号)左右。 A、300℃ B、350℃ C、400℃ D、600℃(4)、若残留在浸出液中的铁完全转化为黄铵铁矾除去,“除铁”时通入NH3调节溶液pH的范围是。该工艺条件下,Ni2+生成Ni(OH)2沉淀,Fe3+生成Fe(OH)3或黄铵铁矾沉淀定,开始沉淀和沉淀完全时的pH如下表:
A、300℃ B、350℃ C、400℃ D、600℃(4)、若残留在浸出液中的铁完全转化为黄铵铁矾除去,“除铁”时通入NH3调节溶液pH的范围是。该工艺条件下,Ni2+生成Ni(OH)2沉淀,Fe3+生成Fe(OH)3或黄铵铁矾沉淀定,开始沉淀和沉淀完全时的pH如下表:沉淀物
Ni(OH)2
Fe(OH)3
黄铵铁矾
开始沉淀时的pH
7.1
2.7
1.3
沉淀完全(c=1×10-5 mol/L)时的pH
9.2
3.7
2.3
(5)、“沉镍"时pH调为8.0,滤液中Ni2+浓度约为mol/L(100.4≈2.5)。(6)、流程中(填化学式)可循环使用,减少污染。(7)、NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式是。22. 砷盐净化工艺成功应用于冶炼锌工业,加快了我国锌冶炼技术改造步伐。从砷盐净化渣(成分为Cu、 、Zn、ZnO、Co、Ni等)中回收有价值的金属具有重要意义。
回答下列问题:
(1)、“选择浸Zn”过程中,为了提高Zn的浸出率可采取的措施有(写两点),其他条件不变时,Zn和Ni浸出率随pH变化如下图所示,则“选择浸Zn”过程中,最好控制溶液的pH为。 (2)、“氧化浸出“时, 被氧化为 的化学方程方式为;此过程温度不能过高的原因。(3)、用NaOH溶液调节氧化浸出液至弱酸性,再加入 进行“沉铜”,得到难溶性的 ,则“沉铜”的离子方程式为。(4)、操作Ⅰ所用到的玻璃仪器有 , 已知煅烧 时温度不同,产物不同。400℃时在空气中充分煅挠,得到的钴的氧化物的质量为4.82g, 的体积为2.688L(标准状况下),则此时所得钴的氧化物的化学式为。(5)、已知常温下,相关金属氢氧化物开始沉淀和沉淀完全(离子浓度 视为沉淀完全)的pH如下表所示:
(2)、“氧化浸出“时, 被氧化为 的化学方程方式为;此过程温度不能过高的原因。(3)、用NaOH溶液调节氧化浸出液至弱酸性,再加入 进行“沉铜”,得到难溶性的 ,则“沉铜”的离子方程式为。(4)、操作Ⅰ所用到的玻璃仪器有 , 已知煅烧 时温度不同,产物不同。400℃时在空气中充分煅挠,得到的钴的氧化物的质量为4.82g, 的体积为2.688L(标准状况下),则此时所得钴的氧化物的化学式为。(5)、已知常温下,相关金属氢氧化物开始沉淀和沉淀完全(离子浓度 视为沉淀完全)的pH如下表所示:开始沉淀的pH
完全沉淀的pH
8.0
10.0
7.5
9.5
若将沉铜后的溶液调节至 ,此时溶液中 。
23. 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝( )、钼( )、镍( )等元素的氧化物,一种回收利用工艺的部分流程如下: 已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。
已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。①生成 的离子方程式为。
②若条件控制不当, 也会沉淀。为避免 中混入 沉淀,溶液中 (列出算式)时,应停止加入 溶液。
(4)、①滤液Ⅲ中,主要存在的钠盐有 和 , 为。②往滤液Ⅲ中添加适量 固体后,通入足量(填化学式)气体,再通入足量 ,可析出 。
(5)、高纯 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层 (砷化镓)反应。
①该氧化物为。②已知: 和 同族, 和 同族。在 与上层 的反应中, 元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为。
24. 锂、铍等金属广泛应用于航空航天、核能和新能源汽车等高新产业。一种从萤石矿(主要含BeO、 、 及少量 、 、FeO、 、 )中提取铍的工艺如图: 已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,温度升高,溶解度增大。
已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,温度升高,溶解度增大。回答下列问题:
(1)、铍的化学性质与铝相似,写出BeO溶于NaOH溶液的化学方程式。(2)、“微波焙烧”使矿物内部变得疏松多孔,目的是。(3)、“浸出渣”的主要成分是。(4)、“除铁”中发生反应的离子方程式: 、。(5)、“除铝”时,溶液的pH越小,铝的去除率(填“越高”、“越低”或“不变”)。利用“除铝”所得苯甲酸铝沉淀再生苯甲酸的方案为:将苯甲酸铝沉淀溶于热的稀硫酸中,。(6)、由油酸铍制备BeO的方法是。