【备考2024年】从巩固到提高 高考化学二轮微专题07 铁及其化合物
试卷更新日期:2024-02-22 类型:二轮复习
一、选择题
-
1. 高铁酸钠是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为 , 杂质有及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是( )
 A、“碱浸”可以除去废铁屑中的油脂 B、“滤渣”的主要成分是和 C、“操作Ⅰ”通入的空气可以用溶液代替 D、若流程改为先“氧化”后“调”,可能会生成2. 实验室合成高铁酸钾()的过程如下图所示。下列说法错误的是( )
A、“碱浸”可以除去废铁屑中的油脂 B、“滤渣”的主要成分是和 C、“操作Ⅰ”通入的空气可以用溶液代替 D、若流程改为先“氧化”后“调”,可能会生成2. 实验室合成高铁酸钾()的过程如下图所示。下列说法错误的是( ) A、气体a的主要成分为 B、沉淀b的主要成分为 C、中的化合价为 D、反应2为3. 实验小组用过量溶液处理覆铜板得到浸出液,并对其中的物质进行回收,流程如下。下列有关说法正确的是( )
A、气体a的主要成分为 B、沉淀b的主要成分为 C、中的化合价为 D、反应2为3. 实验小组用过量溶液处理覆铜板得到浸出液,并对其中的物质进行回收,流程如下。下列有关说法正确的是( )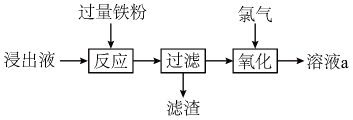 A、浸出液呈中性 B、滤渣只有铜粉 C、用KSCN溶液检验是否“氧化”完全 D、溶液a回收后可用于处理覆铜板4. 用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉.对加入铁粉充分反应后的溶液分析合理的是( )A、若无固体剩余,则溶液中一定有Fe3+ B、若有固体存在,则溶液中一定有Fe2+ C、若溶液中有Cu2+ , 则一定没有固体析出 D、若溶液中有Fe2+ , 则一定有Cu析出5. 关于下列转化过程分析不正确的是
A、浸出液呈中性 B、滤渣只有铜粉 C、用KSCN溶液检验是否“氧化”完全 D、溶液a回收后可用于处理覆铜板4. 用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉.对加入铁粉充分反应后的溶液分析合理的是( )A、若无固体剩余,则溶液中一定有Fe3+ B、若有固体存在,则溶液中一定有Fe2+ C、若溶液中有Cu2+ , 则一定没有固体析出 D、若溶液中有Fe2+ , 则一定有Cu析出5. 关于下列转化过程分析不正确的是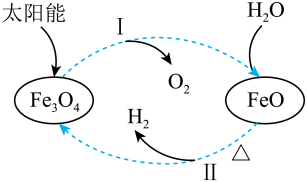 A、中Fe元素的化合价为+2、+3 B、该转化过程中FeO和均做催化剂 C、过程Ⅱ的化学方程式为: D、该过程的总反应为:6. 如图所示是铁及其化合物的价类二维图,下列有关叙述正确的是 ( )
A、中Fe元素的化合价为+2、+3 B、该转化过程中FeO和均做催化剂 C、过程Ⅱ的化学方程式为: D、该过程的总反应为:6. 如图所示是铁及其化合物的价类二维图,下列有关叙述正确的是 ( )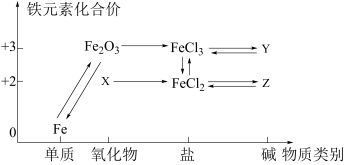 A、物质X是Fe3O4 B、Fe2O3→Fe的转化,Fe2O3发生氧化反应 C、在空气中Z→Y的现象是白色沉淀迅速变成灰绿色,最终变成红褐色 D、可通过复分解反应实现FeCl2和FeCl3的相互转化7. 下列有关铁及其化合物转化过程中的离子方程式书写正确的是A、氧化亚铁溶于稀硝酸: B、铁溶于盐酸: C、醋酸除铁锈: D、三氯化铁腐蚀铜板:8. 一种用溶液浸取黄铁矿(主要含 , 还含有少量难溶性杂质)的流程如图所示。下列叙述错误的是
A、物质X是Fe3O4 B、Fe2O3→Fe的转化,Fe2O3发生氧化反应 C、在空气中Z→Y的现象是白色沉淀迅速变成灰绿色,最终变成红褐色 D、可通过复分解反应实现FeCl2和FeCl3的相互转化7. 下列有关铁及其化合物转化过程中的离子方程式书写正确的是A、氧化亚铁溶于稀硝酸: B、铁溶于盐酸: C、醋酸除铁锈: D、三氯化铁腐蚀铜板:8. 一种用溶液浸取黄铁矿(主要含 , 还含有少量难溶性杂质)的流程如图所示。下列叙述错误的是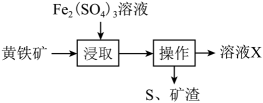 A、浸取时主要反应的离子方程式为: B、可以向操作后的溶液X中加入KSCN溶液,检验是否反应完全 C、溶液X经过一系列操作,可制得“绿矾晶体() D、实验室中可以利用溶液和NaOH溶液混合制备胶体9. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A、浸取时主要反应的离子方程式为: B、可以向操作后的溶液X中加入KSCN溶液,检验是否反应完全 C、溶液X经过一系列操作,可制得“绿矾晶体() D、实验室中可以利用溶液和NaOH溶液混合制备胶体9. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( ) A、在水溶液中,a可与e反应生成b B、e只能被还原 C、可将e的溶液加入NaOH溶液中制得d(OH)3胶体 D、可存在b→c→d→e→b的循环转化关系10. 一种用溶液浸取黄铁矿(主要含 , 还含有少量难溶性杂质)的流程如图所示,下列叙述中错误的是
A、在水溶液中,a可与e反应生成b B、e只能被还原 C、可将e的溶液加入NaOH溶液中制得d(OH)3胶体 D、可存在b→c→d→e→b的循环转化关系10. 一种用溶液浸取黄铁矿(主要含 , 还含有少量难溶性杂质)的流程如图所示,下列叙述中错误的是 A、浸取时主要反应的离子方程式为: B、可以向操作后的溶液X中加入KSCN溶液,检验是否存在 C、中含有离子键和共价键,阴阳离子个数比为2:1 D、由溶液X制取绿矾晶体的主要操作是蒸发浓缩、冷却结晶、过滤11. 下列关于元素及其化合物的性质说法错误的是A、K和苯酚反应可生成 B、工业上用在中燃烧生产HCl C、生铁降低含碳量生产碳素钢 D、工业上用焦炭还原石英砂制备纯硅12. 含铁物质或微粒所带电荷数与化合价的关系如图所示,下列说法错误的是
A、浸取时主要反应的离子方程式为: B、可以向操作后的溶液X中加入KSCN溶液,检验是否存在 C、中含有离子键和共价键,阴阳离子个数比为2:1 D、由溶液X制取绿矾晶体的主要操作是蒸发浓缩、冷却结晶、过滤11. 下列关于元素及其化合物的性质说法错误的是A、K和苯酚反应可生成 B、工业上用在中燃烧生产HCl C、生铁降低含碳量生产碳素钢 D、工业上用焦炭还原石英砂制备纯硅12. 含铁物质或微粒所带电荷数与化合价的关系如图所示,下列说法错误的是 A、M可能是 B、R为铁单质,常温下遇浓硫酸发生钝化 C、N可用溶液检验 D、与强氧化剂在碱性条件下反应可以生成13. 含铁物质与其相应化合价的关系如图所示。下列推断合理的是
A、M可能是 B、R为铁单质,常温下遇浓硫酸发生钝化 C、N可用溶液检验 D、与强氧化剂在碱性条件下反应可以生成13. 含铁物质与其相应化合价的关系如图所示。下列推断合理的是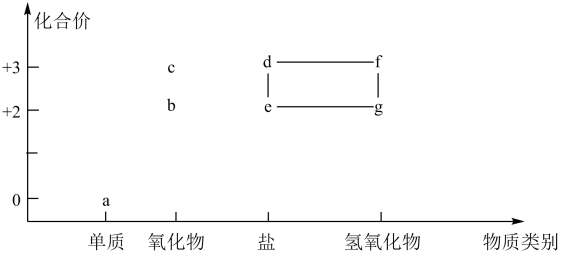 A、可用苯酚溶液鉴别đ和e B、a与水反应可直接生成c C、e的水溶液常用于净水 D、存在e-d-f-g的循环转化关系14. 草酸亚铁晶体是生产感光材料的原料 , 制备流程如下:
A、可用苯酚溶液鉴别đ和e B、a与水反应可直接生成c C、e的水溶液常用于净水 D、存在e-d-f-g的循环转化关系14. 草酸亚铁晶体是生产感光材料的原料 , 制备流程如下:下列说法错误的是( )
A、可用溶液检验是否变质 B、步骤①酸化的目的是抑制的水解 C、步骤②反应为 D、步骤③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥15. 如图为部分含铁物质之间的转化关系,下列说法正确的是( ) A、FeCl2溶液与H2O2溶液反应,可实现转化⑥ B、将Fe(OH)3溶于氢碘酸可实现转化③ C、将Fe(OH)2溶于稀硝酸可转化为Fe2+ D、铁与水蒸气在高温下反应可实现转化①16. 铁与水蒸气反应的实验装置如图,下列说法正确的是( )
A、FeCl2溶液与H2O2溶液反应,可实现转化⑥ B、将Fe(OH)3溶于氢碘酸可实现转化③ C、将Fe(OH)2溶于稀硝酸可转化为Fe2+ D、铁与水蒸气在高温下反应可实现转化①16. 铁与水蒸气反应的实验装置如图,下列说法正确的是( ) A、实验时,试管口应高于试管底 B、加热时试管内生成黑色物质,点燃肥皂泡可听到爆鸣声 C、反应的化学方程式为2Fe+3H2O(g)Fe2O3+3H2 D、试管中发生化合反应17. 部分含铁微粒所带的电荷数与其中铁元素化合价的关系如图所示,由该图可预测含铁微粒间相互转化时所需试剂。下列推断不合理的是( )
A、实验时,试管口应高于试管底 B、加热时试管内生成黑色物质,点燃肥皂泡可听到爆鸣声 C、反应的化学方程式为2Fe+3H2O(g)Fe2O3+3H2 D、试管中发生化合反应17. 部分含铁微粒所带的电荷数与其中铁元素化合价的关系如图所示,由该图可预测含铁微粒间相互转化时所需试剂。下列推断不合理的是( ) A、常温下,可用R材质容器储运浓硫酸 B、M可用K3[Fe(CN)6]溶液检验 C、若Q为金属阳离子,可通过Fe2O3与稀HI溶液反应生成 D、Fe3+与氧化剂在碱性条件下反应可生成FeO18. 铁器表面氧化层的成分有多种:致密的Fe3O4、疏松的FeO(OH)和FeOCl,它们均难溶于水。下列说法错误的是( )A、有氧条件下 与 转化为 ,周围环境的 增大 B、 可自发转变为 ,说明 的溶解度小于 C、检验 中是否含有 ,可选用的试剂是稀硫酸和 溶液 D、 完全转化为 时转移 电子19. 中药材铁华粉的主要成分是(CH3COO)2Fe,其检测流程如图所示。下列说法正确的是( )
A、常温下,可用R材质容器储运浓硫酸 B、M可用K3[Fe(CN)6]溶液检验 C、若Q为金属阳离子,可通过Fe2O3与稀HI溶液反应生成 D、Fe3+与氧化剂在碱性条件下反应可生成FeO18. 铁器表面氧化层的成分有多种:致密的Fe3O4、疏松的FeO(OH)和FeOCl,它们均难溶于水。下列说法错误的是( )A、有氧条件下 与 转化为 ,周围环境的 增大 B、 可自发转变为 ,说明 的溶解度小于 C、检验 中是否含有 ,可选用的试剂是稀硫酸和 溶液 D、 完全转化为 时转移 电子19. 中药材铁华粉的主要成分是(CH3COO)2Fe,其检测流程如图所示。下列说法正确的是( ) A、刺激性气体X为SO2 B、铁华粉中可能含有铁单质 C、向滤液中滴加酸性KMnO4溶液,一定能证明Fe2+具有还原性 D、滤液中加入K3[Fe(CN)6]试液,产生蓝色沉淀说明溶液中含有Fe3+20. Fe3+可与H2O、、等配体形成配位数为6的配离子,如[Fe(H2O)6]3+(浅紫色)、(红色)、(无色),但不能与形成配离子。某同学完成如下实验:
A、刺激性气体X为SO2 B、铁华粉中可能含有铁单质 C、向滤液中滴加酸性KMnO4溶液,一定能证明Fe2+具有还原性 D、滤液中加入K3[Fe(CN)6]试液,产生蓝色沉淀说明溶液中含有Fe3+20. Fe3+可与H2O、、等配体形成配位数为6的配离子,如[Fe(H2O)6]3+(浅紫色)、(红色)、(无色),但不能与形成配离子。某同学完成如下实验:
下列有关叙述错误的是( )
A、[Fe(H2O)6]3+为浅紫色,但溶液I却呈黄色,是Fe3+水解的产物所致 B、溶液II、III的颜色分别为红色和无色,说明其中不存在[Fe(H2O)6]3+ C、为了观察到溶液I中[Fe(H2O)6]3+的浅紫色,可向溶液中加入硝酸 D、已知Fe3+与、的反应在溶液中存在以下平衡: ; , 溶液II→溶液III,颜色由红色变为无色。若该反应是可逆反应,其平衡常数为21. 高铁酸钾(K2FeO4)是一种新型的污水处理剂。为充分利用资源,变废为宝,在实验室中探究采用暖贴残渣制备高铁酸钾,流程如下
下列说法错误的是( )
A、步骤 i 适当加热搅拌可以加快反应速率 B、ii 中的试剂为 H2O2 C、iii 中反应为 2Fe3+ + 5H2O +3ClO- =2 FeO +3Cl-+10H+ D、iv 中反应说明溶解度:Na2FeO4>K2FeO422. FeCl3是棕红色固体,易潮解,在300℃以上可升华成含二聚三氯化铁( )分子的气体。可用于金属刻蚀,污水处理等。主要有以下制备方法:
)分子的气体。可用于金属刻蚀,污水处理等。主要有以下制备方法:方法①:氯化法。以废铁屑和氯气为原料,在立式反应炉里反应,生成的氯化铁蒸气和尾气由炉的顶部排出,进入捕集器冷凝为固体结晶。
方法②:熔融法。将铁屑和干燥氯气在低共熔混合物(如30%KCl与70%FeCl3混合)内进行反应生成氯化铁,升华后收集在冷凝室中,该法制得的氯化铁纯度高。
方法③:复分解法。用氧化铁与盐酸反应后得到氯化铁溶液。
方法④:氯化亚铁合成法。将铁屑溶于盐酸中,然后向其中通入氯气得到氯化铁。
下列说法正确的是( )
A、二聚三氯化铁分子中含有配位键 B、将FeCl3饱和溶液缓慢滴入氢氧化钠溶液中,可制取Fe(OH)3胶体 C、直接加热蒸干方法③所得的氯化铁溶液制备无水氯化铁 D、向方法④所得的溶液中加入KSCN溶液与氯气,检验该溶液中是否含有Fe2+二、非选择题
-
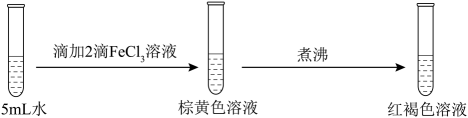
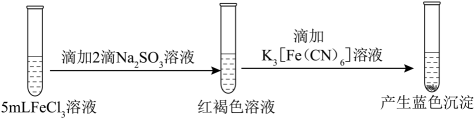
23. 为探究FeCl3的性质,进行了如下实验(FeCl3和Na2SO3溶液浓度均为0.1mol·L−1)。
实验
操作与现象
①
②
③
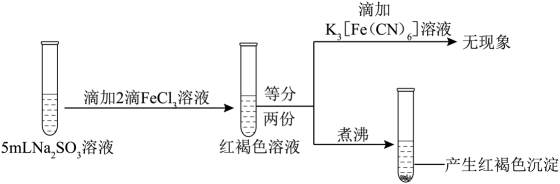
分析上述实验现象,所得结论不合理的是
A、实验①说明加热促进Fe3+水解反应 B、实验②说明Fe3+ 既发生了水解反应,又发生了还原反应 C、实验③说明Fe3+ 发生了水解反应,但没有发生还原反应 D、实验①-③说明SO对Fe3+ 的水解反应无影响,但对还原反应有影响24. 利用硫酸烧渣(主要含、FeO,还含有和CuO等)来制取溶液。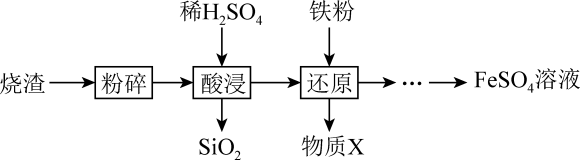 (1)、①将硫酸烧渣进行粉碎,其目的是。
(1)、①将硫酸烧渣进行粉碎,其目的是。②“酸浸”时,发生反应的离子方程式是。
(2)、“还原”时,铁粉将、还原为和Cu。检验是否已全部被还原,所选用试剂的化学式是。(3)、将得到的溶液进行下列操作,测定其物质的量浓度:步骤一:取溶液,将其稀释成100.00mL溶液。
步骤二:取25.00mL稀释后的溶液,向其中加入酸性溶液。恰好反应时,记下消耗溶液的体积。
步骤三:重复上述实验3次,平均消耗溶液20.00mL。
已知:(未配平)
①配平上述方程式。
②“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是。
③试通过计算,求原溶液的物质的量浓度是多少?(写出计算过程)
25. 铁及其化合物在人类生活中有着极其重要的作用。完成下列填空:(1)、铁的原子结构示意图为 。由此可知,铁是第周期元素,铁原子核外3d轨道上共填充了个电子。 (2)、古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是(选填编号)。
。由此可知,铁是第周期元素,铁原子核外3d轨道上共填充了个电子。 (2)、古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是(选填编号)。a.Fe b.FeO c.Fe2O3 d.Fe3O4
(3)、FeSO4可以用来净水、治疗缺铁性贫血等,实验室在配制FeSO4溶液时,为了防止FeSO4变质,经常向溶液中加入铁粉,其原因是(用离子方程式表示)。(4)、向新配制的FeSO4溶液中,加入一定量的稀硝酸,发生如下反应:Fe2++H++NO=Fe3++NO↑+H2O
①配平上述反应。
②每生成0.5molNO气体,转移的电子数为。
③要检验该反应后的溶液中是否还含有Fe2+ , 实验方案是。
现在可以利用铁氧化物循环裂解水制备氢气,其过程如图所示:
 (5)、写出反应Ⅲ的平衡常数表达式。(6)、写出铁氧化物循环裂解水制氢的总反应的化学方程式:。(7)、Fe3O4和CO的反应过程与温度密切相关。向某容器中加入Fe3O4与CO,当其它条件一定时,达到平衡时CO的体积百分含量随温度的变化关系如图所示。
(5)、写出反应Ⅲ的平衡常数表达式。(6)、写出铁氧化物循环裂解水制氢的总反应的化学方程式:。(7)、Fe3O4和CO的反应过程与温度密切相关。向某容器中加入Fe3O4与CO,当其它条件一定时,达到平衡时CO的体积百分含量随温度的变化关系如图所示。
已知:①Fe3O4+CO⇌3FeO+CO2-Q1(Q1>0)
②Fe3O4+4CO⇌3Fe+4CO2+Q2(Q2>0)
推测当温度达到570℃,平衡时CO体积百分含量最高的原因:。
26. 煤化学链技术具有成本低、能耗低的捕集特性。以铁矿石(主要含铁物质为)为载氧体的煤化学链制氢工艺如下图。测定反应前后不同价态铁的含量,对工艺优化和运行监测具有重要意义。 (1)、进入燃烧反应器前,铁矿石需要粉碎,煤需要烘干研磨,其目的是。(2)、分离燃烧反应器中产生的(g)和 , 可进行高纯捕集和封存,其分离方法是。(3)、测定铁矿石中全部铁元素含量。
(1)、进入燃烧反应器前,铁矿石需要粉碎,煤需要烘干研磨,其目的是。(2)、分离燃烧反应器中产生的(g)和 , 可进行高纯捕集和封存,其分离方法是。(3)、测定铁矿石中全部铁元素含量。i.配制铁矿石待测液:铁矿石加酸溶解,向其中滴加氯化亚锡()溶液。
ii.用重铬酸钾()标准液滴定可测定样品中全部铁元素含量。配制铁矿石待测液时溶液过量会对测定结果产生影响,分析影响结果及其原因。
(4)、测定燃烧反应后产物中单质铁含量:取a g样品,用溶液充分浸取(FeO不溶于该溶液),向分离出的浸取液中滴加b 溶标准液,消耗标准液V mL。已知被还原为 , 样品中单质铁的质量分数为。(5)、工艺中不同价态铁元素含量测定结果如下。
①制氢产物主要为 , 写出蒸汽反应器中发生反应的化学方程式。
②工艺中可循环使用的物质是(填化学式)。
27. 以焙烧黄铁矿(杂质为石英等)产生的红渣为原料制备铵铁蓝颜料。工艺流程如下:
回答下列问题:
(1)、红渣的主要成分为(填化学式),滤渣①的主要成分为(填化学式)。(2)、黄铁矿研细的目的是。(3)、还原工序中,不生成S单质的反应的化学方程式为。(4)、工序①的名称为 , 所得母液循环使用。(5)、沉铁工序产生的白色沉淀中的化合价为 , 氧化工序发生反应的离子方程式为。(6)、若用还原工序得到的滤液制备和 , 所加试剂为和(填化学式,不引入杂质)。28. 聚合硫酸铁(PFS)也称碱式硫酸铁或羟基硫酸铁,是新型、优质、高效铁盐类无机高分子絮凝剂。PFS固体为淡黄色无定型粉状固体,极易溶于水,高于130℃发生分解,有较强的吸湿性。下图是以回收废铁屑为原料制备PFS的一种工艺流程。
回答下列问题:
(1)、粉碎过筛的目的是。(2)、酸浸没时最合适的酸是。(3)、反应釜中加入的氧化剂是双氧水,其作用是 , 反应的离子方程式为。(4)、聚合釜中溶液的pH必须控制在一定的范围内,原因是。(5)、相对于常压蒸发,减压蒸发的优点是。(6)、盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液VmL。按照上述步骤做空白对照试验,消耗NaOH溶液mL,已知该样品中Fe的质量分数ω,则B的表达式。29. 碳酸亚铁在干燥空气中为白色固体,可用于制铁盐、兽药、补血剂等。利用废铁屑(含少量碳、氧化铝和氧化铁杂质)为原料制取碳酸亚铁,并探究碳酸亚铁的部分性质。回答下列问题:(1)、Ⅰ.制碳酸亚铁,工艺流程如图:
常温下几种金属阳离子开始沉淀与完全沉淀时的pH如表:
Fe2+
Fe3+
Al3+
开始沉淀
7.5
2.7
3.8
完全沉淀
9.5
3.7
4.7
酸浸时,所发生氧化还原反应的离子方程式为。
(2)、加入氨水调控pH的范围是 , “固体”的成分是。(3)、在工业生产中加入的NH4HCO3 , 需过量,下列分析不正确的是(填标号)。a.使Fe2+充分转化为碳酸亚铁
b.碳酸氢铵受热分解
c.促进Fe2+、CO的水解
(4)、Ⅱ.探究碳酸亚铁的性质
实验:
由上面实验可以得出碳酸亚铁的相关性质是 , 写出碳酸亚铁变成红褐色固体所发生反应的化学方程式。
(5)、已知:100.8≈6.3,25℃时,Ksp(FeCO3)=3.0×10-11、Ksp[Fe(OH)2]=1.6×10-14。现将碳酸亚铁加入0.1mol·L-1Na2CO3(pH=11.6)溶液中,经计算可知(填“有”或“无”)Fe(OH)2生成。30. 黄钠铁矾[Na3Fe3(SO4)3(OH)6]被用于作净水剂。以高品质的硫铁矿(主要成分为FeS2 , 含少量SiO2)为原料制取黄钠铁矾,工艺流程如图: (1)、“盐浸”时的反应为FeS2+Fe2(SO4)3→FeSO4+S↓(未配平),其中氧化剂和还原剂的物质的量之比为;滤渣的主要成分为SiO2和。(2)、“氧化”时发生反应的离子方程式为;用空气代替NaClO进行该反应具有成本低等优点,但存在的缺点。(3)、“沉铁”过程,控制不同条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示黄钠铁矾稳定产生的区域)。
(1)、“盐浸”时的反应为FeS2+Fe2(SO4)3→FeSO4+S↓(未配平),其中氧化剂和还原剂的物质的量之比为;滤渣的主要成分为SiO2和。(2)、“氧化”时发生反应的离子方程式为;用空气代替NaClO进行该反应具有成本低等优点,但存在的缺点。(3)、“沉铁”过程,控制不同条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示黄钠铁矾稳定产生的区域)。
①80℃时,加入碳酸钠偏多时得到的黄钠铁矾中含有的杂质是。
②生成黄钠铁矾的离子反应方程式。
③由图在pH=2时,温度过高或过低,不易制得黄钠铁矾。试解释其原因。
(4)、测定黄钠铁矾样品中铁的质量分数:称取样品2.000g置于锥形瓶中,加入足量稀H2SO4溶解,滴入稍过量的KI溶液,待充分反应后,调节溶液近中性,滴入几滴淀粉溶液,用0.1500mol•L-1Na2S2O3溶液平行滴定,平均消耗20.00mL。(已知:I2+2S2O=2I-+S4O)①滴定终点的实验现象是。
②样品中铁的质量分数为。