【备考2024年】从巩固到提高 高考化学二轮微专题06 氧族和碳族及其应用
试卷更新日期:2024-02-22 类型:二轮复习
一、选择题
-
1. 右图为硫元素的“价—类”二维图。下列说法正确的是( )
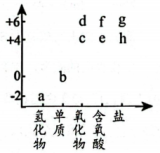 A、a与氧气反应可直接生成b或d B、c能使新制氯水褪色,说明c具有漂白性 C、f的浓溶液和稀溶液均具有氧化性 D、h在空气中不能直接转化成g2. “中国芯”的主要原料是单晶硅,制取纯硅的过程如图所示。下列说法正确的是( )
A、a与氧气反应可直接生成b或d B、c能使新制氯水褪色,说明c具有漂白性 C、f的浓溶液和稀溶液均具有氧化性 D、h在空气中不能直接转化成g2. “中国芯”的主要原料是单晶硅,制取纯硅的过程如图所示。下列说法正确的是( )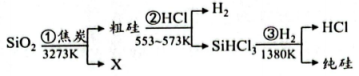 A、步骤①中的反应为 B、二氧化硅是酸性氧化物,能与水反应生成硅酸 C、步骤②和③均属于置换反应 D、28g纯硅中含有4molSi-Si键3. 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y 同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法错误的是
A、步骤①中的反应为 B、二氧化硅是酸性氧化物,能与水反应生成硅酸 C、步骤②和③均属于置换反应 D、28g纯硅中含有4molSi-Si键3. 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y 同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法错误的是 A、洗气瓶中产生的沉淀是亚硫酸钡 B、在Z导管出来的气体中有二氧化碳 C、洗气瓶中产生的沉淀是硫酸钡 D、在Z导管口有红棕色气体出现4. 在价类二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。下图中的字母分别代表硫及其常见化合物,相关推断不合理的是
A、洗气瓶中产生的沉淀是亚硫酸钡 B、在Z导管出来的气体中有二氧化碳 C、洗气瓶中产生的沉淀是硫酸钡 D、在Z导管口有红棕色气体出现4. 在价类二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。下图中的字母分别代表硫及其常见化合物,相关推断不合理的是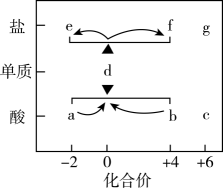 A、a溶液与b溶液反应过程中有淡黄色沉淀生成 B、硫酸型酸雨的形成过程涉及b到c的转化 C、g阴离子的中心原子的杂化轨道类型为sp3 D、d在加热下与强碱溶液反应生成e和f,且n(e):n(f)=1:25. 将足量SO2气体通入BaCl2溶液中,无明显现象。若要观察到BaSO3沉淀,可再通入A、Cl2 B、NO2 C、H2S D、NH36. 氮化硅是一种性能优异的半导体材料。下列说法正确的是A、硅也是一种半导体材料 B、非金属性: C、原子半径: D、硅位于第3周期第VIA族7. 中科院发现深海处在微生物作用下的含硫物质的变化过程如图所示(已略去部分不含硫物质)。有关转化过程说法错误的是
A、a溶液与b溶液反应过程中有淡黄色沉淀生成 B、硫酸型酸雨的形成过程涉及b到c的转化 C、g阴离子的中心原子的杂化轨道类型为sp3 D、d在加热下与强碱溶液反应生成e和f,且n(e):n(f)=1:25. 将足量SO2气体通入BaCl2溶液中,无明显现象。若要观察到BaSO3沉淀,可再通入A、Cl2 B、NO2 C、H2S D、NH36. 氮化硅是一种性能优异的半导体材料。下列说法正确的是A、硅也是一种半导体材料 B、非金属性: C、原子半径: D、硅位于第3周期第VIA族7. 中科院发现深海处在微生物作用下的含硫物质的变化过程如图所示(已略去部分不含硫物质)。有关转化过程说法错误的是 A、中含有的键与键的数目之比为 B、 , C、既被氧化又被还原 D、理论上每产生 , 转移8. “价—类”二维图是研究物质性质的一种方法,下图是a~f表示的是含硫物质。下列说法正确的是( )
A、中含有的键与键的数目之比为 B、 , C、既被氧化又被还原 D、理论上每产生 , 转移8. “价—类”二维图是研究物质性质的一种方法,下图是a~f表示的是含硫物质。下列说法正确的是( ) A、a可用硫化亚铁与稀硝酸反应制取 B、b在足量的纯氧中燃烧,可一步转化为d C、c能使溴水褪色,证明c有漂白性 D、f既有氧化性又有还原性9. 将浓硫酸与乙醇共热后得到的混合气体通入下列装置中,下列说法错误的是( )
A、a可用硫化亚铁与稀硝酸反应制取 B、b在足量的纯氧中燃烧,可一步转化为d C、c能使溴水褪色,证明c有漂白性 D、f既有氧化性又有还原性9. 将浓硫酸与乙醇共热后得到的混合气体通入下列装置中,下列说法错误的是( ) A、品红溶液a褪色证明气体中有SO2 B、品红溶液b不变色且澄清石灰水变浑浊证明原混合气体中有CO2 C、SO2的生成体现了浓硫酸的氧化性 D、酸性高锰酸钾溶液可以氧化乙烯和SO210. 法生产多晶硅的流程如下。下列说法错误的是( )
A、品红溶液a褪色证明气体中有SO2 B、品红溶液b不变色且澄清石灰水变浑浊证明原混合气体中有CO2 C、SO2的生成体现了浓硫酸的氧化性 D、酸性高锰酸钾溶液可以氧化乙烯和SO210. 法生产多晶硅的流程如下。下列说法错误的是( ) A、合成1反应中作氧化剂 B、合成2的反应为: C、上述流程说明可溶于 D、净化、热解中生成的多晶硅为还原产物11. 反应SiCl4(g)+2H2(g)Si(s)+4HCl(g)可用于“中国芯”原料高纯硅的制备。下列说法正确的是A、SiCl4为极性分子 B、反应中只有一种物质为电解质 C、单晶硅为分子晶体 D、Si原子的结构示意图为
A、合成1反应中作氧化剂 B、合成2的反应为: C、上述流程说明可溶于 D、净化、热解中生成的多晶硅为还原产物11. 反应SiCl4(g)+2H2(g)Si(s)+4HCl(g)可用于“中国芯”原料高纯硅的制备。下列说法正确的是A、SiCl4为极性分子 B、反应中只有一种物质为电解质 C、单晶硅为分子晶体 D、Si原子的结构示意图为 12. 部分含硫物质的类别与相应化合价及部分物质间转化关系如图。下列说法错误的是
12. 部分含硫物质的类别与相应化合价及部分物质间转化关系如图。下列说法错误的是 A、a溶液放置在空气中一段时间会出现浑浊现象 B、空气中燃烧b可以得到大量的d C、e的浓溶液可以用铁槽车运输是利用其强氧化性 D、b附着在试管壁上可以用二硫化碳或热的浓NaOH溶液洗涤13. 制备并检验SO2性质的装置如图所示。下列分析正确的是
A、a溶液放置在空气中一段时间会出现浑浊现象 B、空气中燃烧b可以得到大量的d C、e的浓溶液可以用铁槽车运输是利用其强氧化性 D、b附着在试管壁上可以用二硫化碳或热的浓NaOH溶液洗涤13. 制备并检验SO2性质的装置如图所示。下列分析正确的是 A、此实验中浓硫酸只表现出强氧化性 B、湿润的蓝色石蕊试纸先变红,后褪色 C、若将蘸有品红溶液的滤纸换成蘸有酸性KMnO4溶液的滤纸,现象、原理都相同 D、棉花可用NaOH溶液浸泡,吸收尾气,减少环境污染14. 硅与碳同主族,是构成地壳的主要元素之一,下列说法正确的是A、单质硅和金刚石中的键能: B、和中化合价均为-4价 C、中Si原子的杂化方式为sp D、碳化硅硬度很大,属于分子晶体15. 下列化学方程式正确,且符合含硫物质的性质描述的是A、非金属硫单质具有氧化性: B、是一种酸性氧化物,可与碱性氧化物反应生成盐: C、具有还原性,可吸收: D、浓硫酸不易挥发,能用于制取挥发性酸:16. 硫及其化合物的“价—类”二维图体现了化学变化之美。下列有关说法正确的是
A、此实验中浓硫酸只表现出强氧化性 B、湿润的蓝色石蕊试纸先变红,后褪色 C、若将蘸有品红溶液的滤纸换成蘸有酸性KMnO4溶液的滤纸,现象、原理都相同 D、棉花可用NaOH溶液浸泡,吸收尾气,减少环境污染14. 硅与碳同主族,是构成地壳的主要元素之一,下列说法正确的是A、单质硅和金刚石中的键能: B、和中化合价均为-4价 C、中Si原子的杂化方式为sp D、碳化硅硬度很大,属于分子晶体15. 下列化学方程式正确,且符合含硫物质的性质描述的是A、非金属硫单质具有氧化性: B、是一种酸性氧化物,可与碱性氧化物反应生成盐: C、具有还原性,可吸收: D、浓硫酸不易挥发,能用于制取挥发性酸:16. 硫及其化合物的“价—类”二维图体现了化学变化之美。下列有关说法正确的是 A、硫在氧气中燃烧直接生成Y B、Z与Cu反应,体现了Z的酸性和强氧化性 C、硫化氢与X反应的氧化产物和还原产物的物质的量之比为1:2 D、N可由其相应单质直接化合生成17. 硫元素的价类二维图如图所示。下列说法错误的是
A、硫在氧气中燃烧直接生成Y B、Z与Cu反应,体现了Z的酸性和强氧化性 C、硫化氢与X反应的氧化产物和还原产物的物质的量之比为1:2 D、N可由其相应单质直接化合生成17. 硫元素的价类二维图如图所示。下列说法错误的是 A、C可用于葡萄酒工业 B、F溶液久置于空气中会生成E,溶液的pH减小 C、A,C和D都可以通过单质间化合制得 D、E的浓溶液可用于干燥C但不能干燥A18. “中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应用流程图表示如图:
A、C可用于葡萄酒工业 B、F溶液久置于空气中会生成E,溶液的pH减小 C、A,C和D都可以通过单质间化合制得 D、E的浓溶液可用于干燥C但不能干燥A18. “中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应用流程图表示如图:
下列说法错误的是
A、反应①中氧化剂和还原剂之比为1:2 B、流程中 HCl和H2可以循环利用 C、反应①②③均为置换反应 D、①③两反应的还原剂可以互换19. 物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的价态-类别图。下列说法正确的是( )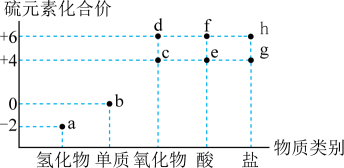 A、常温下,a和f的浓溶液反应可生成b和c B、附着有b的试管,常用酒精清洗 C、分别往d、e的溶液中滴加少量氯化钡溶液,均可产生白色沉淀 D、常温下等物质的量浓度的g、h两种钠盐溶液的pH:g<h20. 羰基硫(COS)的结构与类似,可作粮食熏蒸剂,防治虫类、真菌对粮食的危害。下列说法错误的是( )A、COS属于极性分子 B、COS沸点高于的沸点 C、COS空间构型为直线形 D、COS热稳定性大于21. 在“价一类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,相关推断不合理的是( )
A、常温下,a和f的浓溶液反应可生成b和c B、附着有b的试管,常用酒精清洗 C、分别往d、e的溶液中滴加少量氯化钡溶液,均可产生白色沉淀 D、常温下等物质的量浓度的g、h两种钠盐溶液的pH:g<h20. 羰基硫(COS)的结构与类似,可作粮食熏蒸剂,防治虫类、真菌对粮食的危害。下列说法错误的是( )A、COS属于极性分子 B、COS沸点高于的沸点 C、COS空间构型为直线形 D、COS热稳定性大于21. 在“价一类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,相关推断不合理的是( ) A、b、d、f既具有氧化性又具有还原性 B、硫酸型酸雨的形成过程涉及b到c的转化 C、d与c在一定条件下反应可生成b或a D、d在加热条件下与强碱溶液反应生成e和f,且
A、b、d、f既具有氧化性又具有还原性 B、硫酸型酸雨的形成过程涉及b到c的转化 C、d与c在一定条件下反应可生成b或a D、d在加热条件下与强碱溶液反应生成e和f,且二、非选择题
-
22. SO2是大气污染物,SO2废气的处理可以先用H2还原成H2S后再设法回收S,主要涉及反应:3H2+SO2H2S+2H2O。完成下列填空:(1)、写出硫化氢的电子式 , 硫原子的核外有种不同运动状态的电子。(2)、列举一个硫元素比氧元素非金属性弱的事实:。(3)、在一定温度下,向2L反应器中通入含SO2的废气与H2 , 经过10min,有0.4mol水生成,则这段时间内v(SO2)=。(4)、一定条件下SO2与H2的反应达到平衡时,SO2的平衡转化率随温度(t)、压强(P)的变化如下图所示:
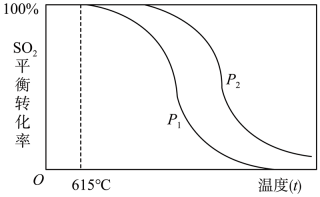
①根据上述信息可以判断:P1P2(填“>”、“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K将(填“变大”、“变小”或“不变”)。
③SO2废气的另一种处理方法是用Na2SO3溶液吸收,得到NaHSO3溶液。
(5)、写出该方法吸收SO2的化学方程式。(6)、所得的NaHSO3溶液呈酸性,运用相关化学用语进行解释。23. 工业用焦炭和硫酸钠反应制备硫化钠:Na2SO4 + 2CNa2S + CO2↑,完成下列填空:(1)、硫元素在周期表中的位置为 , 硫原子核外有种不同运动状态的电子。(2)、CS2的结构与CO2相似,二者形成晶体时的熔点高低为:CS2CO2(填“>、=、<”)。(3)、有关二硫化碳分子的描述正确的是____A、含有非极性键 B、是直线形分子 C、属于极性分子 D、结构式为(4)、C元素和S元素比较,非金属性强的是 , 写出一个能支持你的结论的事实:。(5)、Na2S又称臭碱,Na2S溶液中含硫元素微粒的浓度由大到小的顺序是。(6)、天然气中常含有少量H2S,在酸性介质中进行天然气脱硫的原理示意图如图示,
配平步骤①涉及到的方程式(先在括号里补齐生成物):
_Fe2 (SO4)3 + _ H2S =_FeSO4 +_S↓ +_
(7)、图示中反应②是FeSO4在酸性条件下被O2氧化的过程,若有1摩尔FeSO4在酸性条件下被氧化,需要O2的体积(标准状况)为升。24.(1)、I.硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。从图1中选择符合图2要求的X代表的物质:X。
 (2)、硫原子的最外层电子排布式为 , 其原子核外有种不同能量的电子。在周期表中,与硫相邻的短周期元素的原子半径由大到小的顺序是。(3)、硫化氢溶液在空气中易变浑浊,说明S的非金属性比O(填“强”或“弱”),从原子结构的角度解释其原因:。(4)、下图是燃煤发电厂处理废气的装置示意图,下列说法错误的是____。
(2)、硫原子的最外层电子排布式为 , 其原子核外有种不同能量的电子。在周期表中,与硫相邻的短周期元素的原子半径由大到小的顺序是。(3)、硫化氢溶液在空气中易变浑浊,说明S的非金属性比O(填“强”或“弱”),从原子结构的角度解释其原因:。(4)、下图是燃煤发电厂处理废气的装置示意图,下列说法错误的是____。 A、使用此装置可减少导致酸雨的气体的形成 B、装置内发生了化合反应和分解反应 C、若排放的气体能使澄清石灰水变浑浊,说明排放的气体中一定含有SO2 D、整个过程的总反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2(5)、II.某化学兴趣小组用以下装置探究SO2的某些化学性质。
A、使用此装置可减少导致酸雨的气体的形成 B、装置内发生了化合反应和分解反应 C、若排放的气体能使澄清石灰水变浑浊,说明排放的气体中一定含有SO2 D、整个过程的总反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2(5)、II.某化学兴趣小组用以下装置探究SO2的某些化学性质。
装置乙的作用是。若X为品红溶液,观察到溶液褪色,说明SO2具有(填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有。
a.氧化性 b.还原性 c.漂白性 d.酸性
(6)、若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式。Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-++H+
25. 某小组根据硫元素的化合价,预测SO2既有还原性又有氧化性,并设计实验进行探究。(1)、I.探究SO2的还原性:向试管中通入足量SO2 (尾气处理装置已略) ,记录如下。装置
编号
试剂
实验现象

a
碘水
溶液的棕黄色褪去
b
Fe2(SO4)3溶液
a中反应的离子方程式为。
(2)、b中的实验现象为。将b所得溶液分成三份,进行如下实验。实验①向第一份溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀。
实验②向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
实验③向第三份溶液中先加入稀盐酸酸化,再加入BaCl2溶液,产生白色沉淀。
上述实验不能证明SO2与Fe3+发生了氧化还原反应的是 , 原因是。
(3)、II.探究SO2的氧化性:向试管中通入足量SO2 (尾气处理装置已略) ,记录如下。装置
编号
试剂
实验现象

c
3mol·L-1稀硫酸
始终无明显变化
d
3 mol·L-1稀盐酸
铜片表面变黑,溶液变为棕色
已知:i.水合Cu+既易被氧化也易被还原,因此水溶液中无法生成水合Cu+。
ii.CuCl为白色固体,难溶于水,可溶于c(Cl-)较大的溶液生成[CuCl3]2-。
证明d所得棕色溶液含有[CuCl3]2- :用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因是。
(4)、与c对比,d能发生反应的原因是。(5)、由实验II可推知,该条件下SO2、CuCl、Cu2+的氧化性由强到弱的顺序为。26. 水泥是重要的建筑材料。水泥熟料的主要成分为CaO、 , 并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题:
(1)、在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是 , 还可使用代替硝酸。(2)、沉淀A的主要成分是 , 其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为。(3)、加氨水过程中加热的目的是。沉淀B的主要成分为、(填化学式)(4)、草酸钙沉淀经稀处理后,用标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:。实验中称取0.400g水泥样品,滴定时消耗了的溶液36.00mL,则该水泥样品中钙的质量分数为 , (相对原子质量Ca:40)27. 硫的化合物在工业中用途广泛。是一种重要的溶剂。工业上可以利用硫黄()与为原料制备 , 时受热分解成气态 , 发生反应。完成下列填空:
(1)、和互称为;硫原子最外层未成对电子中运动状态不相同的方面是。(2)、反应所涉及的各物质中,属于极性分子的电子式为。列举一个能比较硫元素与碳元素非金属性相对强弱的实验事实:。常温下,用的溶液处理工业尾气中的 , 吸收过程中的使用率()与溶液的关系如图所示(溶液体积与温度均保持不变)。 (3)、a点时,溶液中。已知到b点时吸收了标准状况下尾气,则尾气中的体积分数为(尾气中其他成分不反应)。(4)、当的使用率达到时,溶液为4.4,分析原因:。(5)、用硫酸酸化的 , 溶液处理气体,会析出铬钾矾晶体。写出相关反应的化学方程式。28.(1)、I.碳元素作为一种形成化合物种类最多的元素,其单质及化合物具有广泛的用途。
(3)、a点时,溶液中。已知到b点时吸收了标准状况下尾气,则尾气中的体积分数为(尾气中其他成分不反应)。(4)、当的使用率达到时,溶液为4.4,分析原因:。(5)、用硫酸酸化的 , 溶液处理气体,会析出铬钾矾晶体。写出相关反应的化学方程式。28.(1)、I.碳元素作为一种形成化合物种类最多的元素,其单质及化合物具有广泛的用途。储能材料是当今科学研究的热点,C60(结构如图)可用作储氢材料。继C60后,科学家又合成了Si60、N60 , 下列有关说法正确的是。

a.C60、Si60、N60都属于新型化合物
b.C60、Si60、N60互为同分异构体
c.已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d.已知金刚石中C-C键长154pm,C60中C-C键长145-140pm,故C60熔点高于金刚石
(2)、II.玻璃生产离不开碳酸盐,原料在熔炉里发生的主要反应如下:2Na2CO3+CaCO3+3SiO2 2Na2SiO3+CaSiO3+3CO2↑上述反应中,反应物之一在熔融状态下不导电,该物质属于晶体。写出气体产物的电子式 , 其属于分子(填“极性”或“非极性”)。
(3)、上述反应中,在周期表中相邻的两种元素的原子半径>(填元素符号);处于第三周期的元素名称是;金属性最强的短周期元素原子核外有种不同能级的电子,其单质在O2中燃烧,生成的产物可能有(写化学式)。(4)、III.碳元素能形成多种酸,如常见的碳酸、草酸(H2C2O4)等。已知下列3个变化: →CO2、 →CO2、Fe3+→Fe2+。找出其中一个变化与“ →Mn2+”组成一个反应,写出该反应的离子方程式并配平。
(5)、上述反应中的高锰酸钾在不同条件下可发生如下反应: +5e+8H+→Mn2++4H2O; +3e+2H2O→MnO2+4OH-; +e→①由此可知,高锰酸根离子( )反应后的产物与有关。
②高锰酸钾溶液与硫化亚铁发生如下反应:10FeS+6KMnO4+24H2SO4→3K2SO4+6MnSO4+5Fe2(SO4)3+10S↓+24H2O,已知该反应进行一段时间后,固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为个。