【备考2024年】从巩固到提高 高考化学微专题03 阿伏加德罗常数
试卷更新日期:2024-02-22 类型:二轮复习
一、选择题
-
1. 为阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,金刚石含有4NA个共价键 B、的乙酸和盐酸混合溶液含0.1NA个 C、标准状态下,含有的质子数为10NA D、电解水生成氢气,外电路通过1NA个电子2. 为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,含有的中子数为 B、常温下,中含有的孤电子对数为 C、溶液中含有的数为 D、和足量充分反应转移的电子数为3. 电解重水()是制取氘气()的一种方法。设为阿伏加德罗常数的值。下列说法错误的是( )A、分子间存在氢键 B、的熔、沸点比高 C、含中子数目为 D、制取转移的电子数目为4. 火箭表面耐高温涂层的制备反应为。阿伏加德罗常数的值为 , 下列说法正确的是( )A、中共价键的数目为 B、中含有的中子数为 C、固体含有的数目为 D、消耗时,该反应中转移的电子数为5. 反应常被用于除去水中残余氯。为阿伏加德罗常数的值,下列说法正确的是( )A、溶液中含有的键数目为 B、25℃、101kPa时,中氯原子的数目为 C、含有质子的数目为 D、通过上述反应除去 , 电子转移的数目为6. 设NA为阿伏加德罗常数的值,下列叙述正确的是A、1LpH=1的H2C2O4溶液中含有阳离子总数为0.2NA B、12.0g二氧化硅晶体中含Si-O键的数目为0.4NA C、常温下,1.6gO2与O3的混合气体中所含的原子数目为0.1NA D、含0.4molHCl的浓盐酸与足量MnO2反应,转移电子数目为0.2NA7. 为阿伏加德罗常数的值。下列叙述正确的是A、0.1 mol/L 溶液中,含有的数目为0.2 B、标准状况下,22.4 L 和22.4 L 在光照下充分反应后的分子数为2 C、1 mol 晶体和1 mol 晶体含有的离子数目均为2 D、一定条件下,5.6 g Fe与0.1 mol 充分反应,转移的电子数为0.38. 设为阿伏加德罗常数的值,下列说法正确的是A、中含有的电子数为 B、溶液中含有的阴离子数目小于 C、标准状况下,乙炔中含有的键数目为 D、与足量的氧气反应转移电子数目为9. 绿矾()分解可制备铁红,同时产生、和。设NA为阿伏加德罗常数的值,下列说法错误的是A、溶液含有的阳离子数大于NA B、0.5mol三聚分子(
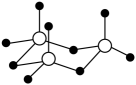 )中含有σ键数目为6 NA
C、绿矾分解生成16g时,转移电子数为0.2 NA
D、22.4L溶于水,溶液中、、的数目总和为NA
10. NA为阿伏加德罗常数的值。下列说法正确的是A、22.4L 光气(COCl2) 所含分子数为NA B、0.1 mol Cu(H2O)4SO4·H2O晶体中σ键数目为1.8 NA C、电解1L饱和食盐水,pH=13时, 转移的电子数为0.05 NA D、2mL5mol·L-1的硅酸钠溶液和盐酸反应后制得硅酸胶体,胶粒数为0.01NA11. 设为阿伏加德罗常数的值,下列说法正确的是A、39g
)中含有σ键数目为6 NA
C、绿矾分解生成16g时,转移电子数为0.2 NA
D、22.4L溶于水,溶液中、、的数目总和为NA
10. NA为阿伏加德罗常数的值。下列说法正确的是A、22.4L 光气(COCl2) 所含分子数为NA B、0.1 mol Cu(H2O)4SO4·H2O晶体中σ键数目为1.8 NA C、电解1L饱和食盐水,pH=13时, 转移的电子数为0.05 NA D、2mL5mol·L-1的硅酸钠溶液和盐酸反应后制得硅酸胶体,胶粒数为0.01NA11. 设为阿伏加德罗常数的值,下列说法正确的是A、39g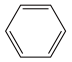 含有键的数目为
B、和中含有的质子数均为
C、和完全反应生成的分子数为
D、与足量完全反应,转移电子数为
12. 设NA为阿伏加德罗常数的值。下列说法正确的是A、固体中含有的离子数目为 B、标况下所含的分子数为 C、一定条件下,与足量的反应,转移的电子数为 D、溶液中含有的氧原子数为13. 设NA为阿伏加德常数的值,下列说法正确的是( )A、1 mol Na2O2固体中含离子总数为4NA B、标准状况下,22.4 L氨水含有NA个NH3分子 C、丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA D、室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA14. NA表示阿伏加德罗常数,下列有关物质结构说法正确的是( )A、NaH的电子式为:
含有键的数目为
B、和中含有的质子数均为
C、和完全反应生成的分子数为
D、与足量完全反应,转移电子数为
12. 设NA为阿伏加德罗常数的值。下列说法正确的是A、固体中含有的离子数目为 B、标况下所含的分子数为 C、一定条件下,与足量的反应,转移的电子数为 D、溶液中含有的氧原子数为13. 设NA为阿伏加德常数的值,下列说法正确的是( )A、1 mol Na2O2固体中含离子总数为4NA B、标准状况下,22.4 L氨水含有NA个NH3分子 C、丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA D、室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA14. NA表示阿伏加德罗常数,下列有关物质结构说法正确的是( )A、NaH的电子式为: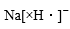 B、78克Na2O2晶体中所含阴阳离子总数为3NA
C、CCl4和PCl5分子中所有原子的最外层都达到了8电子稳定结构
D、浓硫酸溶于水电离出H+和SO并放出大量的热,所以浓硫酸溶于水属于放热反应
15. 设NA表示阿伏加德罗常数的值,下列叙述中正确的是A、含4.8g碳元素的石墨晶体中的共价键数是0.8NA B、标准状况下,甲烷和氧气的混合气体共22.4L,完全燃烧后产物的分子总数可能为NA C、10g的D2O中含有的质子数与中子数分别为5NA和4NA D、常压、500℃、催化条件下,1molSO2和0.5molO2充入一密闭容器内,充分反应后的生成物分子数为NA16. 为阿伏加德罗常数的值。下列叙述中正确的是A、中含有的键的数目为 B、标准状况下,和在光照下充分反应后的分子数为 C、固体含有的离子数目为 D、一定条件下,5.6gFe与充分反应,转移的电子数为17. 设NA为阿伏加德罗常数的值,下列说法错误的是A、标准状况下,2.24L丙烯中含有的σ键数目为0.8NA B、6.0gSiO2与足量HF溶液充分反应,生成SiF4的数目为0.1NA C、1.2gNaHSO4晶体中含有的数目为0.01NA D、5.6gFe与3.55g氯气充分反应后转移的电子数目为0.1NA18. 设NA为阿伏加德罗常数的值,下列说法正确的是A、1.0L1mol/LAlCl3溶液中,Al3+的数目为1.0NA B、0.2mol苯含有双键的数目为0.6NA C、电解熔融CuCl2 , 阴极增重3.2g,外电路中通过电子的数目为0.1NA D、标准状况下22.4LSO3的质量为80g19. 为阿伏加德罗常数的值.下列叙述正确的是A、金刚石中键的数目为 B、与足量水反应,转移电子数为 C、常温下,的溶液中,发生电离的水分子数为 D、含的溶液中含有的氧原子数为20. 表示阿伏加德罗常数的值,下列叙述正确的是A、一定条件下,5.6 g Fe与足量S反应,转移个电子 B、常温下,溶液中阴离子总数等于 C、电解精炼铜时每转移个电子,阳极质量一定减少32 g D、常温常压下,6 g 晶体中所含硅氧键数目为21. 科学家发现某些生物酶能将海洋中的转化为 , 该过程的总反应为。设为阿伏加德罗常数的值,下列说法正确的是A、溶液中含离子的数目为 B、标准状况下,中含键的数目为 C、18克中含电子对的数目为 D、完全反应失去电子的数目为22. 已知:。代表阿伏加德罗常数的值,下列说法错误的是A、生成电子转移数为 B、消耗生成CO分子数为 C、生成标准状况下 , 断开C-H键数为 D、消耗所生成的气体完全燃烧,需要分子数为23. 设为阿伏加德罗常数的值,下列说法正确的是A、的溶液中的数目小于 B、中价电子总数为 C、标准状况下,中含有的键数为 D、浓盐酸与反应,产生分子数为24. 设为阿伏加德罗常数的值,下列说法正确的是A、溶液中所含数目为 B、和充分反应后,所含分子数目小于 C、环氧乙烷(
B、78克Na2O2晶体中所含阴阳离子总数为3NA
C、CCl4和PCl5分子中所有原子的最外层都达到了8电子稳定结构
D、浓硫酸溶于水电离出H+和SO并放出大量的热,所以浓硫酸溶于水属于放热反应
15. 设NA表示阿伏加德罗常数的值,下列叙述中正确的是A、含4.8g碳元素的石墨晶体中的共价键数是0.8NA B、标准状况下,甲烷和氧气的混合气体共22.4L,完全燃烧后产物的分子总数可能为NA C、10g的D2O中含有的质子数与中子数分别为5NA和4NA D、常压、500℃、催化条件下,1molSO2和0.5molO2充入一密闭容器内,充分反应后的生成物分子数为NA16. 为阿伏加德罗常数的值。下列叙述中正确的是A、中含有的键的数目为 B、标准状况下,和在光照下充分反应后的分子数为 C、固体含有的离子数目为 D、一定条件下,5.6gFe与充分反应,转移的电子数为17. 设NA为阿伏加德罗常数的值,下列说法错误的是A、标准状况下,2.24L丙烯中含有的σ键数目为0.8NA B、6.0gSiO2与足量HF溶液充分反应,生成SiF4的数目为0.1NA C、1.2gNaHSO4晶体中含有的数目为0.01NA D、5.6gFe与3.55g氯气充分反应后转移的电子数目为0.1NA18. 设NA为阿伏加德罗常数的值,下列说法正确的是A、1.0L1mol/LAlCl3溶液中,Al3+的数目为1.0NA B、0.2mol苯含有双键的数目为0.6NA C、电解熔融CuCl2 , 阴极增重3.2g,外电路中通过电子的数目为0.1NA D、标准状况下22.4LSO3的质量为80g19. 为阿伏加德罗常数的值.下列叙述正确的是A、金刚石中键的数目为 B、与足量水反应,转移电子数为 C、常温下,的溶液中,发生电离的水分子数为 D、含的溶液中含有的氧原子数为20. 表示阿伏加德罗常数的值,下列叙述正确的是A、一定条件下,5.6 g Fe与足量S反应,转移个电子 B、常温下,溶液中阴离子总数等于 C、电解精炼铜时每转移个电子,阳极质量一定减少32 g D、常温常压下,6 g 晶体中所含硅氧键数目为21. 科学家发现某些生物酶能将海洋中的转化为 , 该过程的总反应为。设为阿伏加德罗常数的值,下列说法正确的是A、溶液中含离子的数目为 B、标准状况下,中含键的数目为 C、18克中含电子对的数目为 D、完全反应失去电子的数目为22. 已知:。代表阿伏加德罗常数的值,下列说法错误的是A、生成电子转移数为 B、消耗生成CO分子数为 C、生成标准状况下 , 断开C-H键数为 D、消耗所生成的气体完全燃烧,需要分子数为23. 设为阿伏加德罗常数的值,下列说法正确的是A、的溶液中的数目小于 B、中价电子总数为 C、标准状况下,中含有的键数为 D、浓盐酸与反应,产生分子数为24. 设为阿伏加德罗常数的值,下列说法正确的是A、溶液中所含数目为 B、和充分反应后,所含分子数目小于 C、环氧乙烷(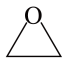 )中所含键数目为
D、常温常压下,乙醇中所含杂化的原子数目为
25. 甲酸甲酯常用作杀菌剂、熏蒸剂和烟草处理剂,可由甲酸和甲醇反应制得。NA为阿伏加德罗常数的值。下列有关说法正确的是A、pH=3的甲酸溶液中氢离子数目为1×10-3NA B、0.5 mol甲酸甲酯中含有sp3杂化的原子数目为NA C、50g质量分数为64%的甲醇水溶液中含有σ键数目为5NA D、甲醇燃料电池中,每消耗22.4L(标准状况)甲醇,转移电子数目为6NA26. 设NA为阿伏加德罗常数的值,下列说法正确的是A、标准状况下,生成2.24LO2转移的电子数为0.4NA B、2L1mol·L-1的氯化铜溶液中H+数目为4NA C、常温下,5.6g铁与足量稀硝酸反应转移的电子数为0.3NA D、2LpH=5的0.05mol·L-1K2Cr2O7溶液中数目为0.1NA27. 为阿伏加德罗常数,下列叙述中正确的是( )A、常温常压下,与混合气体共含个氧原子 B、标准状况下,22.4L乙烯中含有的键数目为 C、密闭容器中,与充分反应生成HI(g),容器内分子数小于 D、常温下与过量稀NaOH溶液反应,转移的电子总数为28. 设为阿伏加德罗常数的值,下列说法正确的是( )A、质量分数为46%的乙醇溶液中,含键的数目为 B、晶体含有离子总数为 C、含的浓硫酸与足量的镁反应,转移的电子数为 D、常温下,的溶液中,的数目为29. 设是阿伏加德罗常数的值,催化氧化脱硫的工作原理: , 时,。下列说法正确的是( )A、水中含有的氢键数为2 B、每生成 , 失去的电子数为 C、氢氧化铁的悬浊液中,若时,悬浊液中的数目为 D、反应中每产生 , 消耗数目30. 利用电催化实现CO2到C2H5OH的转化,反应原理:6H2+2CO2C2H5OH+3H2O。设NA为阿伏加德罗常数的值,下列有关说法正确的是( )A、11.2L CO2中含分子的数目为0.5 NA B、23gC2H5OH中含共价键的数目为4 NA C、生成1 mol C2H5OH转移电子的数目为8 NA D、4gH2与4gD2所含中子的数目相差NA
)中所含键数目为
D、常温常压下,乙醇中所含杂化的原子数目为
25. 甲酸甲酯常用作杀菌剂、熏蒸剂和烟草处理剂,可由甲酸和甲醇反应制得。NA为阿伏加德罗常数的值。下列有关说法正确的是A、pH=3的甲酸溶液中氢离子数目为1×10-3NA B、0.5 mol甲酸甲酯中含有sp3杂化的原子数目为NA C、50g质量分数为64%的甲醇水溶液中含有σ键数目为5NA D、甲醇燃料电池中,每消耗22.4L(标准状况)甲醇,转移电子数目为6NA26. 设NA为阿伏加德罗常数的值,下列说法正确的是A、标准状况下,生成2.24LO2转移的电子数为0.4NA B、2L1mol·L-1的氯化铜溶液中H+数目为4NA C、常温下,5.6g铁与足量稀硝酸反应转移的电子数为0.3NA D、2LpH=5的0.05mol·L-1K2Cr2O7溶液中数目为0.1NA27. 为阿伏加德罗常数,下列叙述中正确的是( )A、常温常压下,与混合气体共含个氧原子 B、标准状况下,22.4L乙烯中含有的键数目为 C、密闭容器中,与充分反应生成HI(g),容器内分子数小于 D、常温下与过量稀NaOH溶液反应,转移的电子总数为28. 设为阿伏加德罗常数的值,下列说法正确的是( )A、质量分数为46%的乙醇溶液中,含键的数目为 B、晶体含有离子总数为 C、含的浓硫酸与足量的镁反应,转移的电子数为 D、常温下,的溶液中,的数目为29. 设是阿伏加德罗常数的值,催化氧化脱硫的工作原理: , 时,。下列说法正确的是( )A、水中含有的氢键数为2 B、每生成 , 失去的电子数为 C、氢氧化铁的悬浊液中,若时,悬浊液中的数目为 D、反应中每产生 , 消耗数目30. 利用电催化实现CO2到C2H5OH的转化,反应原理:6H2+2CO2C2H5OH+3H2O。设NA为阿伏加德罗常数的值,下列有关说法正确的是( )A、11.2L CO2中含分子的数目为0.5 NA B、23gC2H5OH中含共价键的数目为4 NA C、生成1 mol C2H5OH转移电子的数目为8 NA D、4gH2与4gD2所含中子的数目相差NA