【高考真题】浙江省2024年1月普通高校招生选考化学试题
试卷更新日期:2024-02-22 类型:高考真卷
一、选择题(本大题共16小题,每小题3分,共48分,每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
-
1. 下列物质不属于电解质的是( )A、CO2 B、HCl C、NaOH D、BaSO42. 工业上将Cl2通入冷的NaOH溶液中制得漂白液,下列说法不正确的是( )A、漂白液的有效成分是NaClO B、ClO﹣水解生成HClO使漂白液呈酸性 C、通入CO2后的漂白液消毒能力增强 D、NaClO溶液比HClO溶液稳定3. 下列表示不正确的是( )A、中子数为10的氧原子:
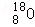 B、SO2的价层电子对互斥(VSEPR)模型:
B、SO2的价层电子对互斥(VSEPR)模型: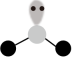 C、用电子式表示KCl的形成过程:
C、用电子式表示KCl的形成过程: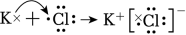 D、
D、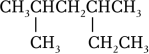 的名称:2﹣甲基4﹣乙基戊烷
4. 汽车尾气中的NO和CO在催化剂作用下发生反应:2NO+2CO2CO2+N2 , 列说法不正确的是( )(NA为阿伏加德罗常数的值)A、生成1molCO2转移电子的数目为2NA B、催化剂降低NO与CO反应的活化能 C、NO是氧化剂,CO是还原剂 D、N2既是氧化产物又是还原产物5. 在溶液中能大量共存的离子组是( )A、H+、I﹣、Ba2+、 B、Fe3+、K+、CN﹣、Cl﹣ C、Na+、、Br﹣、Ca2+ D、、、CH3COO﹣、6. 为回收利用含I2的CCl4废液,某化学兴趣小组设计方案如下所示,下列说法不正确的是( )
的名称:2﹣甲基4﹣乙基戊烷
4. 汽车尾气中的NO和CO在催化剂作用下发生反应:2NO+2CO2CO2+N2 , 列说法不正确的是( )(NA为阿伏加德罗常数的值)A、生成1molCO2转移电子的数目为2NA B、催化剂降低NO与CO反应的活化能 C、NO是氧化剂,CO是还原剂 D、N2既是氧化产物又是还原产物5. 在溶液中能大量共存的离子组是( )A、H+、I﹣、Ba2+、 B、Fe3+、K+、CN﹣、Cl﹣ C、Na+、、Br﹣、Ca2+ D、、、CH3COO﹣、6. 为回收利用含I2的CCl4废液,某化学兴趣小组设计方案如下所示,下列说法不正确的是( )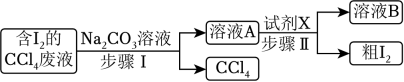 A、步骤Ⅰ中,加入足量Na2CO3溶液充分反应后,上下两层均为无色 B、步骤Ⅰ中,分液时从分液漏斗下口放出溶液A C、试剂X可用硫酸 D、粗I2可用升华法进一步提纯7. 根据材料的组成和结构变化可推测其性能变化,下列推测不合理的是( )
A、步骤Ⅰ中,加入足量Na2CO3溶液充分反应后,上下两层均为无色 B、步骤Ⅰ中,分液时从分液漏斗下口放出溶液A C、试剂X可用硫酸 D、粗I2可用升华法进一步提纯7. 根据材料的组成和结构变化可推测其性能变化,下列推测不合理的是( )材料
组成和结构变化
性能变化
A
生铁
减少含碳量
延展性增强
B
晶体硅
用碳原子取代部分硅原子
导电性增强
C
纤维素
接入带有强亲水基团的支链
吸水能力提高
D
顺丁橡胶硫
硫化使其结构由线型转变为网状
强度提高
A、A B、B C、C D、D8. 下列实验装置使用不正确的是( )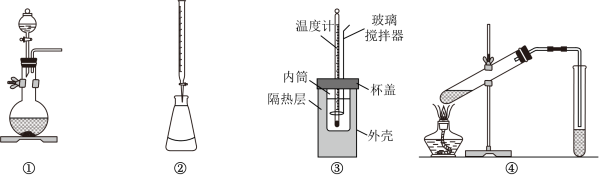 A、图①装置用于二氧化锰和浓盐酸反应制氯气 B、图②装置用于标准酸溶液滴定未知碱溶液 C、图③装置用于测定中和反应的反应热 D、图④装置用于制备乙酸乙酯9. 关于有机物检测,下列说法正确的是( )A、用浓溴水可鉴别溴乙烷、乙醛和苯酚 B、用红外光谱可确定有机物的元素组成 C、质谱法测得某有机物的相对分子质量为72,可推断其分子式为C5H12 D、麦芽糖与稀硫酸共热后加NaOH溶液调至碱性,再加入新制氢氧化铜并加热,可判断麦芽糖是否水解10. 下列化学反应与方程式不相符的是( )A、黑火药爆炸:S+2KNO3+3CK2S+N2↑+3CO2↑ B、四氯化钛水解:TiCl4+(x+2)H2OTiO2⋅xH2O↓+4HCl C、硫化钠溶液在空气中氧化变质:2S2﹣+O2+4H+═2S↓+2H2O D、硬脂酸甘油酯在NaOH溶液中皂化:
A、图①装置用于二氧化锰和浓盐酸反应制氯气 B、图②装置用于标准酸溶液滴定未知碱溶液 C、图③装置用于测定中和反应的反应热 D、图④装置用于制备乙酸乙酯9. 关于有机物检测,下列说法正确的是( )A、用浓溴水可鉴别溴乙烷、乙醛和苯酚 B、用红外光谱可确定有机物的元素组成 C、质谱法测得某有机物的相对分子质量为72,可推断其分子式为C5H12 D、麦芽糖与稀硫酸共热后加NaOH溶液调至碱性,再加入新制氢氧化铜并加热,可判断麦芽糖是否水解10. 下列化学反应与方程式不相符的是( )A、黑火药爆炸:S+2KNO3+3CK2S+N2↑+3CO2↑ B、四氯化钛水解:TiCl4+(x+2)H2OTiO2⋅xH2O↓+4HCl C、硫化钠溶液在空气中氧化变质:2S2﹣+O2+4H+═2S↓+2H2O D、硬脂酸甘油酯在NaOH溶液中皂化: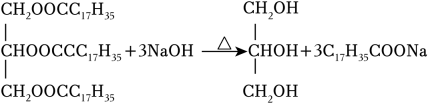 11. 制造隐形眼镜的功能高分子材料Q的合成路线如图:
11. 制造隐形眼镜的功能高分子材料Q的合成路线如图:
下列说法不正确的是( )
A、试剂a为NaOH乙醇溶液 B、Y易溶于水 C、Z的结构简式可能为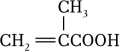 D、M分子中有3种官能团
12. X、Y、Z、M和Q五种主族元素,原子序数依次增大,X原子半径最小,短周期中M电负性最小,Z与Y、Q相邻,基态Z原子的s能级与p能级的电子数相等,下列说法不正确的是( )A、沸点:X2Z>X2Q B、M与Q可形成化合物M2Q、M2Q2 C、化学键中离子键成分的百分数:M2Z>M2Q D、与离子空间结构均为三角锥形13. 破损的镀锌铁皮在氨水中发生电化学腐蚀,生成[Zn(NH3)4]2+和H2 , 下列说法不正确的是( )A、氨水浓度越大,腐蚀趋势越大 B、随着腐蚀的进行,溶液pH变大 C、铁电极上的电极反应式为:2NH3+2e﹣═2+H2↑ D、每生成标准状况下224mLH2 , 消耗0.010molZn14. 酯在NaOH溶液中发生水解反应,历程如下:
D、M分子中有3种官能团
12. X、Y、Z、M和Q五种主族元素,原子序数依次增大,X原子半径最小,短周期中M电负性最小,Z与Y、Q相邻,基态Z原子的s能级与p能级的电子数相等,下列说法不正确的是( )A、沸点:X2Z>X2Q B、M与Q可形成化合物M2Q、M2Q2 C、化学键中离子键成分的百分数:M2Z>M2Q D、与离子空间结构均为三角锥形13. 破损的镀锌铁皮在氨水中发生电化学腐蚀,生成[Zn(NH3)4]2+和H2 , 下列说法不正确的是( )A、氨水浓度越大,腐蚀趋势越大 B、随着腐蚀的进行,溶液pH变大 C、铁电极上的电极反应式为:2NH3+2e﹣═2+H2↑ D、每生成标准状况下224mLH2 , 消耗0.010molZn14. 酯在NaOH溶液中发生水解反应,历程如下: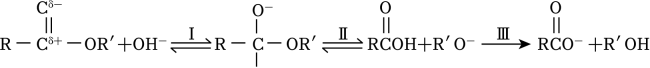
已知:
①
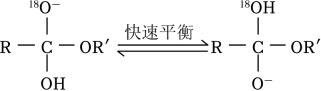
②RCOOCH2CH3水解相对速率与取代基R的关系如下表:
取代基R
CH3
ClCH2
Cl2CH
水解相对速率
1
290
7200
下列说法不正确的是( )
A、步骤Ⅰ是OH﹣与酯中Cδ+作用 B、步骤Ⅲ使Ⅰ和Ⅱ平衡正向移动,使酯在NaOH溶液中发生的水解反应不可逆 C、酯的水解速率:FCH2COOCH2CH3>ClCH2COOCH2CH3 D、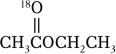 与OH﹣反应、
与OH﹣反应、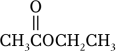 与18OH﹣反应,两者所得醇和羧酸盐均不同
15. 常温下、将等体积、浓度均为0.40mol•L﹣1BaCl2溶液与新制H2SO3溶液混合,出现白色浑浊;再滴加过量的H2O2溶液,振荡,出现白色沉淀。
与18OH﹣反应,两者所得醇和羧酸盐均不同
15. 常温下、将等体积、浓度均为0.40mol•L﹣1BaCl2溶液与新制H2SO3溶液混合,出现白色浑浊;再滴加过量的H2O2溶液,振荡,出现白色沉淀。已知:H2SO3 Ka1=1.4×10﹣2 , Ka2=6.0×10﹣8。Ksp(BaSO3)=5.0×10﹣10 , Ksp(BaSO4)=1.1×10﹣10。
下列说法不正确的是( )
A、H2SO3溶液中存在c(H+)>c()>c()>c(OH﹣) B、将0.40mol•L﹣1H2SO3溶液稀释到0.20mol•L﹣1 , c()几乎不变 C、BaCl2溶液与H2SO3溶液混合后出现的白色浑浊不含有BaSO3 D、存在反应Ba2++H2SO3+H2O2═BaSO4↓+2H++H2O是出现白色沉淀的主要原因16. 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确的是( )实验目的
方案设计
现象
结论
A
探究Cu和浓HNO3反应后溶液呈绿色的原因
将NO2通入下列溶液至饱和:
①浓HNO3
②Cu(NO3)2和HNO3混合溶液
①无色变黄色
②蓝色变绿色
Cu和浓HNO3反应后溶液呈绿色的主要原因是溶有NO2
B
比较F﹣与SCN﹣结合Fe3+的能力
向等物质的量浓度的KF和KSCN混合溶液中滴加几滴FeCl3溶液,振荡
溶液颜色无明显变化
结合Fe3+的能力:F﹣>SCN﹣
C
比较HF与H2SO3的酸性
分别测定等物质的量浓度的NH4F与(NH4)2SO3溶液的pH
前者pH小
酸性:HF>H2SO3
D
探究温度对反应速率的影响
等体积、等物质的量浓度的Na2S2O3与H2SO4溶液在不同温度下反应
温度高的溶液中先出现浑浊
温度升高,该反应速率加快
A、A B、B C、C D、D二、非选择题(本大题共5小题,共52分)
-
17. 氮和氧是构建化合物的常见元素。
已知:
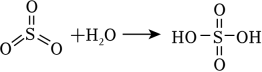
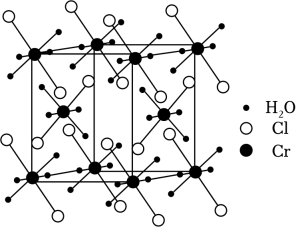
请回答:
(1)、某化合物的晶胞如图,其化学式是 , 晶体类型是 。(2)、下列说法正确的是 。A、电负性:B>N>O B、离子半径:P3﹣<S2﹣<Cl﹣ C、第一电离能:Ge<Se<As D、基态Cr的简化电子排布式:[Ar]3d4(3)、①H2N﹣NH2+H+→H2N﹣ , 其中﹣NH2的N原子杂化方式为 ;比较键角∠HNH:H2N﹣NH2中的﹣NH2H2N﹣中的﹣(填“>”、“<”或“=”),请说明理由 。②将HNO3与SO3按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是。比较氧化性强弱: HNO3(填“>”、“<”或“=”);写出A中阴离子的结构式 。
18. 固态化合物Y的组成为MgCaFeMn(CO3)4 , 以Y为原料实现如图转化。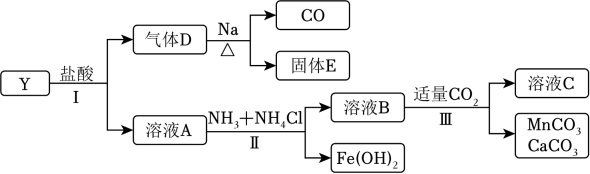
已知:NH3与溶液A中金属离子均不能形成配合物。
请回答:
(1)、依据步骤Ⅲ,MnCO3、CaCO3和MgCO3中溶解度最大的是 。写出溶液C中的所含有的阴离子 。步骤Ⅱ中,加入NH4Cl的作用是 。(2)、下列说法正确的是 。A、气体D是形成酸雨的主要成分 B、固体E可能含有Na2CO3 C、Mn(OH)2可溶于NH4Cl溶液 D、碱性:Ca(OH)2<Fe(OH)2(3)、酸性条件下,固体NaBiO3(微溶于水,其还原产物为无色的Bi3+)可氧化Mn2+为 , 根据该反应原理,设计实验验证Y中含有Mn元素 ;写出Mn2+转化为的离子方程式 。19. 通过电化学、热化学等方法,将CO2转化为HCOOH等化学品,是实现“双碳”目标的途径之一。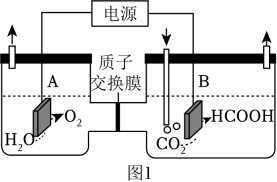
请回答:
(1)、某研究小组采用电化学方法将CO2转化为HCOOH,装置如图1。电极B上的电极反应式是 。(2)、该研究小组改用热化学方法,相关热化学方程式如下:Ⅰ:C(s)+O2(g)═CO2(g)
ΔH1=﹣393.5kJ•mol﹣1
Ⅱ:C(s)+H2(g)+O2(g)═HCOOH(g)
ΔH2=﹣378.7kJ•mol﹣1
Ⅲ:CO2(g)+H2(g)⇌HCOOH(g)
ΔH3
①ΔH3=kJ•mol﹣1。
②反应Ⅲ在恒温、恒容的密闭容器中进行,CO2和H2的投料浓度均为1.0mol•L﹣1 , 平衡常数K=2.4×10﹣8 , 则CO2的平衡转化率为 。
③用氨水吸收HCOOH,得到1.00mol•L﹣1氨水和0.18mol•L﹣1甲酸铵的混合溶液,298K时该混合溶液的pH=。[已知:298K时,电离常数Kb(NH3•H2O)=1.8×10﹣5、Ka(HCOOH)=1.8×10﹣4]
(3)、为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂M的DMSO(有机溶剂)溶液,CO2和H2在溶液中反应制备HCOOH,反应过程中保持CO2(g)和H2(g)的压强不变,总反应CO2+H2⇌HCOOH的反应速率为v,反应机理如下列三个基元反应,各反应的活化能E2<E1<<E3(不考虑催化剂活性降低或丧失)。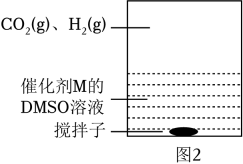
Ⅳ:M+CO2⇌Q
E1
Ⅴ:Q+H2⇌L
E2
Ⅴ:L⇌M+HCOOH
E3
①催化剂M足量条件下,下列说法正确的是 ____。
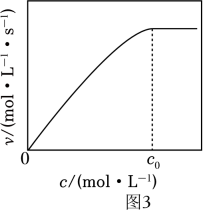
A、v与CO2(g)的压强无关 B、v与溶液中溶解H2的浓度无关 C、温度升高,v不一定增大 D、在溶液中加入N(CH2CH3)3 , 可提高CO2转化率(4)、②实验测得:298K,p(CO2)=p(H2)=2MPa下,v随催化剂M浓度c变化如图3。c⩽c0时,v随c增大而增大:c>c0时,v不再显著增大。请解释原因。
 20. H2S可用于合成光电材料。某兴趣小组用CaS与MgCl2反应制备液态H2S,实验装置如图,反应方程式为:CaS+MgCl2+2H2O═CaCl2+Mg(OH)2+H2S↑
20. H2S可用于合成光电材料。某兴趣小组用CaS与MgCl2反应制备液态H2S,实验装置如图,反应方程式为:CaS+MgCl2+2H2O═CaCl2+Mg(OH)2+H2S↑已知:①H2S的沸点是61℃,有毒:
②装置A内产生的H2S气体中含有酸性气体杂质。
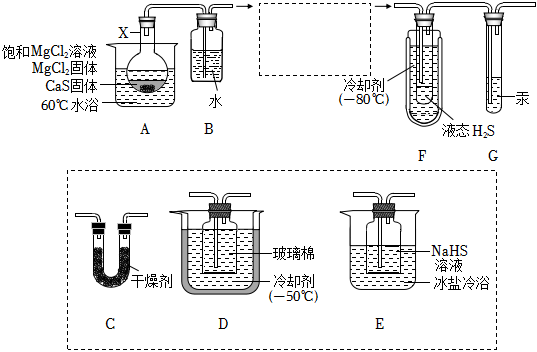
请回答:
(1)、仪器X的名称是 。(2)、完善虚框内的装置排序:A→B→→→→F+G(3)、下列干燥剂,可用于装置C中的是 。A、氢氧化钾 B、五氧化二磷 C、氯化钙 D、碱石灰(4)、装置G中汞的两个作用是:①平衡气压:②。(5)、下列说法正确的是 。A、该实验操作须在通风橱中进行 B、装置D的主要作用是预冷却H2S C、加入的MgCl2固体,可使MgCl2溶液保持饱和,有利于平稳持续产生H2S D、该实验产生的尾气可用硝酸吸收(6)、取0.680gH2S产品,与足量CuSO4溶液充分反应后,将生成的CuS置于已恒重、质量为31.230g的坩埚中,煅烧生成CuO,恒重后总质量为32.814g。产品的纯度为 。21. 某研究小组通过下列路线合成镇静药物氯硝西泮。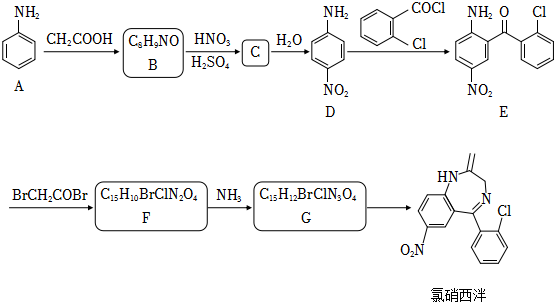
已知:
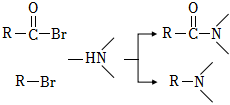
请回答:
(1)、化合物E的含氧官能团的名称是 。(2)、化合物C的结构简式是 。(3)、下列说法不正确的是 。A、化合物A→D的过程中,采用了保护氨基的方法 B、化合物A的碱性比化合物D弱 C、化合物B在氢氧化钠溶液加热的条件下可转化为化合物A D、化合物G→氯硝西泮的反应类型为取代反应(4)、写出F→G的化学方程式 。(5)、聚乳酸( )是一种可降解高分子,可通过化合物X(
)是一种可降解高分子,可通过化合物X( )开环聚合得到,设计以乙炔为原料合成X的路线 (用流程图表示,无机试剂任选)。 (6)、写出同时符合下列条件的化合物B的同分异构体的结构简式 。
)开环聚合得到,设计以乙炔为原料合成X的路线 (用流程图表示,无机试剂任选)。 (6)、写出同时符合下列条件的化合物B的同分异构体的结构简式 。①分子中含有二取代的苯环:
②1H﹣NMR谱和IR谱检测表明:分子中共有4种不同化学环境的氢原子,无碳氧单键。