北京市西城区2023-2024学年九年级上学期期末化学试卷
试卷更新日期:2024-02-20 类型:期末考试
一、选择题
-
1. 空气成分中,体积分数约为78%的是A、氮气 B、氧气 C、稀有气体 D、二氧化碳2. 各种元素在地壳里的含量(质量分数)如图,其中含量最多的元素是
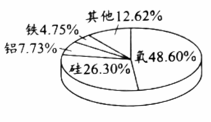 A、氧 B、硅 C、铝 D、铁3. 发现元素周期律的科学家是A、道尔顿 B、拉瓦锡 C、门捷列夫 D、阿伏加德罗4. 下列属于金属元素的是A、H B、S C、Ag D、N5. “加碘食盐”中的“碘”指的是A、单质 B、元素 C、分子 D、原子6. 下列安全图标中,表示“禁止燃放鞭炮”的是A、
A、氧 B、硅 C、铝 D、铁3. 发现元素周期律的科学家是A、道尔顿 B、拉瓦锡 C、门捷列夫 D、阿伏加德罗4. 下列属于金属元素的是A、H B、S C、Ag D、N5. “加碘食盐”中的“碘”指的是A、单质 B、元素 C、分子 D、原子6. 下列安全图标中,表示“禁止燃放鞭炮”的是A、 B、
B、 C、
C、 D、
D、 7. 下列元素符号书写不正确的是A、钠Na B、氯Cl C、铜Cu D、锌ZN8. 下列仪器中,可以加热的是A、量筒 B、试管 C、集气瓶 D、胶头滴管9. 下列实验操作正确的是A、点燃酒精灯
7. 下列元素符号书写不正确的是A、钠Na B、氯Cl C、铜Cu D、锌ZN8. 下列仪器中,可以加热的是A、量筒 B、试管 C、集气瓶 D、胶头滴管9. 下列实验操作正确的是A、点燃酒精灯 B、量取液体
B、量取液体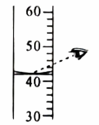 C、加热液体
C、加热液体 D、取粉末状固体
D、取粉末状固体 10. 下列物质的化学式书写不正确的是A、氯化钾KCl B、氧化铜CuO C、氢氧化镁MgOH D、碳酸钠Na2CO311. 下列关于物质用途的说法不正确的是A、氢气用作清洁燃料 B、干冰用于人工降雨 C、氧气用于食品防腐 D、氮气用于充填灯泡12. 垃圾分类利国利民,旧杂志属于A、厨余垃圾 B、可回收物 C、有害垃圾 D、其他垃圾13. 全球增温潜势(GWP)表示一种温室气体产生的温室效应与等质量CO2产生的温室效应的比值(见右表)。下列气体中产生温室效应最强的是
10. 下列物质的化学式书写不正确的是A、氯化钾KCl B、氧化铜CuO C、氢氧化镁MgOH D、碳酸钠Na2CO311. 下列关于物质用途的说法不正确的是A、氢气用作清洁燃料 B、干冰用于人工降雨 C、氧气用于食品防腐 D、氮气用于充填灯泡12. 垃圾分类利国利民,旧杂志属于A、厨余垃圾 B、可回收物 C、有害垃圾 D、其他垃圾13. 全球增温潜势(GWP)表示一种温室气体产生的温室效应与等质量CO2产生的温室效应的比值(见右表)。下列气体中产生温室效应最强的是温室气体
GWP
甲烷
29.8
一氧化二氮
273
氟利昂
6226
六氟化硫
22800
A、甲烷 B、一氧化二氮 C、氟利昂 D、六氟化硫14. 六氟化硫(SF6)是常见的温室气体。下列关于SF6的说法不正确的是A、由两种元素组成 B、1个六氟化硫分子由7个原子构成 C、相对分子质量为146g D、氟元素的质量分数计算式为15. 下列不属于新能源的是A、太阳能 B、地热能 C、核能 D、化石能源16. 下列做法不利于缓解全球气候变暖的是A、露天焚烧秸秆 B、教室人走灯熄 C、共享单车出行 D、大力植树造林17. 下列做法不利于保护水资源的是A、洗菜废水冲洗厕所 B、生活污水直接排放 C、水管漏水及时维修 D、合理使用化肥农药18. 氢元素和氧元素的本质区别是A、质子数不同 B、中子数不同 C、相对原子质量不同 D、最外层电子数不同19. 下列符号中,表示两个氢原子的是A、2H B、H+ C、H2 D、2H220. 下列物质中含有氧分子的是A、H2O B、KMnO4 C、O2 D、CO221. 下列方法能鉴别氮气和二氧化碳的是A、闻气味 B、观察颜色 C、伸入燃着的木条 D、倒入澄清石灰水22. 下列化学方程式书写正确的是A、 B、 C、 D、23. 下列物质均可在氧气中燃烧,可能生成氮气的是A、C2H4 B、NH3 C、H2S D、pH324. 硒元素在元素周期表中的信息如图,下列说法不正确的是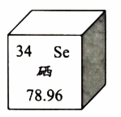 A、元素符号是Se B、核电荷数为34 C、原子序数为34 D、相对原子质量为3425. 硒原子的核外电子数是A、34 B、45 C、79 D、11326. 硒化亚铁中硒元素的化合价是A、-2 B、+2 C、-3 D、+327. 下列硒化亚铁的性质中,属于化学性质的是A、黑色晶体 B、密度4.72g/cm3 C、熔点965℃ D、高温下易分解28. 硒化亚铁与盐酸可发生反应: , X的化学式是A、Se B、H2 C、Se2Cl2 D、H2Se29. 四氟化氙(XeF4)是人类较早认识的稀有气体化合物之一,下图是制取XeF4反应前后分子种类变化的微观示意图。下列说法不正确的是
A、元素符号是Se B、核电荷数为34 C、原子序数为34 D、相对原子质量为3425. 硒原子的核外电子数是A、34 B、45 C、79 D、11326. 硒化亚铁中硒元素的化合价是A、-2 B、+2 C、-3 D、+327. 下列硒化亚铁的性质中,属于化学性质的是A、黑色晶体 B、密度4.72g/cm3 C、熔点965℃ D、高温下易分解28. 硒化亚铁与盐酸可发生反应: , X的化学式是A、Se B、H2 C、Se2Cl2 D、H2Se29. 四氟化氙(XeF4)是人类较早认识的稀有气体化合物之一,下图是制取XeF4反应前后分子种类变化的微观示意图。下列说法不正确的是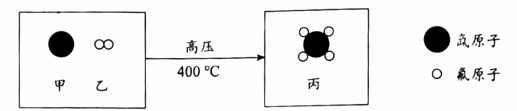 A、稀有气体在一定条件下能发生化学反应 B、参加反应的甲和乙的质量比为131:38 C、参加反应的乙和生成的丙的分子个数比为2:1 D、反应前后原子的种类和个数不变30. 利用图1装置研究H2O2的分解反应,所得结果如图2所示。下列说法不正确的是
A、稀有气体在一定条件下能发生化学反应 B、参加反应的甲和乙的质量比为131:38 C、参加反应的乙和生成的丙的分子个数比为2:1 D、反应前后原子的种类和个数不变30. 利用图1装置研究H2O2的分解反应,所得结果如图2所示。下列说法不正确的是图1
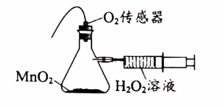 图2
图2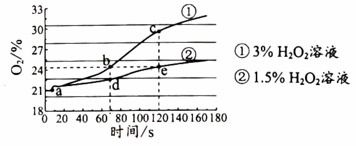 A、图2中的a点对应的操作是推动注射器活塞 B、对比b点和e点不能验证反应速率与H2O2的浓度有关 C、对比c点和e点可以验证反应速率与H2O2的浓度有关 D、该实验不能证明MnO2对H2O2的分解起催化作用
A、图2中的a点对应的操作是推动注射器活塞 B、对比b点和e点不能验证反应速率与H2O2的浓度有关 C、对比c点和e点可以验证反应速率与H2O2的浓度有关 D、该实验不能证明MnO2对H2O2的分解起催化作用二、非选择题
-
31. 常见食品干燥剂的主要成分如下表。
干燥剂
生石灰干燥剂
硫酸钙干燥剂
主要成分
CaO
CaSO4
(1)、其中属于氧化物的是(填化学式)。(2)、生石灰干燥剂吸水后转化为氢氧化钙,反应的化学方程式为。32. 二氧化硫(SO2)是葡萄酒生产中常用的抗氧化剂。(1)、SO2中硫元素和氧元素的质量比为。(2)、SO2是大气污染物之一,造成的环境问题是。33. 氧气曾叫做“养气”,说明氧气的重要性。(1)、氧气可用于医疗急救,是因为氧气能。(2)、工业生产常用铁管输送氧气。①铁属于(填“单质”或“化合物”)。
②若管道阀门使用不当,会造成铁管剧烈燃烧爆炸,反应的化学方程式为。
34. 天然气(主要成分甲烷)是常见的家用燃气。(1)、煤、、天然气都属于化石燃料。(2)、甲烷(CH4)充分燃烧的化学方程式为。(3)、燃气燃烧不充分时,火焰呈黄色此时应采取的措施是____(填序号)。A、调大燃气阀门 B、调大进风口(4)、在燃气中添加有臭味的乙硫醇(C2H5SH),可警示泄漏。配平乙硫醇燃烧的化学方程式:(5)、发生火灾时,应迅速关闭燃气阀门。该做法利用的灭火原理是。35. 含磷化合物可引起水体富营养化。(1)、向水样中加入氯化钙使含磷化合物转化沉淀,除去沉淀的操作是。氯离子的符号是。(2)、降低(1)中所得水样硬度的方法是。36. 科学家提出一种海水淡化技术,其原理如下图。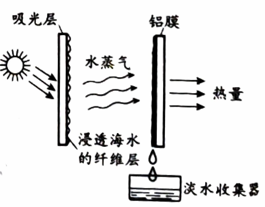 (1)、海水属于(填“混合物”或“纯净物”)。(2)、该技术利用的净水方法是。(3)、海水转化为淡水的过程中,不发生变化的是____(填序号)。A、分子种类 B、分子间隔 C、分子质量(4)、铝膜中的金属铝可通过电解熔融氧化铝制得,同时生成氧气,反应的化学方程式为。37. 阅读下面科普短文。
(1)、海水属于(填“混合物”或“纯净物”)。(2)、该技术利用的净水方法是。(3)、海水转化为淡水的过程中,不发生变化的是____(填序号)。A、分子种类 B、分子间隔 C、分子质量(4)、铝膜中的金属铝可通过电解熔融氧化铝制得,同时生成氧气,反应的化学方程式为。37. 阅读下面科普短文。柔性屏幕具有轻薄、能耗低、亮度高、可弯曲等特点,被广泛应用于曲面屏电视、折叠屏手机等电子产品。

常见的柔性屏幕主要由涂层和柔性基板组成。其中,聚酰亚胺薄膜是柔性基板的常见材科,它可由二元酐(C10H2O6)和二元胺(C12H12ON2)合成制备,具有良好的耐热性、尺寸稳定性等。
为进一步提升薄膜的性能,科研人员在制备聚酰亚胺薄膜时加入了不同配比的试剂,分别测试了薄膜的耐热性和不同温度下的尺寸稳定性,结果见表1和图1。表1中当玻璃化转化温度大于450℃时,薄膜时热性优异;图1中尺寸变化越大,薄膜尺寸稳定性越差。
表1不同试剂配比及其对薄膜耐热性的影响
试剂配比序号
试剂1配比/%
试剂2配比%
玻璃化转化温度/℃
1
100
0
408
2
80
20
419
3
60
40
446
4
50
50
>450
5
40
60
>450
6
20
80
>450
7
0
100
>450
图1
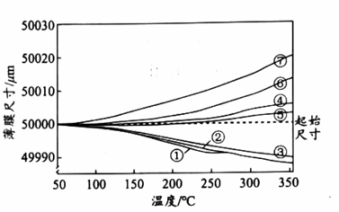
我国科学家表示,柔性屏幕还可用于裸眼3D显示器、可穿戴设备等多种电子产品。
依据文章内容回答下列问题。
(1)、C10H2O6中碳、氧原子的个数比为。(2)、柔性屏幕具有的特点:(答1条即可)。(3)、判断下列说法是否正确(填“对”或“错”)。①聚酰亚胺薄膜具有良好的耐热性和尺寸稳定性。。
②在耐热性的测试实验中,每组实验都加入了两种试剂。。
(4)、由图1可知,350℃时,薄膜尺寸缩小的实验组有(填序号)。(5)、综合图表分析,在实验研究范围内,⑤是最佳试剂配比的理由是。38. 中科院大连化物所研发了二氧化碳加氢制汽油的新型储能技术,其主要工艺流程如下: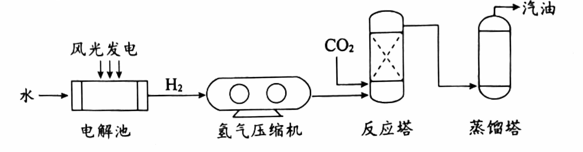 (1)、电解池中,发生的反应属于基本反应类型中的。(2)、整个流程中,只发生物理变化的设备有。(3)、关于该技术的说法正确的是____(填序号)。A、可捕集CO2缓解温室效应 B、可生产不含硫元素的汽油 C、能量的转化形式:风能、光能→电能→化学能39. 镁基储氢材料(主要成分Mg)是极具应用前景的储氢材料。储氢、释氢过程中涉及的部分物质转化如下:
(1)、电解池中,发生的反应属于基本反应类型中的。(2)、整个流程中,只发生物理变化的设备有。(3)、关于该技术的说法正确的是____(填序号)。A、可捕集CO2缓解温室效应 B、可生产不含硫元素的汽油 C、能量的转化形式:风能、光能→电能→化学能39. 镁基储氢材料(主要成分Mg)是极具应用前景的储氢材料。储氢、释氢过程中涉及的部分物质转化如下: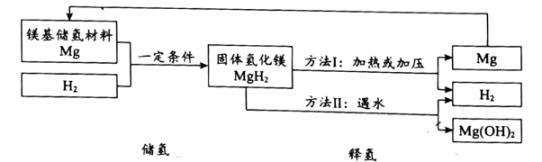 (1)、储氢过程,发生化合反应的化学方程式为。(2)、释氢过程:
(1)、储氢过程,发生化合反应的化学方程式为。(2)、释氢过程:①方法I,化合价发生改变的元素有。
②方法Ⅱ,产生H2的质量(填“<”“=”或“>”)参加反应的MgH2中氢元素的质量。
③与方法I相比,方法Ⅱ的优点是(答1条即可)。
40. 实验室用下图所示装置制备并收集气体。气体
O2
CO2
药品
高锰酸钾
大理石和稀盐酸
仪器
己选
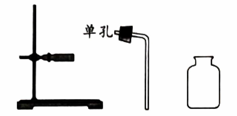
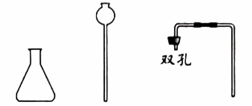
待选
试管 ☐ 酒精灯☐
集气瓶☐ 酒精灯☐
(1)、上述实验中制备O2的化学方程式为 , 选择向上排空气法收集O2的原因是。(2)、上述实验中制备CO2的化学方程式为。(3)、从待选仪器中选全必需的仪器41. 用下图实验研究O2和CO2的性质。实验1
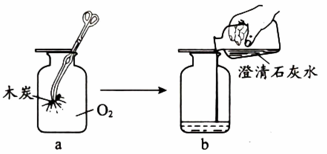 实验2
实验2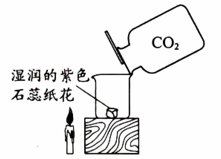 (1)、实验1:
(1)、实验1:①a中观察到木炭剧烈燃烧、、放热。
②b中石灰水变浑浊,反应的化学方程式为。
(2)、实验2,缓慢倒入CO2 , 观察到湿润的紫色石蕊纸花变红,蜡烛熄灭。①证明CO2和水发生反应,还需补充的操作是。CO2和水反应的化学方程式为。
②蜡烛和纸花的现象均能证明CO2具有的性质是。
42. 下图实验可测定空气中O2的含量(夹持装置已略去)。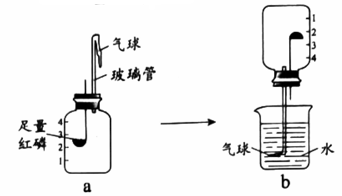 (1)、红磷燃烧的化学方程式为。(2)、红磷足量的目的是。(3)、待a中红磷燃烧停止,冷却至室温时,将装置倒置于烧杯中,取下b中导管口处的气球,观察到的现象是。(4)、气球的作用是。43. 用下图实验探究水的组成。
(1)、红磷燃烧的化学方程式为。(2)、红磷足量的目的是。(3)、待a中红磷燃烧停止,冷却至室温时,将装置倒置于烧杯中,取下b中导管口处的气球,观察到的现象是。(4)、气球的作用是。43. 用下图实验探究水的组成。实验1
 实验2
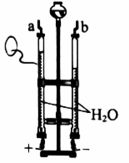
实验2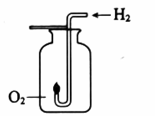 (1)、实验1:
(1)、实验1:①将燃着的木条放在a管尖嘴口,打开活塞,观察到的现象是 , 由此得出的推论是(填序号)。
A.水中含有氢元素 B.水中含有氧元素
C.水由氢、氧两种元素组成
②在方框内补全电解水反应的微观示意图。
 (2)、实验2,观察到集气瓶内壁有无色液滴产生。经检验产物只有水,该反应的化学方程式为。该反应也可验证水的组成,从元素守恒的角度说明理由:。44. 用下图装置进行实验。
(2)、实验2,观察到集气瓶内壁有无色液滴产生。经检验产物只有水,该反应的化学方程式为。该反应也可验证水的组成,从元素守恒的角度说明理由:。44. 用下图装置进行实验。实验1
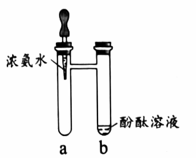 实验2
实验2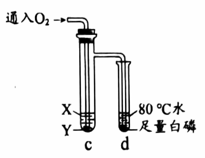 (1)、实验1,将浓氨水滴入a管中,b中溶液变红,从微观角度解释上述现象:。(2)、实验2,验证可燃物燃烧的条件。资料:白磷着火点为40℃。
(1)、实验1,将浓氨水滴入a管中,b中溶液变红,从微观角度解释上述现象:。(2)、实验2,验证可燃物燃烧的条件。资料:白磷着火点为40℃。①对比d中通入氧气前后的现象,由此得出可燃物燃烧的条件是。
②d中热水的作用是。
③该实验还可以验证可燃物燃烧的另一个条件,c中X、Y分别是。
45. 用下图装置研究质量守恒定律。实验1
 实验2
实验2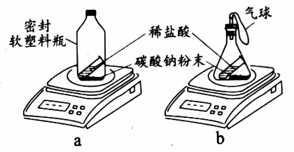 (1)、实验1能验证质量守恒定律,现象是锥形瓶中 , 电子天平示数。(2)、实验2,观察到电子天平示数a中不变、b中变小。b中电子天平示数变小的原因是。46. 活性炭常用于净水。以开心果壳为原料可以制备活性炭,使用后的活性炭通过再生处理能够恢复一定的吸附性。
(1)、实验1能验证质量守恒定律,现象是锥形瓶中 , 电子天平示数。(2)、实验2,观察到电子天平示数a中不变、b中变小。b中电子天平示数变小的原因是。46. 活性炭常用于净水。以开心果壳为原料可以制备活性炭,使用后的活性炭通过再生处理能够恢复一定的吸附性。【查阅资料】
活性炭对亚甲基蓝和碘的吸附量可以衡量其吸附效果,吸附量越高,吸附效果越好。
I.制备开心果壳活性炭,流程如下图:
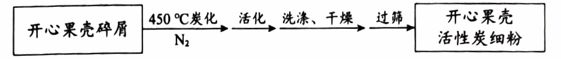
【解释与结论】
(1)、炭化和活化过程均发生了化学变化。①炭化过程,用N2作为保护气,利用N2的主要性质是。
②活化过程,需将炭化得到的炭粉和加入的活化剂充分研磨,其目的是。
(2)、过筛的目的是除去(填“大于”或“小于”)筛子网眼直径的颗粒。(3)、Ⅱ.探究影响开心果壳活性炭吸附效果的因素【进行实验】室温下,称取2mg开心果壳活性炭置于250mL锥形瓶中,加入100mL一定浓度的亚甲基蓝溶液,密封,吸附一定时间,过滤后测定吸附量。结果如下表:
序号
亚甲基蓝初始浓度/mg.L-1
吸附时间/min
吸附量/mg.g-1
1
100
30
133.9
2
150
30
148.5
3
200
30
149.8
4
200
50
183.8
5
200
70
204.2
6
250
30
150.6
7
300
30
209.5
【解释与结论】
①②③⑥⑦的目的是。
(4)、下列亚甲基蓝初始浓度范围中,随亚甲基蓝初始浓度增大,活性炭吸附效果变化最大的是____(填序号)。A、100~150mg.L-1 B、150-200mg.L-1 C、200~250mg.L-1 D、250-300mg.L-1(5)、由③④⑤可以得到的结论是。(6)、Ⅲ.探究使用后的活性炭的再生效果【进行实验】用三种不同方法将使用后的活性炭进行再生处理,通过测定碘吸附量,比较再生效果。结果如下表:
活性炭种类
未使用的活性炭
使用后的活性炭
再生活性炭
方法1
方法2
方法3
碘吸附量/mg.g-1
637
373
611
630
565
【解释与结论】
三种方法中再生效果最好的是(填序号)。
(7)、三种方法都能使活性炭再生,判断的依据是。(8)、【反思与评价】继续实验,发现升高温度,开心果壳活性炭的吸附效果增强。补全实验方案:称取2mg开心果壳活性炭置于250mL锥形瓶中,。
47. 高纯氟化氢是制造芯片的关键材料。生产氟化氢的主要反应为。若制得40kgHF,计算参加反应的H2SO4的质量(写出计算过程及结果)。