安徽省合肥市肥西县2023-2024学年九年级上学期期末化学试题
试卷更新日期:2024-02-20 类型:期末考试
一、选择题
-
1. 下列生活现象中发生物理变化的是A、面包发霉 B、葡萄酿酒 C、瓷碗破碎 D、铁锅生锈2. 下列物质的用途体现物质化学性质的是A、石墨制作电极——导电性 B、氮气作保护气——稳定性 C、氦气填充气球——密度小 D、干冰人工降雨——易升华3. 2023年第52个世界环境日,中国确立的主题是“建设人与自然和谐共生的现代化”。下列做法错误的是A、多单选公共交通工具,鼓励绿色出行 B、合理配置室内照明光源,节约用电 C、网购包装用品分类回收,综合利用 D、全面禁止使用化石燃料,治理雾霾4. “见著知微,见微知著”是一种常见的化学思维方法。对下列事实用微粒的知识解释不正确的是
选项
事实
解释
A
氢气和液氢都可作燃料
构成物质的分子相同
B
水有三态变化
水分子的大小随温度改变而改变
C
金刚石硬,石墨质软
碳原子排列方式不同
D
晴天花更香
温度越高分子运动的速度越快
A、A B、B C、C D、D5. 如图是检查装置气密性的过程。最终在F处观察到的现象是( ) A、甲 B、乙 C、丙 D、丁6. “宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方法。某化学反应的微观示意图如图所示,下列说法正确的是
A、甲 B、乙 C、丙 D、丁6. “宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方法。某化学反应的微观示意图如图所示,下列说法正确的是 A、从微观构成看:有三种物质由分子构成 B、从物质分类看:该反应涉及到3种氧化物 C、从反应价值看:该反应能获取清洁能源,延缓温室效应 D、从表示方法看:该反应的化学方程式为7. 民间常用川乌、草乌泡制药酒。川乌、草乌含有少量有毒物质乌头碱(化学式为),药酒使用不当会造成中毒。下列关于乌头碱的说法不正确的是A、乌头碱在空气中充分燃烧只生成和 B、乌头碱分子中C、H原子个数比为34:47 C、乌头碱中所含碳元素质量分数最大 D、每个乌头碱分子由93个原子构成8. 化学符号具有独特的学科内涵。下列各项对相关符号含义的说法正确的是A、Cu只能表示金属铜 B、只能表示2个二氧化硫分子 C、
A、从微观构成看:有三种物质由分子构成 B、从物质分类看:该反应涉及到3种氧化物 C、从反应价值看:该反应能获取清洁能源,延缓温室效应 D、从表示方法看:该反应的化学方程式为7. 民间常用川乌、草乌泡制药酒。川乌、草乌含有少量有毒物质乌头碱(化学式为),药酒使用不当会造成中毒。下列关于乌头碱的说法不正确的是A、乌头碱在空气中充分燃烧只生成和 B、乌头碱分子中C、H原子个数比为34:47 C、乌头碱中所含碳元素质量分数最大 D、每个乌头碱分子由93个原子构成8. 化学符号具有独特的学科内涵。下列各项对相关符号含义的说法正确的是A、Cu只能表示金属铜 B、只能表示2个二氧化硫分子 C、 只能表示氖原子结构示意图
D、只能表示硝酸根离子
9. 下列关于电解水实验的说法中,正确的是( )
只能表示氖原子结构示意图
D、只能表示硝酸根离子
9. 下列关于电解水实验的说法中,正确的是( ) A、管a中的气体为H2 B、与管a相连的是电源的正极 C、管a与管b中气体质量比为2:1 D、该实验可说明水由H2和O2组成10. 利用数据传感技术比较块状和粉末状的碳酸钙与足量稀盐酸反应 的快慢。按下图装置进行实验,倾斜锥形瓶,使 10 mL 稀盐酸与固体 充分接触,瓶内气压随时间的变化如图。下列有关说法不正确的是
A、管a中的气体为H2 B、与管a相连的是电源的正极 C、管a与管b中气体质量比为2:1 D、该实验可说明水由H2和O2组成10. 利用数据传感技术比较块状和粉末状的碳酸钙与足量稀盐酸反应 的快慢。按下图装置进行实验,倾斜锥形瓶,使 10 mL 稀盐酸与固体 充分接触,瓶内气压随时间的变化如图。下列有关说法不正确的是 A、m=1 B、对比 a、c 点或 b、d 点可知,粉末状反应更快 C、图中 d 点溶液中溶质为 CaCl2 D、t 秒内,粉末状碳酸钙反应产生的 CO2 更多11. 纳米铁粉在空气中不易自燃,但稍加热即可剧烈燃烧,如图是纳米铁粉在锥形瓶中燃烧的实验。下列说法不正确的是( )
A、m=1 B、对比 a、c 点或 b、d 点可知,粉末状反应更快 C、图中 d 点溶液中溶质为 CaCl2 D、t 秒内,粉末状碳酸钙反应产生的 CO2 更多11. 纳米铁粉在空气中不易自燃,但稍加热即可剧烈燃烧,如图是纳米铁粉在锥形瓶中燃烧的实验。下列说法不正确的是( ) A、纳米铁粉燃烧的化学方程式为3Fe+2O2Fe3O4 B、水可防止生成物溅落炸裂瓶底 C、激光手电照射使纳米铁粉的着火点降低 D、气球先膨胀后又变小12. A B C D表示4种物质,其微观示意图见下表,A和B在一定条件下反应生成C和D。下列说法不正确的是
A、纳米铁粉燃烧的化学方程式为3Fe+2O2Fe3O4 B、水可防止生成物溅落炸裂瓶底 C、激光手电照射使纳米铁粉的着火点降低 D、气球先膨胀后又变小12. A B C D表示4种物质,其微观示意图见下表,A和B在一定条件下反应生成C和D。下列说法不正确的是物质
A
B
C
D

微观示
意图



 A、B的化学式为SO2 B、生成的C为单质 C、参加反应的A和B分子个数比为2:1 D、16gB参加反应,则生成C的质量为8g13. 下列实验方法能达到实验目的的是
A、B的化学式为SO2 B、生成的C为单质 C、参加反应的A和B分子个数比为2:1 D、16gB参加反应,则生成C的质量为8g13. 下列实验方法能达到实验目的的是选项
实验目的
实验方法
A
除去CuO中的C
在空气中灼烧
B
鉴别和
分别点燃,在火焰上方罩一干冷烧杯
C
检验一瓶是否收集满
将带火星木条伸入瓶中
D
除去中的CO
点燃
A、A B、B C、C D、D14. 如图 为探究可燃物燃烧条件的俯视示意图。①处为木炭,②③处为火柴头(其中③处火柴头用细沙盖住)。 用酒精灯从铜片下方对准中心④处进行加热(如图 2,夹持仪器略去),一段时间后,只有②处火柴头燃烧。 下列说法不正确的是 A、对比①③处现象证明可燃物燃烧需要温度达到着火点 B、③处火柴头不燃烧是因为没有与氧气接触 C、②处火柴头燃烧说明铜具有导热性 D、在④处加热体现了控制变量思想15. 钨丝灯管在使用过程中,钨丝(W)温度可达3000℃以上,这会造成W在使用过程中缓慢挥发,使灯丝变细,加入碘( , 固体)可以延缓这个过程,其原理如图所示;下列说法正确的是
A、对比①③处现象证明可燃物燃烧需要温度达到着火点 B、③处火柴头不燃烧是因为没有与氧气接触 C、②处火柴头燃烧说明铜具有导热性 D、在④处加热体现了控制变量思想15. 钨丝灯管在使用过程中,钨丝(W)温度可达3000℃以上,这会造成W在使用过程中缓慢挥发,使灯丝变细,加入碘( , 固体)可以延缓这个过程,其原理如图所示;下列说法正确的是 A、加入后在灯管中只发生化学变化 B、灯管内中可以循环使用的物质是: C、上述反应过程中,各元素的化合价没有发生变化 D、在灯丝上分解,产生的W又沉积在灯丝上
A、加入后在灯管中只发生化学变化 B、灯管内中可以循环使用的物质是: C、上述反应过程中,各元素的化合价没有发生变化 D、在灯丝上分解,产生的W又沉积在灯丝上二、填空题
-
16. 阅读下列短文,回答问题
芦笋具有很高的营养价值和保健功能,被人们称为“蔬菜之王”。芦笋中富含维生素C。维生素C()的含量是植物营养成分的重要指标。科研人员测定不同品种、不同部位的芦笋中维生素C含量及不同贮藏条件下维生素C含量的变化。维生素C易溶于水,易被光、热和氧气等破坏。因此,在测定芦笋中维生素C含量时,应采摘后立即测定,且整个实验过程需要快速。
采摘3个品种的芦笋,立即测定不同部位[同一株芦笋分成上(笋尖)、中、下段]芦笋中维生素C的含量如图甲所示。

选取品种1,探究贮藏条件对芦笋中维生素C含量的影响。同一天采摘同一试验区的芦笋产品,选取同一部位样品,立即测定其中维生素C含量,并随机分成2组,第①组在室温(25℃左右)自然漫射光下保存;第②组在冰箱(4℃)中避光保存。每2天分别测定每组芦笋样品中的维生素C含量,测定结果如图乙所示。
芦笋的营养和保健功能使其具有很高的食用价值。每1kg鲜芦笋中含有蛋白质25g,高于普通蔬菜3~8倍。芦笋中碳水化合物和脂肪的含量偏低,富含纤维素、多种维生素和微量元素,尤其含有丰富的抗癌元素——硒,被视为一种保健食品。
依据文章内容回答下列问题。
(1)、维生素C是由种元素组成。在物质分类中属于(填“混合物”或“化合物”)(2)、在测定植物中维生素C含量时,应采摘后立即测定,原因是。(3)、分析图乙,请给出芦笋保存和食用的建议是。(4)、芦笋中所含硒元素在元素周期表中的信息如图,由图可以获得的信息是(写出一条)。 (5)、下列说法正确的是____(填序号)。A、品种2与品种3笋尖中维生素C含量基本相等 B、芦笋中嫩尖部比根部维生素C含量高 C、芦笋中富含碳水化合物和脂肪17. 了解国际空间站内的“空气”。(1)、站内空气要与地球上的空气组成基本一致,其中与的体积比约为。(2)、站内的来源:
(5)、下列说法正确的是____(填序号)。A、品种2与品种3笋尖中维生素C含量基本相等 B、芦笋中嫩尖部比根部维生素C含量高 C、芦笋中富含碳水化合物和脂肪17. 了解国际空间站内的“空气”。(1)、站内空气要与地球上的空气组成基本一致,其中与的体积比约为。(2)、站内的来源:①主要来源是电解水,反应的化学方程式是;该反应类型为。
②备用由分解高氯酸锂()获得,同时还生成氯化锂(LiCl),该反应中含有氧元素的物质是。
(3)、过滤器中的活性炭可除去有气味的物质,利用了活性炭的性。(4)、呼出的二氧化碳用固体氢氧化锂(LiOH)吸收,生成碳酸锂()和水。①的相对分子质量为。
②反应的化学方程式是。
18. 下列是常用实验仪器,据图作答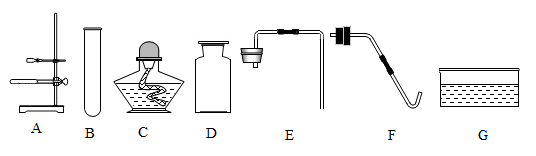 (1)、认识仪器:仪器B的名称是。(2)、制取气体:实验室用高锰酸钾制氧气的化学方程式是 , 用排水法收集氧气时,表明氧气已集满的现象是;实验室制取二氧化碳的药品是 , 组装制取并收集二氧化碳的装置,需选择的仪器是(填字母序号)。(3)、探究性质:
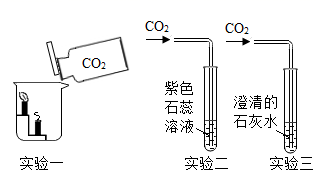
(1)、认识仪器:仪器B的名称是。(2)、制取气体:实验室用高锰酸钾制氧气的化学方程式是 , 用排水法收集氧气时,表明氧气已集满的现象是;实验室制取二氧化碳的药品是 , 组装制取并收集二氧化碳的装置,需选择的仪器是(填字母序号)。(3)、探究性质:实验一,蜡烛由低到高依次熄灭,由此可知二氧化碳的物理性质是;
实验二,溶液颜色的变化是;
实验三,澄清的石灰水变浑浊,反应的化学方程式是。
三、实验探究题
-
19. 小峰同学在体育课上腿部擦伤,医务室的大夫在他伤口上涂了医用过氧化氢溶液,小峰看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?(1)、
Ⅰ.小峰准备用如图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气。记录2分钟收集的气体体积。
请写出过氧化氢分解的化学方程式。 (2)、氧气可以用排水法收集,是因为;若要检验生成的气体是否为氧气,可将导气管从水中取出,取带火星的木条放在处,观察到 , 说明生成的气体是氧气。(3)、实验中使用量筒收集气体的最大优势是。(4)、Ⅱ.小峰查阅了相关资料,并进行了探究实验
(2)、氧气可以用排水法收集,是因为;若要检验生成的气体是否为氧气,可将导气管从水中取出,取带火星的木条放在处,观察到 , 说明生成的气体是氧气。(3)、实验中使用量筒收集气体的最大优势是。(4)、Ⅱ.小峰查阅了相关资料,并进行了探究实验【查阅资料】
1.过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
2.温度对化学反应的快慢有影响,人体正常体温是37℃。
【提出猜想】
猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
【进行实验】
序号
实验步骤
实验现象
实验结论
①
分两次进行实验,均注入5mL相同浓度的过氧化氢溶液;
第一次在常温下进行
第二次将试管浸在37℃的温水中
量筒中2分钟收集到的气体体积均为5mL
②
分两次进行
实验第一次
第二次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,再向试管中注入5mL过氧化氢溶液
第一次,量筒中2分钟收集到的气体体积为5mL
第二次,量筒中2分钟收集到的气体体积为_mL
过氧化氢分解加快是因为过氧化氢酶的作用
实验①得出的结论是。
(5)、实验②中“第一次”应进行的操作是。(6)、实验②中第二次收集到的氧气体积为mL。(7)、【实验反思】小峰反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
加入过氧化氢酶
不加过氧化氢酶
反应温度/℃
25
37
42
25
37
42
收集到气体体积/mL
39
56
34
5
5
5
通过这些数据,你能得出的新结论是。
20. 甲酸(HCOOH)在热的浓硫酸中分解,生成一氧化碳和水。用如图所示装置完成一氧化碳还原四氧化三铁的实验。(碱石灰能吸收水分和酸性物质) (1)、装置连接好后(固定装置省略),推动注射器活塞,出现现象时,说明装置气密性良好。(2)、写出甲酸分解的化学方程式:。(3)、证明一氧化碳与四氧化三铁已发生反应的现象是。此处酒精灯火焰外加网罩的目的是:。(4)、a处导管口绑一小气球的目的是;小气球也可以用代替。
(1)、装置连接好后(固定装置省略),推动注射器活塞,出现现象时,说明装置气密性良好。(2)、写出甲酸分解的化学方程式:。(3)、证明一氧化碳与四氧化三铁已发生反应的现象是。此处酒精灯火焰外加网罩的目的是:。(4)、a处导管口绑一小气球的目的是;小气球也可以用代替。四、计算题