福建省福州市2023-2024学年九年级上学期适应性练习化学试卷
试卷更新日期:2024-02-20 类型:期末考试
一、选择题
-
1. 天宫课堂播种科学梦想。下列天宫课堂的实验中,涉及化学变化的是A、球形火焰 B、陀螺旋转 C、拍击水球 D、钢球碰撞2. 青少年常喝碳酸饮料会导致“钙”流失,这里的“钙”指的是A、元素 B、分子 C、原子 D、单质3. 下列有关玻璃导气管使用正确的是A、连接导气管
 B、用氯酸钾制氧气
B、用氯酸钾制氧气 C、排空气法集气
C、排空气法集气 D、排水法集气
D、排水法集气 4. 腓(N2H4)和四氧化二氮(N2O4)是常见的液体火箭推进剂。下列说法错误的是A、N2O4属于氧化物 B、N2H4中含氮分子和氢分子 C、N2O4中氮元素为+4价 D、一个N2H4分子中含有6个原子5. 青铜是金属冶铸史上最早的合金,主要成分为铜及少量锡、铅等。下列说法正确的是A、青铜熔点比纯铜高 B、青铜可完全溶于足量的稀硫酸 C、青铜比纯铜更坚硬 D、青铜器表面绿色铜锈主要成分是CuO6. 天然气是家庭常用燃料,其爆炸极限为5%~15%。下列说法错误的是A、天然气属于不可再生能源 B、泄漏时应关闭阀门且开窗通风 C、75%的天然气点燃会爆炸 D、泄漏报警器适宜安装在炉具上方7. 空气经除尘、除二氧化碳和水的处理后,进行如图操作。下列说法正确的是
4. 腓(N2H4)和四氧化二氮(N2O4)是常见的液体火箭推进剂。下列说法错误的是A、N2O4属于氧化物 B、N2H4中含氮分子和氢分子 C、N2O4中氮元素为+4价 D、一个N2H4分子中含有6个原子5. 青铜是金属冶铸史上最早的合金,主要成分为铜及少量锡、铅等。下列说法正确的是A、青铜熔点比纯铜高 B、青铜可完全溶于足量的稀硫酸 C、青铜比纯铜更坚硬 D、青铜器表面绿色铜锈主要成分是CuO6. 天然气是家庭常用燃料,其爆炸极限为5%~15%。下列说法错误的是A、天然气属于不可再生能源 B、泄漏时应关闭阀门且开窗通风 C、75%的天然气点燃会爆炸 D、泄漏报警器适宜安装在炉具上方7. 空气经除尘、除二氧化碳和水的处理后,进行如图操作。下列说法正确的是 A、氮气的沸点比氧气低 B、100g空气含21g氧气 C、氧气液化时分子体积变小 D、液态空气汽化过程放热8. 氚灯被广泛应用于夜光手表。氟原子的质子数为1,质量数为3(质量数=质子数+中子数),其符号可表示为H。下列分析正确的是A、氚原子不属于氢元素 B、氚原子的中子数为2 C、氚原子核电荷数为3 D、氚原子结构示意图为
A、氮气的沸点比氧气低 B、100g空气含21g氧气 C、氧气液化时分子体积变小 D、液态空气汽化过程放热8. 氚灯被广泛应用于夜光手表。氟原子的质子数为1,质量数为3(质量数=质子数+中子数),其符号可表示为H。下列分析正确的是A、氚原子不属于氢元素 B、氚原子的中子数为2 C、氚原子核电荷数为3 D、氚原子结构示意图为 9. 根据下列证据进行推理,正确的是
9. 根据下列证据进行推理,正确的是证据
推理
A
活性炭具有强吸附性
能用其软化硬水
B
氯化钠呈电中性
氯化钠由钠原子和氯原子构成
C
金刚石和石墨均属于碳单质
两者的碳原子排列方式相同
D
铁浸入硫酸铜溶液中出现红色固体
铜的金属活动性比铁弱
A、A B、B C、C D、D10. 硼氢化钠(NaBH4)催化释氢,为便捷式电源提供移动氢能,该反应原理如图。下列分析正确的是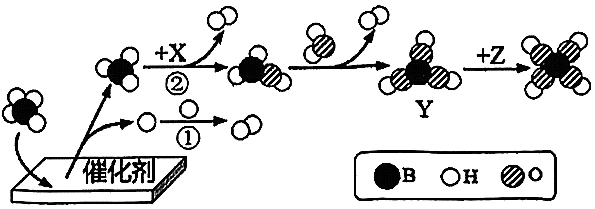 A、该反应过程中共出现4种含硼(B)的微观粒子 B、过程①微观实质是2个氧原子结合成1个氧分子 C、过程②中各微粒的数目比为1:1:1:1,则X为H2O D、若Y与Z发生化合反应,则微粒Z为
A、该反应过程中共出现4种含硼(B)的微观粒子 B、过程①微观实质是2个氧原子结合成1个氧分子 C、过程②中各微粒的数目比为1:1:1:1,则X为H2O D、若Y与Z发生化合反应,则微粒Z为
二、非选择题
-
11. 铌酸锂(LiNbO3)晶体是目前用途最广泛的新型无机材料之一。(1)、铌酸锂含种金属元素。(2)、铌在元素周期表中的信息如图,铌的原子序数为 , 相对原子质量是。
 (3)、铌酸锂中铌、氧元素质量比为(填最简整数比)。(4)、铌用于制造超导(电阻趋向于零)线缆,体现其物理性质是(写一种)。(5)、为保护金属资源,提出一条你的建议:。12. 黏土主要成分为Al2O3•2SiO2•2H2O,还含有铁、钾等元素,可用于制作红砖和青砖。高温烧砖过程,黏土中铁元素被充分氧化成Fe2O3 , 时形成红砖;在氧气不足和还原性气氛的条件下,部分Fe2O3转化成FeO和Fe3O4形成青砖。(1)、黏土属于(填“纯净物”或“混合物”)。(2)、Fe3O4中铁元素有+2、+3两种化合价,其化学式也可表示为“X•Fe2O3”,则X的化学式为。(3)、《天工开物》中记载“浇水转釉”的操作如图,其原理是:焙烧工作完成时,封闭窑门并从窑顶慢慢浇水,高温下碳和水蒸气反应生成氢气和一氧化碳。
(3)、铌酸锂中铌、氧元素质量比为(填最简整数比)。(4)、铌用于制造超导(电阻趋向于零)线缆,体现其物理性质是(写一种)。(5)、为保护金属资源,提出一条你的建议:。12. 黏土主要成分为Al2O3•2SiO2•2H2O,还含有铁、钾等元素,可用于制作红砖和青砖。高温烧砖过程,黏土中铁元素被充分氧化成Fe2O3 , 时形成红砖;在氧气不足和还原性气氛的条件下,部分Fe2O3转化成FeO和Fe3O4形成青砖。(1)、黏土属于(填“纯净物”或“混合物”)。(2)、Fe3O4中铁元素有+2、+3两种化合价,其化学式也可表示为“X•Fe2O3”,则X的化学式为。(3)、《天工开物》中记载“浇水转釉”的操作如图,其原理是:焙烧工作完成时,封闭窑门并从窑顶慢慢浇水,高温下碳和水蒸气反应生成氢气和一氧化碳。
①高温下,碳和水蒸气的反应属于(填基本反应类型)。
②“浇水转釉”时Fe2O3转化成FeO,铁元素含量(填“升高”或“降低”)。
③现代工业利用一氧化碳冶炼赤铁矿(主要含Fe2O3)的化学方程式为。
13. 阅读短文,回答问题。空间站中的氧气和水
我国已成功实现在空间站中氧气和水等物质的“自产自销”。通过收集航天员尿液、汗液和呼出的水汽,深度净化,再生为饮用水,使得空间站水资源的利用率达85%。空间站利用太阳能电池板供电,实现氧气和水的再生(如图),该系统把水资源利用率提高到95%以上。
 (1)、空间站中,实现氧气和水再生所需的电能来自(写能源名称)。(2)、实验室利用加热固体方法制氧气的原理为(用化学方程式表示)。该方法不适用于空间站提供氧气,理由是(写一条)。(3)、下列有关水循环系统分析正确的是____(填标号)。A、该系统利用催化剂可增加水的质量 B、系统中氢原子利用率没有达到100% C、可用过滤方法除去尿液浓缩后析出的固体(4)、图中空间站内产生甲烷的反应物有(填化学式)。14. 探秘“燃烧”。
(1)、空间站中,实现氧气和水再生所需的电能来自(写能源名称)。(2)、实验室利用加热固体方法制氧气的原理为(用化学方程式表示)。该方法不适用于空间站提供氧气,理由是(写一条)。(3)、下列有关水循环系统分析正确的是____(填标号)。A、该系统利用催化剂可增加水的质量 B、系统中氢原子利用率没有达到100% C、可用过滤方法除去尿液浓缩后析出的固体(4)、图中空间站内产生甲烷的反应物有(填化学式)。14. 探秘“燃烧”。 (1)、点燃一根“神奇”蜡烛,吹灭火焰后会自动复燃。原因是烛心的镁粉继续氧化放热,重新引燃蜡烛。熄灭该神奇蜡烛的合理操作是(写一点)。(2)、金属镁在二氧化碳中也能燃烧,生成碳和氧化镁,该反应的化学方程式是。
(1)、点燃一根“神奇”蜡烛,吹灭火焰后会自动复燃。原因是烛心的镁粉继续氧化放热,重新引燃蜡烛。熄灭该神奇蜡烛的合理操作是(写一点)。(2)、金属镁在二氧化碳中也能燃烧,生成碳和氧化镁,该反应的化学方程式是。 (3)、辩证认识“黑烟”
(3)、辩证认识“黑烟”①蜡烛燃烧过程,伴随产生对环境不利的黑烟,此黑烟主要成分是(填物质名称)。
②松烟制墨法是利用松枝(填“完全”或“不完全”)燃烧而制墨。
 (4)、配平以下化学方程式:C2H8N2+N2O4=2CO2↑+4H2O↑+N2↑。(5)、根据以上信息,你对燃烧条件的新认识是(写一点)。15. “化”说碳酸饮料(以某品牌无色汽水为例,部分成分说明书如图)。
(4)、配平以下化学方程式:C2H8N2+N2O4=2CO2↑+4H2O↑+N2↑。(5)、根据以上信息,你对燃烧条件的新认识是(写一点)。15. “化”说碳酸饮料(以某品牌无色汽水为例,部分成分说明书如图)。 (1)、若该瓶汽水体积为300mL,可提供的能量是kJ。(2)、为验证汽水中含有二氧化碳,甲同学抽取瓶内上方气体,乙同学抽取瓶内液体,分别注入澄清石灰水中。你认为(填“甲”或“乙”)的方案更合理。写出澄清石灰水与二氧化碳反应的化学方程式:。(3)、已知常温常压下,1体积水能溶解1体积CO2。丙、丁两同学设计如图实验进行验证。实验过程中反复推拉注射器活塞的目的是。停止该操作后,将注射器①、③活塞推至底部,则注射器②内仅有液体,活塞停在2mL处;注射器④活塞停留在6mL处,其中液体与剩余CO2的体积比为(填最简比)。同学们经过讨论,认为丁同学方案正确,理由是。
(1)、若该瓶汽水体积为300mL,可提供的能量是kJ。(2)、为验证汽水中含有二氧化碳,甲同学抽取瓶内上方气体,乙同学抽取瓶内液体,分别注入澄清石灰水中。你认为(填“甲”或“乙”)的方案更合理。写出澄清石灰水与二氧化碳反应的化学方程式:。(3)、已知常温常压下,1体积水能溶解1体积CO2。丙、丁两同学设计如图实验进行验证。实验过程中反复推拉注射器活塞的目的是。停止该操作后,将注射器①、③活塞推至底部,则注射器②内仅有液体,活塞停在2mL处;注射器④活塞停留在6mL处,其中液体与剩余CO2的体积比为(填最简比)。同学们经过讨论,认为丁同学方案正确,理由是。 (4)、欲证明二氧化碳与水发生反应,可以向反应后注射器④中加入试剂(填名称)。16. 为完成“实验室制取氧气”的实践性作业,学习小组开展如图活动。
(4)、欲证明二氧化碳与水发生反应,可以向反应后注射器④中加入试剂(填名称)。16. 为完成“实验室制取氧气”的实践性作业,学习小组开展如图活动。 (1)、组装制取氧气装置可选择图中仪器A、B、(填标号,下同)和。该套装置(填“能”或“不能”)用于制取二氧化碳。(2)、甲同学使用(填仪器名称)把二氧化锰装入容器中,再加入(填药品名称),反应的化学方程式为。(3)、乙同学负责收集和验满气体。验满的方法是。(4)、实验结束,丙同学将残余物直接倒入下水道,洗涤仪器,整理实验台。老师认为他的操作有待改进,请提出改进措施:。17. 为探究水电解实验最佳条件,某化学小组利用图1装置开展如下研究。
(1)、组装制取氧气装置可选择图中仪器A、B、(填标号,下同)和。该套装置(填“能”或“不能”)用于制取二氧化碳。(2)、甲同学使用(填仪器名称)把二氧化锰装入容器中,再加入(填药品名称),反应的化学方程式为。(3)、乙同学负责收集和验满气体。验满的方法是。(4)、实验结束,丙同学将残余物直接倒入下水道,洗涤仪器,整理实验台。老师认为他的操作有待改进,请提出改进措施:。17. 为探究水电解实验最佳条件,某化学小组利用图1装置开展如下研究。[查阅资料]
①电解纯水速率较慢,加入氢氧化钾、氢氧化钠、碳酸钠、硫酸钠等电解质增强导电性,加快反应速率。
②氢氧化钠、氢氧化钾有较强腐蚀性。
③去离子水是指除去呈离子形式杂质后的纯水,生产成本较高。

[实验1]探究不同电解质对水电解速率的影响
往图1水杯中分别加入等量的浓度为12%的碳酸钠、硫酸钠、氢氧化钾和氢氧化钠溶液进行实验,通电相同时间读取并记录数据,重复实验三次,计算氢气产生速率,结果如图3。
 (1)、检查装置气密性:先用燕尾夹夹紧医用软管,再将注射器竖直向下浸入水中如图2,若观察到(填标号)现象,说明气密性良好。(2)、由图3判断:影响水电解速率最大的电解质是。从实验效果分析,(填“有”或“没有”)必要使用去离子水进行本实验。(3)、[实验2]探究水电解实验中电解质溶液的最佳浓度(以氢氧化钠溶液为例),结果如图4。
(1)、检查装置气密性:先用燕尾夹夹紧医用软管,再将注射器竖直向下浸入水中如图2,若观察到(填标号)现象,说明气密性良好。(2)、由图3判断:影响水电解速率最大的电解质是。从实验效果分析,(填“有”或“没有”)必要使用去离子水进行本实验。(3)、[实验2]探究水电解实验中电解质溶液的最佳浓度(以氢氧化钠溶液为例),结果如图4。
浓度为的氢氧化钠溶液为最佳电解质溶液。从安全角度考虑,实验过程需戴橡胶手套的原因是。
(4)、[实验3]将下列电极连接电源负极,探究不同电极材料对水电解速率的影响,测定产生氢气的速率(cm3/s)如表。电极材料
铁丝
铜丝
铁镍合金
石墨
第1次
0.0164
0.0214
0.0138
0.0031
第2次
0.0159
0.0207
0.0150
0.0027
第3次
0.0161
0.0209
0.0144
0.0034
平均值
0.0160
0.0210
0.0144
0.0030
本实验条件下,最佳电极材料是。
(5)、选择电极材料需考虑的因素:电极应与电解质溶液不反应。若用铁作电极,电解质溶液不能用稀硫酸,原因是(用化学方程式解释)。(6)、为验证温度也是影响水电解速率的因素,请写出实验方案:。18. 中国科学家研制新型催化剂将二氧化碳催化合成甲醇(CH3OH),可实现二氧化碳再生利用的“零碳”目标。根据化学方程式计算:人类每年因能源消耗向大气约排放176亿吨CO2 , 理论上可转化得到甲醇的质量为多少亿吨?(反应原理为CO2+3H2CH3OH+H2O)