重庆市合川区2023-2024学年九年级上学期期末化学试题
试卷更新日期:2024-02-20 类型:期末考试
一、选择题
-
1. 第十九届亚运会在杭州完美举办,下列涉及化学变化的是A、活性炭净化游泳池 B、巨型莲花建筑开合 C、火炬接力将其引燃 D、水墨画在屏幕展现2. 在铟、铱等相对原子质量的测定中作出卓越贡献的我国科学家是A、张青莲 B、屠呦呦 C、杨振宁 D、侯德榜3. 分类是学习化学常用的方法,下列物质属于纯净物的是A、医用酒精 B、矿泉水 C、熟石灰 D、黄铜4. 打开包装袋的饼干长时间放置在空气中,会发现其变软,说明空气中含有A、氮气 B、氧气 C、二氧化碳 D、水蒸气5. 稀有气体曾被称为惰性气体,在空气中含量少,但用途却非常广泛。下列有关稀有气体说法正确的是A、约占空气总质量分数的0.94% B、最外层均为8电子的稳定结构 C、氦气可用于填充探空气球 D、化学性质不活泼,故可用于制作霓虹灯6. 下列实验现象描述正确的是A、甲烷燃烧时产生H2O和CO2 B、硫在空气中燃烧发出明亮的蓝紫色火焰 C、铁丝在氧气中燃烧时火星四射、剧烈燃烧、生成黑色固体 D、铁钉放入硫酸铜溶液中,溶液由蓝色变成无色,铁钉表面出现红色固体7. 下列图示的实验操作正确的是A、检查气密性
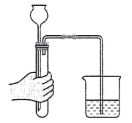 B、稀释浓硫酸
B、稀释浓硫酸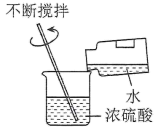 C、称量NaOH固体
C、称量NaOH固体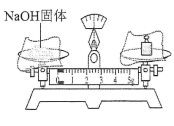 D、蒸馏实验
D、蒸馏实验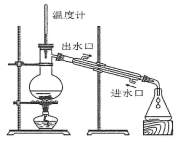 8. 二氧化钒的“冷热双吸”材料,可助力我国实现“双碳”目标。钒元素在周期表中的信息如图所示,下列说法不正确的是
8. 二氧化钒的“冷热双吸”材料,可助力我国实现“双碳”目标。钒元素在周期表中的信息如图所示,下列说法不正确的是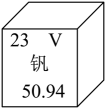 A、钒属于金属元素 B、钒原子中子数为23 C、钒的相对原子质量为50.94 D、二氧化钒的化学式为VO29. 经过各方救援力量奋力扑救,北碚区缙云山山火得到有效封控。在这场与山火的拉锯战中,“以火灭火”的方式,助力了阶段性胜利时刻的到来,下列说法不正确的是A、山林发生火灾时,应逆着风向跑离火场 B、用水灭火的原理主要是降低可燃物的着火点 C、为防止大火蔓延砍伐树木形成隔离带,其目的是隔绝可燃物 D、“以火灭火”可隔绝山火燃烧所需要的氧气和可燃物导致火熄灭10. 下列关于物质的性质和用途说法正确的是A、钨的熔点高——做保险丝 B、浓硫酸具有脱水性——干燥氧气 C、明矾溶于水生成胶状物质——用于水的净化 D、氢氧化钠能与二氧化碳反应——检验二氧化碳11. 有元素化合价变化的反应是氧化还原反应,其中所含元素化合价升高得到的产物为氧化产物,化合价降低得到的产物是还原产物。Cl2+2Na2S=2NaCl+S,该反应中还原产物为A、Na2S B、Cl2 C、S D、NaCl12. 关于碳单质及其氧化物的说法正确的是A、金刚石、石墨、C60都由碳原子直接构成 B、CO2使紫色石蕊溶液变红,说明CO2呈酸性 C、CO可用于冶炼金属,是利用其氧化性 D、CO2可用作气体肥料,体现了其化学性质13. 《天工开物》中记载了古人引用天然气制盐的过程:西川有火井,其井绝无火气,但以长竹剖开去节,合缝漆布,一头插入井底,其上曲接,以口紧对釜脐,注卤水釜中,只见火意烘烘,水即滚沸。下列有关叙述不正确的是A、“火井”中燃烧的物质是一种新能源 B、“合缝漆布”是确保气密性良好 C、点燃前须检验气体纯度 D、卤水煮盐与海水晒盐结晶原理相同14. 工业上使用一种国产低温催化剂生产氢气的反应过程如图所示,下列说法正确的是
A、钒属于金属元素 B、钒原子中子数为23 C、钒的相对原子质量为50.94 D、二氧化钒的化学式为VO29. 经过各方救援力量奋力扑救,北碚区缙云山山火得到有效封控。在这场与山火的拉锯战中,“以火灭火”的方式,助力了阶段性胜利时刻的到来,下列说法不正确的是A、山林发生火灾时,应逆着风向跑离火场 B、用水灭火的原理主要是降低可燃物的着火点 C、为防止大火蔓延砍伐树木形成隔离带,其目的是隔绝可燃物 D、“以火灭火”可隔绝山火燃烧所需要的氧气和可燃物导致火熄灭10. 下列关于物质的性质和用途说法正确的是A、钨的熔点高——做保险丝 B、浓硫酸具有脱水性——干燥氧气 C、明矾溶于水生成胶状物质——用于水的净化 D、氢氧化钠能与二氧化碳反应——检验二氧化碳11. 有元素化合价变化的反应是氧化还原反应,其中所含元素化合价升高得到的产物为氧化产物,化合价降低得到的产物是还原产物。Cl2+2Na2S=2NaCl+S,该反应中还原产物为A、Na2S B、Cl2 C、S D、NaCl12. 关于碳单质及其氧化物的说法正确的是A、金刚石、石墨、C60都由碳原子直接构成 B、CO2使紫色石蕊溶液变红,说明CO2呈酸性 C、CO可用于冶炼金属,是利用其氧化性 D、CO2可用作气体肥料,体现了其化学性质13. 《天工开物》中记载了古人引用天然气制盐的过程:西川有火井,其井绝无火气,但以长竹剖开去节,合缝漆布,一头插入井底,其上曲接,以口紧对釜脐,注卤水釜中,只见火意烘烘,水即滚沸。下列有关叙述不正确的是A、“火井”中燃烧的物质是一种新能源 B、“合缝漆布”是确保气密性良好 C、点燃前须检验气体纯度 D、卤水煮盐与海水晒盐结晶原理相同14. 工业上使用一种国产低温催化剂生产氢气的反应过程如图所示,下列说法正确的是 A、反应结束后尾气不需处理可直接排放 B、该反应属于基本反应类型中的氧化反应 C、参加反应物质的质量比为9:14 D、该化学反应前后不发生变化的有碳原子、氢原子、氧原子和水分子15. 中国茶道既是饮茶的艺术,也是生活的艺术,茶叶中的茶氨酸(C7H14N2O3)对人体健康有益,下列关于物质的检验和鉴别方法,其中正确的是A、茶氨酸属于氧化物 B、可用胆矾鉴别泡茶的水是硬水或软水 C、可用无色酚酞溶液判定茶水是否是酸性溶液 D、可用Ca(OH)2溶液检验茶叶灼烧后是否有CO2生成16. 下列四个图像中,能正确表示反应对应变化关系的是
A、反应结束后尾气不需处理可直接排放 B、该反应属于基本反应类型中的氧化反应 C、参加反应物质的质量比为9:14 D、该化学反应前后不发生变化的有碳原子、氢原子、氧原子和水分子15. 中国茶道既是饮茶的艺术,也是生活的艺术,茶叶中的茶氨酸(C7H14N2O3)对人体健康有益,下列关于物质的检验和鉴别方法,其中正确的是A、茶氨酸属于氧化物 B、可用胆矾鉴别泡茶的水是硬水或软水 C、可用无色酚酞溶液判定茶水是否是酸性溶液 D、可用Ca(OH)2溶液检验茶叶灼烧后是否有CO2生成16. 下列四个图像中,能正确表示反应对应变化关系的是
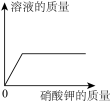
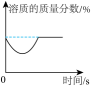
A.向氢氧化钠溶液中滴加过量稀盐酸
B.一定温度下,向不饱和硝酸钾溶液加入硝酸钾
C.饱和石灰水中加入少量生石灰
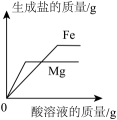
D.向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀盐酸至过量
A、A B、B C、C D、D二、填空题
-
17. 参观“镇国之宝”的青铜器——后母戊鼎时发现其表面有少量铜锈,已知铜锈的主要成分为Cu2(OH)2CO3 , 可用稀盐酸清洗铜锈,使其表面光亮如新。请用化学用语回答下列问题:(1)、3个铜原子 , 2个氢氧根离子。(2)、稀盐酸中含有的微粒为和水分子。(3)、根据铜锈的成分可知,铜生锈可能是与空气中O2、H2O和有关。18. 万众瞩目的2022世界杯足球赛在卡塔尔举行,得益于其拥有丰富的石油资源,东道主卡塔尔豪掷千亿,使其成为历史最贵的世界杯,被广大网友慕称“头顶一块布,全球我最富”。请回答下列问题:(1)、石油属于三大化石燃料之一,属于资源(填“可再生”或“不可再生”)。(2)、为了节约石油资源,可向汽油中添加适量的乙醇制成乙醇汽油:
①请写出乙醇完全燃烧的化学反应方程式。
②下列关于乙醇汽油的说法不正确的是。
A.乙醇是可再生能源 B.乙醇汽油是化合物 C.乙醇汽油可减缓温室效应
(3)、相对于石油而言,氢气是更加理想的能源,其具有的优点是(答出一点即可)。19. 金属资源在生活中使用广泛,极大方便了日常生活,请回答下列问题:(1)、2022年6月,我国第三艘航母“福建舰”下水。建造航母使用了大量的金属钛及合金,工业制钛的反应之一为:TiF4+2H2SO44HF+2SO3+X,则X的化学式为。(2)、铁制品使用广泛,请写出实验室用一氧化碳还原氧化铁的化学方程式为。关于该反应,下列说法正确的是。A.该反应属于置换反应
B.实验中可观察到固体由红色变为黑色
C.通入一氧化碳质量和氧化铁质量之和等于生成物总质量之和
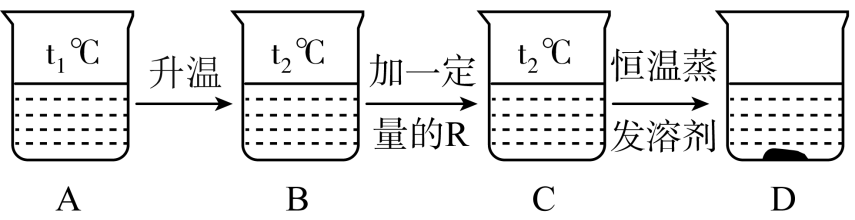
(3)、(填“纯金属”或“合金”)性能相对更优良,因而在日常生活中更为广泛使用。20. t1℃时,烧杯A中装有R物质的饱和溶液,进行某些操作后,实验结果如图所示: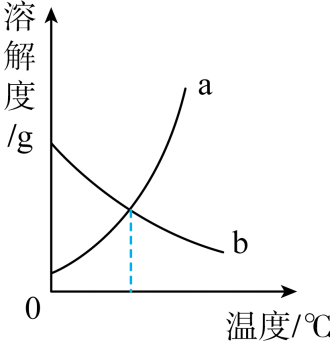
 (1)、B~D中,一定属于饱和溶液的是(填字母序号,下同),溶质的质量分数最小的是。(2)、R和N两种物质的溶解度曲线分别如图所示,则R物质的溶解度曲线是。(3)、R的饱和溶液含有少量杂质N。若要从该溶液中提取纯净的R物质,具体的操作是____。A、蒸发结晶、过滤、洗涤、干燥 B、降温结晶、过滤、洗涤、干燥 C、升温结晶、过滤、洗涤、干燥21. 某金属加工厂有大量金属铝、铁、铜的废弃粉末,为充分利用金属资源,分离和回收金属,某化学兴趣小组通过查阅资料设计了如图实验方案:
(1)、B~D中,一定属于饱和溶液的是(填字母序号,下同),溶质的质量分数最小的是。(2)、R和N两种物质的溶解度曲线分别如图所示,则R物质的溶解度曲线是。(3)、R的饱和溶液含有少量杂质N。若要从该溶液中提取纯净的R物质,具体的操作是____。A、蒸发结晶、过滤、洗涤、干燥 B、降温结晶、过滤、洗涤、干燥 C、升温结晶、过滤、洗涤、干燥21. 某金属加工厂有大量金属铝、铁、铜的废弃粉末,为充分利用金属资源,分离和回收金属,某化学兴趣小组通过查阅资料设计了如图实验方案: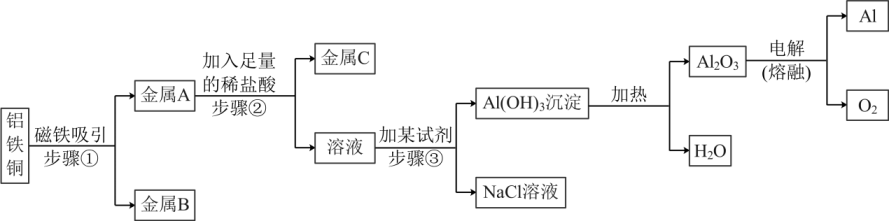
请完成下列各题:
(1)、步骤②发生反应的化学方程式为。(2)、步骤③生成沉淀的化学方程式为;因Al(OH)3既能与酸反应又能与碱反应,故步骤③加入某试剂时应采用的是(选填“滴加”或“倾倒”)操作。(3)、电解熔融Al2O3制金属铝的化学方程式为。(4)、不考虑过程的损耗,最终制得的铝的质量(选填“>”、“=”、“<”)原固体中铝的质量。三、实验题
-
22. 实验是学习化学的基础。如图是初中化学常见实验,请回答下列问题:
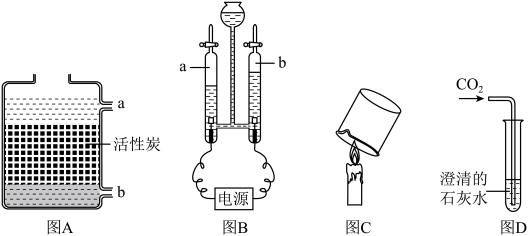 (1)、图A中水应从口通入,活性炭具有结构,故具有吸附作用。(2)、关于图B实验,下列说法不正确的有____。A、a对应连接电源的正极 B、可加入少量Na2SO4溶液增强导电性 C、参加反应水的体积等于生成气体体积的总和(3)、关于图C,下列说法正确的是____。A、蜡烛火焰分为三层,外焰温度最高 B、点燃蜡烛熄灭后产生的白烟,蜡烛重新燃烧 C、干而冷烧杯内有水雾产生,说明蜡烛中含有氢、氧元素(4)、请写出图D中澄清石灰水变浑浊的化学反应方程式。23. 某班同学用氢氧化钠溶液和稀硫酸进行中和反应实验。(1)、甲同学在烧杯中加入5mLNaOH溶液,滴入几滴无色酚酞溶液,此时溶液呈色,接着用滴管滴入一定量的稀硫酸,用玻璃棒搅拌,溶液变为无色,该反应的化学方程式为。(2)、该班同学对反应后溶液中的溶质成分进行探究。
(1)、图A中水应从口通入,活性炭具有结构,故具有吸附作用。(2)、关于图B实验,下列说法不正确的有____。A、a对应连接电源的正极 B、可加入少量Na2SO4溶液增强导电性 C、参加反应水的体积等于生成气体体积的总和(3)、关于图C,下列说法正确的是____。A、蜡烛火焰分为三层,外焰温度最高 B、点燃蜡烛熄灭后产生的白烟,蜡烛重新燃烧 C、干而冷烧杯内有水雾产生,说明蜡烛中含有氢、氧元素(4)、请写出图D中澄清石灰水变浑浊的化学反应方程式。23. 某班同学用氢氧化钠溶液和稀硫酸进行中和反应实验。(1)、甲同学在烧杯中加入5mLNaOH溶液,滴入几滴无色酚酞溶液,此时溶液呈色,接着用滴管滴入一定量的稀硫酸,用玻璃棒搅拌,溶液变为无色,该反应的化学方程式为。(2)、该班同学对反应后溶液中的溶质成分进行探究。【猜想与假设】反应后溶液中的溶质是什么?
猜想一:只有Na2SO4;猜想二:;猜想三:有Na2SO4和NaOH
以上猜想中,可以直接排除猜想三,理由。
【实验探究】
为了验证另外两种猜想,该班同学设计如表实验方案:
实验操作
实验现象
实验结论
取少量反应后的溶液于试管中,向试管中滴入碳酸钠溶液
有气泡产生
猜想二成立
该反应的化学方程式为。
【反思交流】实验结束后,废液处理方法正确的是(填序号)。
A.倒入下水道 B.倒入废液缸 C.带出实验室
四、计算题
-
24. 实验室中常用3%~5%的NaHCO3溶液来进行浓硫酸的事故处理,发生反应的化学方程式为2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑。向某NaHCO3溶液中逐滴加入溶质质量分数为24.5%的稀硫酸至无气泡产生时,消耗稀硫酸20g,称量反应后溶液总质量为115.6g,(假设其体全部溢出)
请计算:
(1)、NaHCO3中氧元素质量分数是碳元素质量分数的倍。(2)、求该NaHCO3溶液中溶质的质量分数。(3)、将50g质量分数5%的NaHCO3溶液溶液配制为8%时可以用不同的方法,请选择一种方法进行计算。(只写出计算过程,不答具体操作)