2024中考一轮总复习 第40课时 实验方案的设计与评价
试卷更新日期:2024-02-18 类型:一轮复习
一、选择题
-
1. 对比实验是进行科学探究的重要方式。下图所示实验均用到了对比的方法。
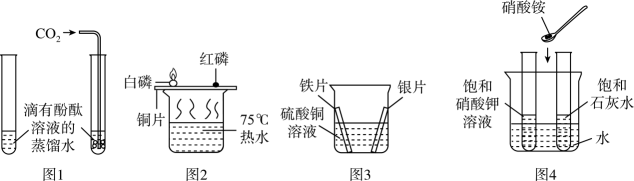
下列说法错误的是
A、图1实验能验证二氧化碳与水发生了反应 B、图2实验能说明红磷的着火点比白磷的高 C、图3实验能验证金属活动性顺序为Fe>Cu>Ag D、图4实验能说明硝酸铵固体溶于水会吸收热量2. “捕捉”空气有很多方法,某同学模仿教材中的“捕捉”实验.你认为他的哪个实验“捕捉”的空气与地表附近所存在的空气成分相差较大( )A、用打气筒向气球充气,气球膨胀 B、将一个空量筒倒立于装满水的水缸中,用力往下压,量筒中留有气体 C、用口对气球呼气,气球膨胀 D、将一空玻璃瓶置于室内,盖上瓶盖3. 下列实验操作(方案)不能达到实验目的的是选项
实验目的
实验操作(方案)
A
除去铜粉中少量的Fe
加足量的稀盐酸,过滤、洗涤、干燥
B
鉴别二氧化碳和氮气两瓶气体
将燃着的木条分别伸入集气瓶中
C
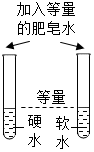
检验硬水和软水
取样,滴加肥皂水,振荡,观察现象
D
区分化肥和KCl
取样,加少量熟石灰粉末,混合研磨,闻气味
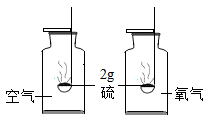
A、A B、B C、C D、D4. 设计实验方案是科学探究的重要环节,以下化学实验设计中,不能达到实脸目的是( )A、厨房中用食醋鉴别纯碱和食盐 B、用稀硫酸除去铁粉中混有的少量铜粉 C、用AgNO3溶液鉴别氯化钠溶液和硝酸钠溶液 D、用稀盐酸检验暴露在空气中的NaOH固体是否变质5. 下列实验设计能达到预期目的或效果的是( )A、证明CO2能与水反应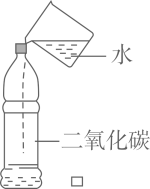 B、证明可燃物燃烧需要与氧气接触
B、证明可燃物燃烧需要与氧气接触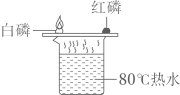 C、证明NaOH固体溶于水放热
C、证明NaOH固体溶于水放热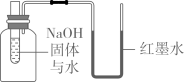 D、证明MnO2是H2O2分解的催化剂
D、证明MnO2是H2O2分解的催化剂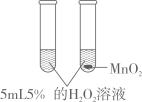 6. 如图所示,装置气密性良好,弹簧夹处于关闭状态。挤压胶头滴管加入液体,稍后打开弹簧夹,能使气球a明显鼓起的是( )
6. 如图所示,装置气密性良好,弹簧夹处于关闭状态。挤压胶头滴管加入液体,稍后打开弹簧夹,能使气球a明显鼓起的是( )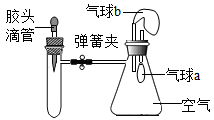
试管内物质
滴管内物质
A
氢氧化钠固体
水
B
二氧化碳气体
氢氧化钠溶液
C
氯化钡溶液
稀硫酸
D
铁片
稀盐酸
A、A B、B C、C D、D7. 对比实验是实验探究的重要方法,下列对比实验设计不能达到相应实验目的的是( )A
B
C
D
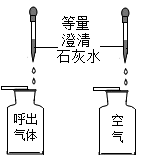
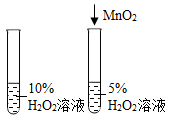
探究温度对分子运动快慢的影响
探究氧气含量对反应剧烈程度的影响
探究空气与呼出气体中二氧化碳的含量
探究反应物浓度对反应速率的影响
A、A B、B C、C D、D8. 下列实验设计能达到实验目的的是( )选项
A
B
C
D
实验设计
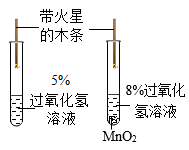
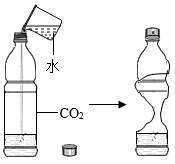
实验目的
研究二氧化锰的催化作用
证明二氧化碳能与水反应
区分硬水和软水
测定空气中氧气的含量
A、A B、B C、C D、D9. 验证金属Fe、Ag、Cu的活动性强弱,下列方案不能达到目的是( )A、Fe、Ag、CuSO4溶液 B、Cu、FeSO4溶液、AgNO3 , 溶液 C、Fe、Cu、AgNO3溶液,稀盐酸 D、Ag、FeSO4溶液、CuSO4溶液10. 下列实验方案中能达到实验目的是( )选项
实验目的
实验方案
A
区分CO和CH4
点燃,观察火焰的颜色
B
比较Zn、Cu、Ag的金属活动性强弱
将Zn和Cu分别放入硫酸铜溶液中
C
鉴别K2CO3、KCl、HCl、Ba(NO3)2四种溶液
相互反应即可鉴别
D
分离CaCl2和CaCO3固体混合物
加水,溶解,过滤
A、A B、B C、C D、D11. 下列实验方案设计不合理的是( )选项
实验目的
实验方案
A
除去CO2中含有的少量CO
点燃
B
鉴别红磷与白磷
观察颜色
C
鉴别氧化铜和铁粉
用磁铁吸引
D
除去氧化铜中少量的木炭粉
空气中灼烧
A、A B、B C、C D、D12. 现有一包固体粉末,可能是由CaCO3、Na2CO3、Na2SO4、NaCl、Ba(NO3)2中的一种或几种组成。为确定其成分,进行下列实验(微溶物质按可溶处理)。①取少量固体粉末于试管中,加足量的水溶解,静置后得到白色沉淀A和无色溶液B;
②过滤,将白色沉淀A放入试管中,滴加过量的稀硝酸,有气泡产生,沉淀部分溶解;
③取无色溶液B少许于试管中,滴加过量的稀硝酸,有气泡产生,得到溶液C;
④在溶液C中滴加硝酸银溶液,有白色沉淀产生。
以下说法正确的是( )
A、白色沉淀A的成分是BaSO4和CaCO3 B、该固体粉末中乙一定有CaCO3、Na2SO4、Na2CO3和Ba(NO3)2 C、无色溶液B中的溶质一定有NaNO3、Na2CO3和NaCl D、该固体粉末中一定有Na2SO4、Ba(NO3)2和Na2CO3 , 可能有CaCO3和NaCl13. 粗盐提纯过程中,除去难溶性杂质后的食盐水中,还含有和等杂质离子。在实验室中去除这些杂质离子的实验步骤如下:
取除去难溶性杂质的食盐水于烧杯中,依次加入过量的溶液、溶液和溶液,将杂质离子转化为沉淀;
过滤,得沉淀和滤液;
向滤液中加入适量盐酸,得到精盐水;
将精盐水蒸发结晶,得到较纯净的氯化钠晶体。(1)、依据以上实验步骤分析,下列说法正确的是( )A、步骤(1)中将溶液放在溶液之后加入,不影响除杂效果 B、步骤(2)过滤得到的沉淀中含有3种物质 C、步骤(3)加入的盐酸若过量,会导致蒸发结晶得到的中含 D、步骤(4)中需要加热至水分完全消失,再停止加热14. 铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu2(OH)2CO3].若要探究“铜生锈是否需要空气中的氧气?”如图所示实验中,只需完成两个实验即可达到实验目的,此两个实验是( )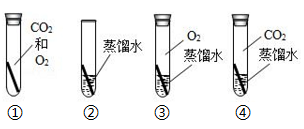 A、①③ B、②③ C、②④ D、③④15. 下列探究实验不能达到目的是( )A、
A、①③ B、②③ C、②④ D、③④15. 下列探究实验不能达到目的是( )A、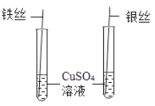 探究Fe、Cu、Ag的金属活动性
B、
探究Fe、Cu、Ag的金属活动性
B、 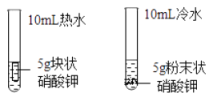 探究影响物质溶解速率的因素
C、
探究影响物质溶解速率的因素
C、 探究可燃物的燃烧条件
D、
探究可燃物的燃烧条件
D、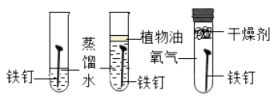 探究铁生锈的条件
探究铁生锈的条件
二、实验探究题
-
16. 为探究催化剂对过氧化氢溶液分解的催化效果,某研究小组做了如下实验。
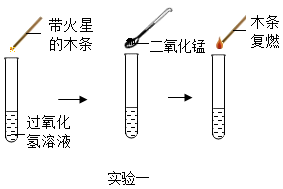
实验二:数据记录表
的过氧化氢溶液
加入二氧化锰的质量
测量末收集氧气的体积
(1)、实验一图中的实验能否证明二氧化锰是过氧化氢分解反应的催化剂?并说明理由:。(2)、实验二:从表格的设计可以看出,该实验的目的是。(3)、写出该反应的化学方程式:。(4)、造成实验二后面数据不变的原因可能是(写一条)。17. 学习复分解反应后,某化学兴趣小组的同学对初中化学常见的四种物质稀盐酸、CaCO3粉末、Na2SO4溶液、BaCl2溶液之间的反应进行如图所示的实验探究。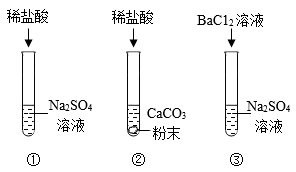 (1)、大家一致认为试管①中不发生复分解反应,理由是。(2)、试管②中观察到的现象是。试管③中发生反应的化学方程式为。(3)、将试管③反应后的物质过滤,对滤液中溶质的成分进一步探究:
(1)、大家一致认为试管①中不发生复分解反应,理由是。(2)、试管②中观察到的现象是。试管③中发生反应的化学方程式为。(3)、将试管③反应后的物质过滤,对滤液中溶质的成分进一步探究:【提出问题】滤液中溶质的成分是什么?
【猜想假设】猜想一:NaCl 猜想二:NaCl、Na2SO4猜想三:。
(4)、【设计实验】实验操作
实验现象
结论
步骤一:取少量滤液于试管中,加入适量BaCl2溶液
无明显现象
猜想不成立
步骤二:取少量滤液于试管中,加入适量稀硫酸
有白色沉淀生成
猜想三成立
(5)、【反思拓展】I、探究反应后溶液中溶质的成分,既要考虑生成物,又要考虑反应物是否有剩余。
Ⅱ、依据复分解反应发生的条件,步骤二中除可用稀硫酸外,还可选用(填字母序号)也能达到同样的实验目的。
a.稀盐酸 b.氢氧化钠溶液 c.碳酸钠溶液
18. 实验室常用的干燥剂“碱石灰”是CaO和NaOH固体的混合物。同学们为探究一瓶久置的“碱石灰”样品的成分,进行实验如下: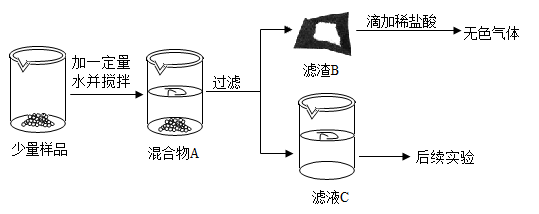
【查阅资料】①Ca(OH)2、Na2CO3溶于水无温度变化。
②CaCl2溶液呈中性。
(1)、【实验分析】通过实验可知:滤渣B中一定含有。(2)、关于滤液C中的溶质成分,有如下猜想:甲的猜想:Na2CO3
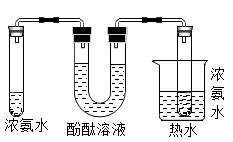
乙的猜想:NaOH丙的猜想:NaOH和Na2CO3
丁的猜想:NaOH和Ca(OH)2【设计方案并进行实验】针对猜想,甲、乙、丙分别设计方案并探究如下:
甲:取滤液C于试管中,滴加足量稀盐酸,有气泡产生,则滤液C中的溶质是Na2CO3
乙:取滤液C于试管中,滴加酚酞溶液,酚酞溶液变红色,则滤液C中的溶质一定含有NaOH
丙:取滤液C于试管中,滴加Ca(OH)2溶液,有白色沉淀产生,向上层清液中滴加无色酚酞溶液,溶液变成红色,则滤液C中的溶质是NaOH和Na2CO3
【反思与评价】丁通过甲的实验现象,否定了自己的猜想,其理由。丁认真分析上述三位同学的实验,认为他们通过实验获得的结论均有不足之处:甲的结论不正确的原因。乙的结论不正确的原因。经过大家讨论,一致认为丙的实验只要把Ca(OH)2溶液换成(填试剂及用量),就能得出正确的结论。有关反应的化学方程式。
同学们还发现:向样品中加入一定量的水并搅拌,会观察到放热。综合对滤液和滤渣成分的探究,下列对样品的分析正确的是(填序号)。
①一定含NaOH ②一定含Na2CO3
③一定含有CaCO3④一定含NaOH、CaO中的一种或两种
19. 化学兴趣小组的同学对乙醇燃烧后的产物进行了探究。【提出问题】乙醇燃烧后的产物是什么?
【查阅资料】无水硫酸铜为白色粉末,遇水会变蓝。
(1)、【做出猜想】猜想一:产物中含有CO、H2O; 猜想二:产物中含有CO2、H2O;猜想三:产物中含有。
(2)、【进行实验】同学们设计了如图的实验:检查装置气密性后,将乙醇燃烧的产物依次通过如图所示的装置进行验证。(部分夹持固定装置省略,B、D、G装置中均为澄清的石灰水)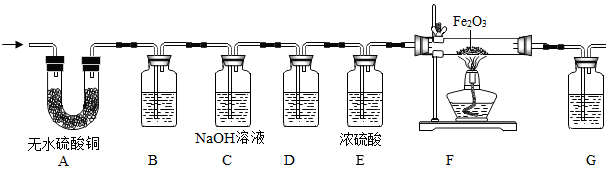
实验前,待 , 再点燃装置F中的酒精灯对固体进行加热。
(3)、装置C的作用是 , 装置D的作用是。(4)、【解释与结论】经过实验,同学们认为猜想三成立,则实验中能观察到的现象有(请回答完整);装置F中发生反应的化学方程式为。(5)、【反思与评价】乙同学发现该实验的设计中有一个明显缺陷,该缺陷是。实验结束后,由于小丽同学的操作步骤不当造成了硬质玻璃管破裂。为了避免此事故再次发生,同学们对该装置进行了改进,你认为他们的改进是。20. 我国制碱工业先驱侯德榜发明了“侯氏制碱法”,为纯碱和氨肥工业技术的发展作出了杰出的贡献。纯碱的用途非常广泛,某化学兴趣小组的同学对它产生了浓厚的兴趣,设计了如下两个实验,并对反应后试管中残留废液进行探究。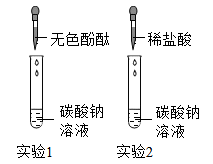 (1)、【实验1】往一支盛有碳酸钠溶液的试管中滴加无色酚酞溶液,观察到溶液变成色。(2)、【实验2】往另一支盛有碳酸钠溶液的试管中滴加稀盐酸,观察到的现象是。同学们对实验2反应后的废液中溶质成分进行探究。(3)、【提出问题】废液中所含溶质是什么?
(1)、【实验1】往一支盛有碳酸钠溶液的试管中滴加无色酚酞溶液,观察到溶液变成色。(2)、【实验2】往另一支盛有碳酸钠溶液的试管中滴加稀盐酸,观察到的现象是。同学们对实验2反应后的废液中溶质成分进行探究。(3)、【提出问题】废液中所含溶质是什么?【作出猜想】猜想一:废液中的溶质可能是NaCl、HCl;
猜想二:废液中的溶质可能是NaCl、Na2CO3;
猜想三:废液中的溶质可能是。
(4)、【设计实验】同学们为验证猜想,设计了如下实验:方案一:
实验操作与现象
化学方程式
实验结论
小芳取少量废液于试管中,滴加澄清石灰水,有白色沉淀产生
猜想二正确
方案二:小明取少量废液于试管中,滴加几滴无色酚酞溶液,发现溶液不变红色,小明认为猜想一正确。
(5)、【进行讨论】同学们一致认为小明的实验结论不正确,理由是。(6)、【进行总结】分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑。(7)、【拓展与应用】现有14.9g纯碱样品(含Na2CO3和NaCl的混合物),将其放入干净的烧杯中,加入89.5g水使其完全溶解,向所得溶液中缓慢加入一定溶质质量分数的稀盐酸(反应方程式为:)。产生气体的质量与加入稀盐酸的质量关系如图所示,试回答下列问题: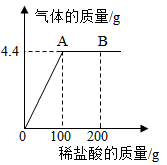
①产生CO2的质量为g。
②滴入稀盐酸至恰好完全反应时,所得溶液中溶质的质量分数是多少?