2024中考一轮总复习 第39课时 科学探究
试卷更新日期:2024-02-18 类型:一轮复习
一、选择题
-
1. 关于“加热高锰酸钾制得氧气并用排水法收集”的实验,下列说法正确的是( )A、制取气体时,先装药品,然后检验装置的气密性 B、加热时,直接用酒精灯的火焰对准药品所在的位置加热 C、导气管口开始产生气泡时,立即用装满水的集气瓶收集气体 D、反应结束时,先将导管移出水面,然后再停止加热2. 下列实验方案设计,能达到实验目的的是( )A、鉴别蒸馏水和氯化钠溶液:取样,烘干,观察现象 B、分离提纯KCl和MnO2的混合物:加水溶解,过滤,洗涤,干燥 C、探究Ag、Zn、Cu三种金属的活动性顺序:取样,分别加入稀硫酸,观察现象 D、除去CO2中混有少量的HCl:通入澄清的石灰水3. 下列有关溶液配制的说法正确的是( )A、欲配制的氯化钠溶液,需称取氯化钠 , 量取水 B、用来配制溶液的烧杯需先用蒸馏水润洗
C、用量筒量水时俯视读数,会使配得的溶液溶质质量分数偏大
D、常温下,氯化钠的溶解度为 , 可以配得常温下溶质质量分数为的氯化钠溶液4. 随着生活节奏的加快,方便的小包装食品越来越受到人们的欢迎.为了防止富脂食品氧化变质和受潮,生产厂家往往在食品包装袋中放入有某些化学物质的小袋.你认为放在这些小袋中的物质应该是( )A、蔗糖 无水硫酸铜 B、食盐 生石灰 C、还原铁粉 生石灰 D、烧碱 生石灰5. 实验探究是化学学习的重要方法,下列实验设计能实现相应实验目的的是( )选项
实验目的
实验设计
选项
实验目的
实验设计
A
探究CO2与水发生反应

B
探究温度对分子运动快慢的影响

C
验证质量守恒定律

D
除去CO2中少量的CO
 A、A B、B C、C D、D6. 除去下列物质中的少量杂质,方法错误的是( )
A、A B、B C、C D、D6. 除去下列物质中的少量杂质,方法错误的是( )选项
物质
所含杂质
除杂质的方法
A
Cu
Fe
加入足量的稀硫酸,过滤,洗涤,干燥
B
N2
O2
将混合气体通过灼热的铜网
C
CO2
CO
将混合气体点燃
D
Cu(NO3)2溶液
AgNO3
加入过量的铜粉,过滤
A、A B、B C、C D、D7. 下列有关物质的鉴别、除杂所用的试剂或方法正确的是( )选项
实验目的
所用试剂或方法
A
除去氧化铜中的碳粉
高温加热
B
鉴别氧化铜和碳粉
观察颜色
C
除去CO2中的CO
点燃
D
鉴别CO和CO2
分别通入紫色石蕊溶液
A、A B、B C、C D、D8. 比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素,其中推理不合理的是( )序号
化学反应事实
影响反应的因素
A
铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧
反应物浓度
B
碳常温下不与氧气发生反应,而在点燃时能与氧气反应
反应温度
C
双氧水在常温下较难分解,而加入二氧化锰后迅速分解
催化剂
D
铜片在空气中很难燃烧,铜粉在空气中较易燃烧
反应物的种类
A、A B、B C、C D、D9. 根据维生素C能够使紫色高锰酸钾溶液褪色的原理,用如图所示的实验可以测定出苹果汁和橙汁中维生素C含量的相对多少.要得出正确结论,实验过程中不需要进行控制的条件是( ) A、烧杯中溶液的体积 B、两个胶头滴管滴出的每滴果汁的体积 C、烧杯中紫色高锰酸钾溶液的浓度 D、胶头滴管滴出的果汁的滴数10. 下列图像能正确反映对应变化关系的是( )
A、烧杯中溶液的体积 B、两个胶头滴管滴出的每滴果汁的体积 C、烧杯中紫色高锰酸钾溶液的浓度 D、胶头滴管滴出的果汁的滴数10. 下列图像能正确反映对应变化关系的是( ) A、①图将水通电电解一段时间 B、②图加热一定质量的高锰酸钾 C、③图加热一定量的氯酸钾和二氧化锰的混合物 D、④图完全分解等质量的过氧化氢
A、①图将水通电电解一段时间 B、②图加热一定质量的高锰酸钾 C、③图加热一定量的氯酸钾和二氧化锰的混合物 D、④图完全分解等质量的过氧化氢二、综合题
-
11. 实验室里现有氯酸钾、过氧化氢溶液、二氧化锰、稀硫酸及以下仪器:
 (1)、图中仪器④的名称是。(2)、利用上述仪器和药品在实验室制取并收集相关气体,你选择的仪器是(填序号);发生反应的化学方程式为;检验该气体的方法是。(3)、若补充一种试剂(填试剂的名称),再利用上述仪器和药品还可以制取氢气。12. 碳酸钡广泛应用于显像管(CRT)、陶瓷、光学玻璃等行业。现有碳酸盐矿石(主要成分是BaCO3和CaCO3),下图是从该矿矿石中分离出BaCO3的流程图。
(1)、图中仪器④的名称是。(2)、利用上述仪器和药品在实验室制取并收集相关气体,你选择的仪器是(填序号);发生反应的化学方程式为;检验该气体的方法是。(3)、若补充一种试剂(填试剂的名称),再利用上述仪器和药品还可以制取氢气。12. 碳酸钡广泛应用于显像管(CRT)、陶瓷、光学玻璃等行业。现有碳酸盐矿石(主要成分是BaCO3和CaCO3),下图是从该矿矿石中分离出BaCO3的流程图。
已知:钡元素化合物的化学性质与钙元素化合物的化学性质相似。下表是不同温度下Ca(OH)2和Ba(OH)2的溶解度。
温度(℃)
0
20
25
60
溶解度/g
Ba(OH)2
1.67
3.89
5.60
20.94
Ca(OH)2
0.189
0.173
0.148
0.121
(1)、把矿石研磨成粉状的目的是。(2)、请你推断分离池中操作②的方法是(选填“A”或“B”)(A.降温、过滤、B.加热、过滤),原因是。(3)、写出由溶液B制取产品的化学方程式。(4)、以下相关说法正确的是____。A、焙烧炉中添加焦炭粉和热空气是为了维持炉内的高温状态 B、焙烧炉内只涉及分解反应 C、废渣需要经过洗涤才能弃渣,是为了保护环境,同时充分利用原料13. 利用黄铁矿主要成分为制硫酸的主要工艺流程如图: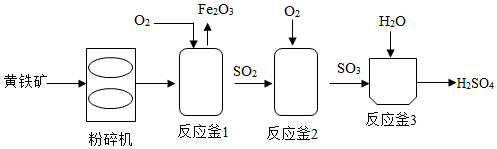 (1)、粉碎黄铁矿的目的是 。(2)、利用反应釜中产生的进行工业炼铁的化学方程式是 。(3)、反应釜中反应前后化合价发生改变的元素有。(4)、反应釜中发生化合反应的化学方程式是。14. 某白色固体甲的主要成分为NaCl,可能含有MgCl2、KCl、BaCl2和NaOH中的一种或几种杂质,为检验白色固体甲的成分并除去其中杂质,进行如下实验:
(1)、粉碎黄铁矿的目的是 。(2)、利用反应釜中产生的进行工业炼铁的化学方程式是 。(3)、反应釜中反应前后化合价发生改变的元素有。(4)、反应釜中发生化合反应的化学方程式是。14. 某白色固体甲的主要成分为NaCl,可能含有MgCl2、KCl、BaCl2和NaOH中的一种或几种杂质,为检验白色固体甲的成分并除去其中杂质,进行如下实验: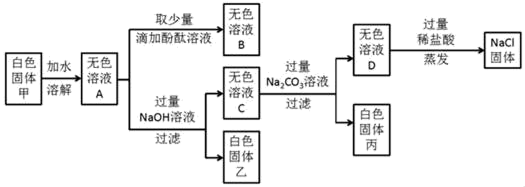 (1)、写出生成白色固体丙的化学方程式。(2)、向无色溶液D中加入过量稀盐酸的步骤中发生反应的化学方程式为;。(3)、在蒸发的操作中,当蒸发皿内出现有时,应停止加热。(4)、分析上述实验可知,白色固体甲中 一定没有的物质是。(5)、若用上述实验中的A、B、C、D四种溶液鉴别稀H2SO4和NaOH溶液,分别取样后,按下图所示操作进行实验,就能达到鉴别目的是实验(填实验编号)。
(1)、写出生成白色固体丙的化学方程式。(2)、向无色溶液D中加入过量稀盐酸的步骤中发生反应的化学方程式为;。(3)、在蒸发的操作中,当蒸发皿内出现有时,应停止加热。(4)、分析上述实验可知,白色固体甲中 一定没有的物质是。(5)、若用上述实验中的A、B、C、D四种溶液鉴别稀H2SO4和NaOH溶液,分别取样后,按下图所示操作进行实验,就能达到鉴别目的是实验(填实验编号)。
三、实验探究题
-
15. 化学是以实验为基础的学科,正确选择实验装置是实验成功的关键。下图所示装置常用于实验室制取气体,请回答下列问题。
 (1)、标号①的仪器名称是。(2)、你认为选用B作发生装置,优点是;请指出装置C中存在的一处错误。(3)、改进上述装置图中存在的错误,并以过氧化氢溶液为原料,在实验室中制取并收集干燥的氧气。按照要求选择实验装置,连接仪器后,先 , 再装入药品,进行实验。
(1)、标号①的仪器名称是。(2)、你认为选用B作发生装置,优点是;请指出装置C中存在的一处错误。(3)、改进上述装置图中存在的错误,并以过氧化氢溶液为原料,在实验室中制取并收集干燥的氧气。按照要求选择实验装置,连接仪器后,先 , 再装入药品,进行实验。①所选装置的连接顺序为(从左到右填写装置序号字母)。
②上述方法制氧气的化学方程式为。
③若把G装置中的浓硫酸换成水并盛满,用来收集难溶于水的气体时,气体从(填“a”或“b”)端通入。
(4)、甲烷(CH4)是最简单、难溶于水的有机物类气体,实验室常用加热无水醋酸钠与氢氧化钠的固体混合物来制得。实验室制取甲烷应选用的发生、收集装置是(填序号)。16. 在实验复习课上,某合作学习小组的同学用碳酸钠溶液鉴别失去标签的稀硫酸、氢氧化钠溶液和氯化钡溶液.请你参与探究并填空:(1)、【进行实验】实验操作
实验现象
实验结论
①
分别用A、B、C三支试管取三种溶液各少量,然后再各加入一定量的碳酸钠溶液
A中
B中
C中无明显现象
A中的原溶液是氯化钡溶液
B中的原溶液是稀硫酸
C中的原溶液是氢氧化钠溶液
上述实验结束后,该组同学将A、B、C三支试管中的废液倒入同一烧杯中,然后过滤得到滤液①.为确定滤液①的成分,同学们进一步做了如下实验探究:
实验操作
实验现象
实验分析
②
取少量滤液①于试管中,向其中加入足量的氯化钡溶液;过滤,得沉淀和滤液②,向沉淀中加入足量稀硝酸
产生白色沉淀
白色沉淀部分消失
根据实验现象可知,滤液①中含有
(填写溶质的化学式)
③
取少量滤液②于试管中,
根据实验现象可知,滤液②中含有氢氧化钠
(2)、【实验结论】同学们通过分析推理,得出结论:滤液①中共含有种溶质.(3)、【实验反思】向滤液①中加入足量的氯化钡溶液的目的是 .17. 粗盐中含有不溶性杂质(如泥沙等)和多种可溶性杂质(如氯化镁、氯化钙、硫酸钠等)。智慧小组的同学想利用所学化学知识得到氯化钠晶体,进行了下列实验。(1)、Ⅰ.除去不溶性杂质
取少量粗盐,加足量水溶解,可通过方法除去其中不溶性杂质。(2)、Ⅱ.除去可溶性杂质【选择试剂】同学们经过讨论,选择的试剂有:①氢氧化钠溶液②碳酸钠溶液③氯化钡溶液。
【探究过程】取步骤Ⅰ后的粗盐溶液进行下列实验

滴加甲、乙、丙三种试剂的正确顺序最多有种,下列顺序合理的是(填字母)。
A.①②③ B.③②① C.①③②
(3)、加入氢氧化钠溶液后,发生反应的化学方程式为。(4)、【反思评价】靖博同学认为,上述实验可以将甲、 乙、丙三种溶液改成两种溶液,分别为(按加入的先后顺序填写溶质的化学式)。
18. 同学们在进行课外实验“碎鸡蛋壳与醋酸的反应”时,发现会产生大量气泡。于是同学们一起再实验,对产生的气体成分进行了下列探究。【查阅资料】①浓硫酸是一种常见的干燥剂;水能使白色无水硫酸铜固体变蓝色。
②鸡蛋壳的主要成分是CaCO3 , 杂质不与醋酸反应,白醋由醋酸(化学式为CH3COOH)和水组成。
③加热的条件下氢气、一氧化碳都能使氧化铜转化为铜。
(1)、【提出猜想】该气体可能含有CO2、O2、CO、H2中的一种或几种。猜想依据是。(2)、【设计实验】将白醋和鸡蛋壳反应产生的气体缓缓通入下图装置进行实验。
【实验预测】
若气体中含有氧气则F中的实验现象为;若气体中含有氢气但不含有一氧化碳,则G中的实验现象应为 , H中的现象应为。
【进行实验】实验中只观察到D处澄清石灰水变浑浊其余都无明显现象。
(3)、 【得出结论】CaCO3与CH3COOH反应会产生。通过询问老师获知,生成物中有一种物质叫醋酸钙[Ca(CH3COO)2]。
(4)、 【交流反思】将20.0g的鸡蛋壳与足量的稀醋酸按上图进行实验,D装置增重了5.5g,则生成二氧化碳的质量为g;
(5)、计算该样品中鸡蛋壳的中碳酸钙的质量分数。设解:设20.0g的鸡蛋壳中的碳酸钙的质量为x。
写出方程式
写出相对分子质量、已知量、未知量
列比例式
求解x=12.5g
该鸡蛋壳中碳酸钙的质量分数为(列式并计算结果)