2024中考一轮总复习 第27课时 溶液的浓度
试卷更新日期:2024-02-18 类型:一轮复习
一、选择题
-
1. 在20℃时,食盐的溶解度为36克,将40克食盐投入50克水中时,得到饱和溶液的质量是( )A、68克 B、70克 C、86克 D、90克2. 对“10%的食盐溶液”含义的解释错误的是( )A、100g食盐溶液中溶解了10g食盐 B、200g水中溶解了20g食盐 C、将10g食盐溶解于90g水中所得到的溶液 D、将食盐和水按1:9的质量比配制成的溶液3. 配制溶质质量分数为5%的下列溶液,能达到目的是( )A、称取5.0g碳酸钙,放入95mL水中,充分搅拌 B、称取5.0g生石灰,放入95mL水中,充分搅拌 C、量取5.0mL浓盐酸,倒入95mL水中,充分搅拌 D、称取5.0g硝酸钾,溶在95mL水中,充分搅拌4. 20℃时氯化钠的溶解度为36g,则20℃时氯化钠的饱和溶液中溶质的质量分数为( )A、36% B、26.5% C、26.4% D、25.6%5. 从溶质质量分数为10%的氢氧化钠溶液中,取出10克溶液,则剩余溶液的溶质质量分数为( )A、20% B、5% C、8% D、不变6. 稀释某溶液时,溶液中保持不变的是( )A、溶液的质量 B、溶质的质量分数 C、溶剂的质量 D、溶质的质量7. 用100g 96%的浓H2SO4 配制成20%的稀H2SO4 , 需加水的质量为( )A、500g B、380 g C、384g D、480g8. 海水利用是解决沿海水资源短缺的重要途径.我国计划到“十三五”末,全国海水淡化总规模将达到日均220万吨以上.如图是采用“膜分离技术”淡化海水的原理图,以下分析正确的是( )
 A、加压后浓海水中溶质的质量不变 B、这种半透膜可用滤纸代替 C、加压后浓海水中溶剂质量不变 D、加压后浓海水中溶质的质量分数不变9. 下列说法不正确的是( )A、降低温度能使任何不饱和溶液转化为饱和溶液 B、汽水和蔗糖水都属于溶液 C、将200g质量分数为10%的氯化钠溶液稀释到5%,需要加水200g D、在溶液中加入KNO3晶体或蒸发溶液中的水分,都能把8%的KNO3溶液变成15%的KNO3溶液10. 向一接近饱和的KNO3溶液中,逐渐加入KON3晶体,下列图象中符合溶液中,溶质质量分数变化规律的是( )A、
A、加压后浓海水中溶质的质量不变 B、这种半透膜可用滤纸代替 C、加压后浓海水中溶剂质量不变 D、加压后浓海水中溶质的质量分数不变9. 下列说法不正确的是( )A、降低温度能使任何不饱和溶液转化为饱和溶液 B、汽水和蔗糖水都属于溶液 C、将200g质量分数为10%的氯化钠溶液稀释到5%,需要加水200g D、在溶液中加入KNO3晶体或蒸发溶液中的水分,都能把8%的KNO3溶液变成15%的KNO3溶液10. 向一接近饱和的KNO3溶液中,逐渐加入KON3晶体,下列图象中符合溶液中,溶质质量分数变化规律的是( )A、 B、
B、 C、
C、 D、
D、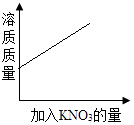
二、填空题
-
11. 华雪想制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液。请回答下列问题:(1)、若用氢氧化钠固体配制,需称取氢氧化钠g。(2)、若华雪想用25%的氢氧化钠溶液稀释成此溶液,则她需要25%的氢氧化钠溶液g;需要蒸馏水g;应选用mL(选填“10”、“20”、“50”、“100”)的量筒量取蒸馏水。12. 过氧化氢是一种有效的防疫新冠病毒的消毒剂。现有一瓶新售的过氧化氢溶液,标签如图所示,若要配制1500g溶质的质量分数为3%的医用过氧化氢溶液,需用这种过氧化氢溶液的质量是g,需要加水g。(直接填写答案,无需写出计算过程)
 13. A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答:
13. A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答: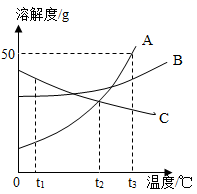
①t1℃时,A、B、C三种物质的溶解度由大到小的顺序是。
②当温度在t2~t3℃之间时,A物质与B物质(填“能”或“不能”)配制溶质质量分数相同的饱和溶液。
③将A、B、C三种物质的饱和溶液分别由t2℃升温到t3℃,所得溶液中溶质的质量分数最大的物质是。
④t3℃时将75gA的饱和溶液稀释成20%的溶液需加g水。
14. 配制溶质质量分数一定的氯化钠溶液常按以下操作顺序进行。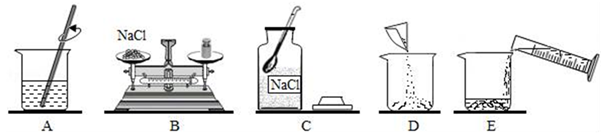
请回答下列问题:
(1)、用如图所示的序号表示正确配制该溶液的操作顺序为。(2)、用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 。A、增加适量氯化钠固体 B、减少适量氯化钠固体 C、调节游码 D、添加砝码(3)、将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是。(4)、在配制一定浓度的氯化钠溶液时,下列操作会造成溶液中溶液的浓度偏小的是。①用量筒量取水时,俯视读数 ②试剂、砝码的左右位置颠倒且使用游码
③用量筒量取水时,仰视读数 ④用于溶解的烧杯中有少量的蒸馏水
⑤转移溶液时有部分液体溅出
三、综合题
-
15. 我国海岸线长,海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大.
Ⅰ.我国海盐年产量3 千多万吨,居世界第一位,目前从海水中提取食盐的方法主要为“盐田法”,生产流程如下:
 (1)、在蒸发池中促进水分蒸发,主要是利用了下列各项中的(填选项序号).
(1)、在蒸发池中促进水分蒸发,主要是利用了下列各项中的(填选项序号).①潮汐能 ②生物能 ③电能 ④太阳能 ⑤化学能
(2)、上述流程中得到的卤水是氯化钠的溶液(填“饱和”或“不饱和”).Ⅱ.金属镁广泛应用于生活、生产和国防工业.从卤水中提取镁的过程所示:

在上述转化过程中,②处发生的化学方程式是;属于基本反应类型的反应.
(3)、Ⅲ.海水中除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素.KCl 和KNO3的溶解度曲线如图所示,试回答下列问题:
①图中曲线交点表示的含义是 .
②t1℃时,KCl 饱和溶液的溶质质量分数KNO3饱和溶液的溶质质量分数(填“大于”“小于”“等于”之一).
③已知20℃时,KNO3 的溶解度为31.6g;80℃时,KNO3的溶解度为169g.在20℃时,向盛有200g 水的烧杯中加入80g 硝酸钾,充分溶解,得到该温度时KNO3 的(填“饱和”或“不饱和”)溶液,若使烧杯内物质缓慢升温至80℃,(忽略水分蒸发) 在该温度下,最后所得溶液中溶质与溶剂的质量之比为(填最简整数比).
④若KNO3溶液中混有少量的NaCl 杂质,可以采取方法获得较纯净的KNO3 .
16. 如图1图象和表格是数据表达的重要手段,根据下列图表回答问题.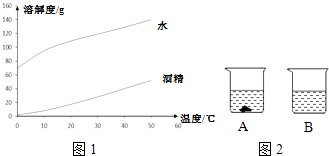
表一 甲、乙分别在水、酒精中的溶解度
甲
乙
20℃
40℃
20℃
40℃
水
109g
129g
21.8g
49g
酒精
17.3g
40g
不溶
不溶
图2 甲分别在水、酒精中的溶解度曲线
(1)、分析表一数据可知,物质的溶解度受 (填序号)的影响.A、溶剂质量 B、溶剂性质 C、溶质性质 D、温度(2)、比较表一、图1可知,图象与表格均能反映温度对固体物质溶解度的影响,其中图象的优点有 (填序号).A、数据更齐全 B、数据更精准 C、变化规律更直观(3)、若甲是NaOH,乙是Na2CO3 , 40℃时将CO2通入饱和的NaOH的酒精溶液,结合表一,写出该过程发生反应的化学方程式 .(4)、40℃时,向两个盛有相同质量甲固体的烧杯中分别加入100g水和100g酒精,充分溶解后恢复至20℃,其结果如图2所示.下列说法中正确的是(填序号).①烧杯B中一定是不饱和溶液.
②烧杯B中的溶剂是酒精.
③升高温度或增加溶剂都有可能将A中固体全部溶解.
④若将烧杯A中溶液变为不饱和溶液,溶液中溶质质量分数一定减小.
四、计算题
-
17. 某化学兴趣小组同学欲测定某铁粉与碳粉混合物中铁的质量分数,他们进行了如图所示的实验。请计算:
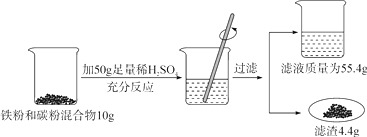 (1)、混合物中铁的质量。(2)、反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数。(3)、欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水的质量是多少?
(1)、混合物中铁的质量。(2)、反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数。(3)、欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水的质量是多少?