2024中考一轮总复习 第23课时 金属的化学性质
试卷更新日期:2024-02-18 类型:一轮复习
一、选择题
-
1. 金属活动性最强的金属是( )A、汞 B、金 C、银 D、铝2. 下列反应中不属于置换反应的( )A、Fe+2HCl═FeCl2+H2↑ B、C+2CuO 2Cu+CO2↑ C、Fe+CuSO4═Cu+FeSO4 D、3CO+Fe2O3 2Fe+3CO23. 下列有关铁及其化合物的说法中错误的是( )A、生铁和钢都是铁的合金 B、铁与盐酸反应生成氯化亚铁和氢气 C、地壳中含量最多的金属元素是铁元素 D、铁能与硫酸铜反应生成铜和硫酸亚铁4. 下列说法中,正确的是( )A、地壳中含量最多的金属元素是铁 B、赤铁矿、磁铁矿是重要的金属资源 C、铝比铁活泼,所以铁比铝耐腐蚀 D、纯铜的熔点小于铜锌合金5. 根据你的生活经验和所学的化学知识判断,下列做法不科学的是( )A、用钢丝球洗刷铝制炊具 B、用汽油除去衣服上的油污 C、油锅着火用锅盖盖灭 D、用热水洗去附着在烧杯底部的硝酸钾6. 下列说法符合图中漫画情景的是( )
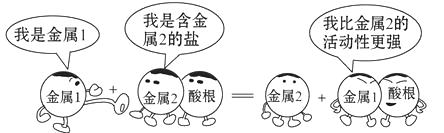 A、此反应可能是复分解反应 B、若金属1是锌,金属2可能是银 C、此反应可能是Cu+2AgCl=2Ag+CuCl2 D、比较铁和铜的活动性强弱可以用硫酸镁溶液7. 下列叙述不正确的是( )A、合金的性能一般比组成它们的纯金属更优越 B、活泼金属能与盐酸反应放出气体,则能与盐酸反应放出气体的物质一定是活泼金属 C、地壳中含量最多的金属和年产量最高的金属分别是铝和铁 D、回收利用废旧金属,不仅可以节约金属资源和能源,还可以减少对环境的污染8. 为了验证铁、锌、铜三种金属的活动性顺序,设计了如下四种方案,其中可行的是( )。A、将Zn、Cu分别加入到FeSO4溶液中 B、将Zn、Fe分别加入到CuSO4溶液中 C、将Zn分别加入到FeSO4、CuSO4溶液中 D、将Cu分别加入到ZnSO4、FeSO4溶液中9. 将红色的铜丝置于酒精灯火焰上加热,表面变黑.将变黑的铜丝插入盛有稀硫酸的试管中一段时间,有关说法不正确的是( )A、铜丝表面变黑,质量增加 B、变黑的铜丝插入稀硫酸,表面恢复红色 C、变黑的铜丝插入稀硫酸,铜丝质量变少 D、变黑的铜丝插入稀硫酸,溶液质量不变10. 下列实验方案中,能达到实验目的是( )
A、此反应可能是复分解反应 B、若金属1是锌,金属2可能是银 C、此反应可能是Cu+2AgCl=2Ag+CuCl2 D、比较铁和铜的活动性强弱可以用硫酸镁溶液7. 下列叙述不正确的是( )A、合金的性能一般比组成它们的纯金属更优越 B、活泼金属能与盐酸反应放出气体,则能与盐酸反应放出气体的物质一定是活泼金属 C、地壳中含量最多的金属和年产量最高的金属分别是铝和铁 D、回收利用废旧金属,不仅可以节约金属资源和能源,还可以减少对环境的污染8. 为了验证铁、锌、铜三种金属的活动性顺序,设计了如下四种方案,其中可行的是( )。A、将Zn、Cu分别加入到FeSO4溶液中 B、将Zn、Fe分别加入到CuSO4溶液中 C、将Zn分别加入到FeSO4、CuSO4溶液中 D、将Cu分别加入到ZnSO4、FeSO4溶液中9. 将红色的铜丝置于酒精灯火焰上加热,表面变黑.将变黑的铜丝插入盛有稀硫酸的试管中一段时间,有关说法不正确的是( )A、铜丝表面变黑,质量增加 B、变黑的铜丝插入稀硫酸,表面恢复红色 C、变黑的铜丝插入稀硫酸,铜丝质量变少 D、变黑的铜丝插入稀硫酸,溶液质量不变10. 下列实验方案中,能达到实验目的是( )选项
实验目的
实验方案
A
鉴别软水和硬水
分别加入食盐水,振荡
B
除去铜粉中的少量铁粉
加入足量稀盐酸,充分反应后,过滤
C
检验二氧化碳气体中是否含有少量的一氧化碳
将混合气体依次通过灼热的氧化铁和澄清石灰水,观察澄清石灰水的变化
D
除去FeCl2溶液中含有的少量CuCl2
加入足量锌粉,充分反应后,过滤
A、A B、B C、C D、D11. 有X、Y、Z三种金属,将Y放入XSO4溶液时,溶液质量不断增加;把X放入ZNO3溶液时,溶液质量不断减少,则下列符合X、Y、Z顺序排列的是( )A、Zn、Fe、Cu B、Fe、Mg、Cu C、Al、Fe、Ag D、Cu、Zn、Ag12. 向AgNO3、Cu(NO3)2的混合溶液中加入一些铁粉,完全反应后过滤。不可能存在的情况是()A、滤纸上有Ag,滤液中有 、 、 B、滤纸上有Ag、Cu,滤液中有 、 C、滤纸上有Ag、Cu、Fe,滤液中有 D、滤纸上有Ag、Cu、Fe,滤液中有 、二、综合题
-
13. 我国劳动人民早在春秋战国时期就已经懂得钢铁冶炼,铁也是生活中使用最为广泛的金属,目前我国钢铁产量已经位居世界第一.下面是一组有关铁的问题,请你用所学化学知识加以回答:(1)、铁是地壳中含量第位的元素;(2)、铁可以拉成铁丝,压成铁片,这是利用了铁的性;在公路上行驶的油罐车尾部经常有一条铁链拖在地面上,这是利用了铁的性;家里铁制炊具要有木柄或塑料柄,这是因为铁有很好的性;(3)、焊接钢管时,经常用硫酸铜溶液在钢管表面画交叉线,然后根据出现的红线对准焊接,用化学方程式表示反应原理 .(4)、颗粒大小达到纳米级的单质铁具有很强的反应活性,俗称纳米铁.在高温环境下,用H2和FeCl2反应,可以生成纳米铁和一种易溶于水显强酸性的气体,写出该反应的化学方程式 , 纳米铁粉在空气中受撞击时会燃烧,生成一种黑色固体,写出该反应的化学方程式 . 请你写出纳米铁和稀盐酸反应的化学反应方程式 .14. 金属在生产、生活中应用广泛.(1)、“沙里淘金”说明黄金在自然界中以 (选填“单质”或“化合物”)形式存在.(2)、铝、铁、铜是生活中广泛使用的三种金属.下列试剂中,哪些能直接验证这三种金属的活动性顺序? (填字母代号).A、硫酸铝溶液 B、硫酸亚铁溶液 C、硫酸铜溶液 D、稀硫酸(3)、铁制品锈蚀,实际上是铁跟空气中的氧气、发生了化学反应.将生锈的铁片放入硫酸和硫酸铜的混合溶液中,可能发生的反应有 个,写出其中一个置换反应的化学方程式 .(4)、在CuSO4和Al2(SO4)3的混合溶液中,加入一定量的铁粉充分反应,过滤后得到滤液和固体剩余物.向该剩余物中加入足量的稀盐酸,有气泡产生.则滤液中一定含有的金属阳离子是 (写离子符号).(5)、将一定量的锌粉加入到氯化亚铁和氯化铜的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生,则滤渣中一定含有的物质是 , 滤液中一定不含的物质是(填化学式).15. 某工厂废液中含有氯化铜和氯化亚铁.某课外化学兴趣小组要将废液进行处理并得到铜和氧化铁两种产品.过程如图所示:
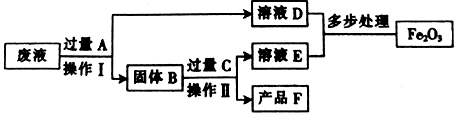 (1)、废液中含有氯化铜和氯化亚铁,加入过量A物质的目的是 .(2)、操作Ⅰ和Ⅱ的名称是 , 其中除用到烧杯、漏斗和铁架台外,还需要的玻璃仪器是 .(3)、检验C过量的方法是 .(4)、经过处理后,氧化铁中铁元素的质量(填“等于”、“小于”或“大于”)废液中氯化亚铁中铁元素的质量.16. 回收利用废金属是解决废金属造成资源浪费和不同程度的环境污染的方法之一.某市一家大型化工厂处理回收含铜废料的生产流程与部分操作如下:
(1)、废液中含有氯化铜和氯化亚铁,加入过量A物质的目的是 .(2)、操作Ⅰ和Ⅱ的名称是 , 其中除用到烧杯、漏斗和铁架台外,还需要的玻璃仪器是 .(3)、检验C过量的方法是 .(4)、经过处理后,氧化铁中铁元素的质量(填“等于”、“小于”或“大于”)废液中氯化亚铁中铁元素的质量.16. 回收利用废金属是解决废金属造成资源浪费和不同程度的环境污染的方法之一.某市一家大型化工厂处理回收含铜废料的生产流程与部分操作如下: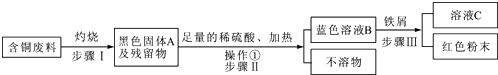
(注:步骤Ⅰ得到的残留物不溶于水和稀硫酸)
请回答下列问题:
(1)、黑色固体A的成分是(用化学式表示);(2)、流程图中操作①的名称是 , 该操作中用到玻璃棒的作用是;(3)、写出步骤Ⅲ的一个反应的化学方程式;(4)、通常在步骤Ⅲ必须加入略过量的“铁屑”,原因是 .17. 以下是两个常见的工业流程,流程一:从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,生产流程如图2所示:
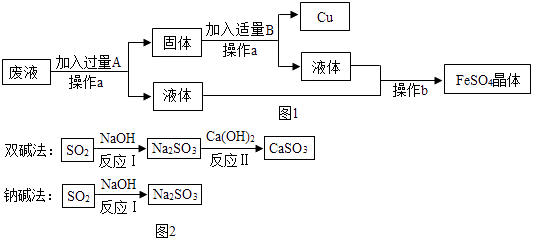 (1)、加入过量的A物质,该A物质为 . 操作a的名称是 , 操作a所用到的玻璃仪器有烧杯、玻璃棒 , 操作a中玻璃棒的作用是 .(2)、写出流程图中的固体成分的化学式 , B的溶液中溶质的化学式(3)、流程二:如图2是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略),请回答下列问题:
(1)、加入过量的A物质,该A物质为 . 操作a的名称是 , 操作a所用到的玻璃仪器有烧杯、玻璃棒 , 操作a中玻璃棒的作用是 .(2)、写出流程图中的固体成分的化学式 , B的溶液中溶质的化学式(3)、流程二:如图2是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略),请回答下列问题:①CaSO3中Ca、S、O元素的质量比是 .
②已知原料NaOH的价格为2.9元/kg.而Ca(OH)2的价格为0.36元/kg.两种工艺中,处理相同质量的SO2 , 双碱法所需的原料成本更低,其原因是 .
三、实验探究题
-
18. 小彬同学家新买了水龙头,他从说明书上了解到该水龙头是铜质镀铬的.想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,小彬进行了如下探究的活动.
【查阅资料】铬(Cr)是银白色、有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜.铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液…
铝是银白色、有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液…
【猜想与预测】三种金属在金属活动性顺序中的相对位置关系:①Cr、Al、Cu;②Al、Cr、Cu;③Al、Cu、Cr.
【实验验证】取大小相同的三种金属薄片,用砂纸打磨光亮(除去金属表面的氧化物)
实验一
实验二
实验三
实验方案
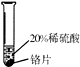
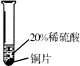
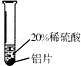
实验现象
铬片表面产生气泡缓慢,溶液变蓝色
无现象
结论
铬能与稀硫酸发生反应,反应速率较慢
铜不与稀硫酸反应
铝能与稀硫酸发生反应,反应速率较快
三种金属在金属活动性顺序中的相对位置关系是 (填序号)
【反思交流】
(1)、请将上述实验现象或结论填写完整.(2)、实验一发生反应的化学方程式是: .(3)、小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是 .【归纳提升】
1)小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,如:Al、CrSO4溶液、Cu这三种药品.
2)比较金属活动性强弱的方法有:
①通过金属与酸反应,判断金属活动性强弱②通过金属与盐溶液反应,判断金属活动性强弱.
19. 已知一种固体化合物由C、H、O、Cu四种元素组成.向盛有该化合物的试管中加入稀盐酸,产生大量气泡,固体逐渐溶解,得到蓝绿色溶液.已知这种蓝绿色是氯化铜溶液.(1)、探究产生的气体是什么.【猜想】①可能是氢气;②③
【实验】请你针对②和③猜想中的一种,为验证猜想,你设计的实验是: .
(2)、从蓝绿色溶液中提取金属铜.现利用该溶液制取金属铜,同时产生FeSO4补血剂,过程如下:
操作1的名称为 , 完成该实验需要的主要玻璃仪器有、、 ,
加入过量的Fe的目的是 , 反应化学方程式为 , 属于反应.B的化学式为;加入足量B的目的是 , 如何确定此目的已经达到?
你的操作是: .
20. 金属的使用范围特别广.现探究金属与酸溶液反应快慢与哪些因素有关.陈璐、魏松明、韩俊洋、徐庚辰4位同学分别做了下列实验:(1)、实验:【陈璐实验】用铝片与铝粉分别和稀盐酸反应,发现反应快,方程式 .
【魏松明实验】用镁粉与铝粉分别与稀盐酸反应,发现反应快.
韩俊洋实验】用镁条分别与10%稀盐酸、15%稀盐酸反应,发现反应快.
【徐庚辰实验】用镁条分别与10%稀盐酸、10%稀硫酸反应,发现稀盐酸反应快.
【实验结论】金属与酸溶液反应快慢与 金属的、金属颗粒的、酸的等有关.
(2)、等质量的A、B两种活泼金属(化合价均为+2价)与足量稀盐酸反应时产生H2的质量与反应时间的关系如图.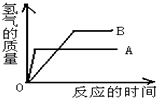
①A、B两种金属的活动性大小是;
②A、B两种金属的相对原子质量大小是;
③在三组Mg和Fe;Zn和Fe;Zn和Cu中,A、B可能是 .
(3)、取32.1g 敞口置露空气中铝片放入足量稀硫酸中,起初没有气泡,过会产生大量气泡,共收集到H2 3g,假设H2被全收集到,则其中含铝g,该铝片中铝元素质量为g.
(4)、【反思与评价】等质量的 铝粉 与 铝片 分别与足量的稀硫酸、稀盐酸反应,产生H2 的质量关系是(选择填空:相等 或 大于 或 小于 ),理由是 .