2024中考一轮总复习 第16课时 根据化学方程式的计算
试卷更新日期:2024-02-18 类型:一轮复习
一、选择题
-
1. 下列叙述完全符合质量守恒定律的是()
A、水结成冰前后,质量保持不变 B、50mL水和50mL乙醇混合后总体积小于100mL C、在100g过氧化氢溶液中,含有30g过氧化氢和70g水 D、1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳2. 下列关系一定成立的是( )A、50mL酒精与50mL水混合,形成100mL酒精溶液 B、1g石灰石粉末与20g水混合,形成21g溶液 C、3g氢气与24g氧气充分反应,生成27g水 D、10g氢氧化钠稀溶液与10g硫酸铜溶液混合,形成20g混合溶液3. 16.0g硫在氧气中完全燃烧生成二氧化硫的质量是()A、16.0g B、32.0g C、8.0g D、64.0g4. 有A,B,C,D种物质,它们能发生如下反应,A+B═C+D,10g的A与l5gB恰好完全反应,生成20gC,若要生成10gD,需要参加反应的B的质量为()A、15g B、20g C、25g D、30g5. 在反应2A+B=3C+D中,A和B的相对分子质量之比为5:1,已知20克A与一定量B恰好完全反应,生成5克D,则在此反应中B和C的质量比是( )A、4:9 B、3:5 C、1:3 D、2:176. 在反应2A+B=2C中,48gA与一定质量的B恰好完全反应,生成80gC。则A与B的相对分子质量之比为( )A、2:1 B、3:4 C、1:2 D、4:37. 质量相等的两份氯酸钾a和b,a中再加少量二氧化锰,b中再加入少量高锰酸钾,将药品分别加热到完全反应,则收集到氧气的质量随加热时间变化的图象如下,其中相对正确的是( )A、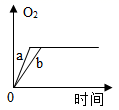 B、
B、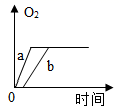 C、
C、 D、
D、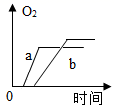 8. 相同质量的下列物质,完全分解后制得氧气质量最少的是( )A、H2O2 B、H2O C、KClO3 D、KMnO49. 如图所示的四个图象,能正确反映对应变化关系的是( )A、
8. 相同质量的下列物质,完全分解后制得氧气质量最少的是( )A、H2O2 B、H2O C、KClO3 D、KMnO49. 如图所示的四个图象,能正确反映对应变化关系的是( )A、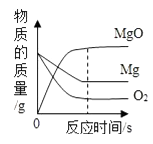 镁在氧气中燃烧
B、
镁在氧气中燃烧
B、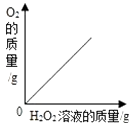 向二氧化锰中加入过氧化氢溶液
C、
向二氧化锰中加入过氧化氢溶液
C、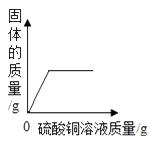 向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
D、
向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
D、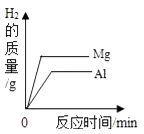 等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
10. 在化学反应A2+BC=B+A2C中,反应物BC与生成物 B的质量关系如右图所示.将2g A2与80g BC恰好完全反应,则生成A2C的质量是()
等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
10. 在化学反应A2+BC=B+A2C中,反应物BC与生成物 B的质量关系如右图所示.将2g A2与80g BC恰好完全反应,则生成A2C的质量是() A、64g B、18g C、80g D、9g
A、64g B、18g C、80g D、9g二、填空题
-
11. 甲醇(CH3OH)是一种有毒、有酒的气味的可燃性液体.甲醇在氧气中不完全燃烧可发生如下反应:8CH3OH+nO2点燃mCO2+2CO+16H2O.若反应生成3.6g水,请计算:m值是;参加反应的氧气质量是克.12. 在化学反应3X+4Y=2Z中,已知X和Z的相对分子质量分别是32和102,则Y的相对分子质量为。13. 一定条件下2A+B=2C的反应中,若8g物质A和一定质量的B恰好完全反应生成72gC,则物质B的质量为g,上述反应所属的基本反应类型为;若B的相对分子质量为32,则A的相对分子质量为。
三、计算题
-
14. 著名科学家诺贝尔经过长期试验,研制出安全炸药。炸药三硝酸甘油酯(C3H5N3O9)发生爆炸的化学方程式为:4C3H5N3O912CO2↑+10H2O↑+ 6X↑+O2↑(1)、推断X的化学式为。(2)、若生成13.2 g二氧化碳,则同时生成氧气的质量是多少?15. 把干燥纯净的氯酸钾和二氧化锰的混合物6.66g,加热至不再产生气体为止,称量剩余物质量为4.74g,求:(1)、生成氧气的质量。(2)、根据化学方程式计算混合物中氯酸钾的质量。(3)、剩余物质各是什么?质量分别是多少g?16. 某课外活动小组为测定九嶷山三分石石灰石中含碳酸钙的质量分数,取来了一些矿石,准确称取25g放于盛有200g稀盐酸(氯化氢和水的混合物)的烧杯中(杂质不溶于水,也不与稀盐酸反应,也不分解),恰好完全反应。测得烧杯内物质的总质量与时间的关系如图所示(气体溶解忽略不计)。试计算:
 (1)、生成二氧化碳的质量是;(2)、参加反应的碳酸钙的质量是?(3)、石灰石中碳酸钙的质量分数是?17. 某兴趣小组取一瓶久置的过氧化氢溶液 34.0g 进行实验,实验完毕后测得相关数据如图所示:
(1)、生成二氧化碳的质量是;(2)、参加反应的碳酸钙的质量是?(3)、石灰石中碳酸钙的质量分数是?17. 某兴趣小组取一瓶久置的过氧化氢溶液 34.0g 进行实验,实验完毕后测得相关数据如图所示: (1)、二氧化锰在反应过程中的作用 , 剩余的混合物中二氧化锰的质量为g;(2)、计算参加反应的过氧化氢的质量。(写出解题过程)18. 某实验小组将63.2g高锰酸钾固体加热分解,并测得剩余固体的质量变化和加热时间关系如图所示,请认真分析图像,回答下列问题:
(1)、二氧化锰在反应过程中的作用 , 剩余的混合物中二氧化锰的质量为g;(2)、计算参加反应的过氧化氢的质量。(写出解题过程)18. 某实验小组将63.2g高锰酸钾固体加热分解,并测得剩余固体的质量变化和加热时间关系如图所示,请认真分析图像,回答下列问题: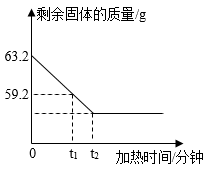 (1)、加热到t1分钟时,产生氧气的质量是g。(2)、加热到t2分钟时,剩余固体中有哪些物质?质量分别是多少?(要求写出计算过程)19. 某品牌钙片的部分信息:①钙片主要成分为碳酸钙;②每片钙片的质量为0.8克。化学社团的同学为测定钙片中钙元素的含量,进行了如图实验:(假设钙片中其他成分不含钙元素,不溶于水且不与任何物质发生反应)。
(1)、加热到t1分钟时,产生氧气的质量是g。(2)、加热到t2分钟时,剩余固体中有哪些物质?质量分别是多少?(要求写出计算过程)19. 某品牌钙片的部分信息:①钙片主要成分为碳酸钙;②每片钙片的质量为0.8克。化学社团的同学为测定钙片中钙元素的含量,进行了如图实验:(假设钙片中其他成分不含钙元素,不溶于水且不与任何物质发生反应)。
根据图示信息,回答下列问题:
(1)、钙片用于补“钙”。钙片中所含的“钙”是指____(填序号)。A、元素 B、单质 C、原子(2)、将钙片研碎的目的是;(3)、每片钙片中所含钙的质量;(4)、计算滤液的质量(要求写出计算过程)。20. 黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜样品中锌的含量,现将10g黄铜样品,与一定质量的稀硫酸恰好完全反应,所得物质总质量103.5g,同时生成氢气0.2g,试计算:(1)、该黄铜样品中锌的质量为g;(2)、恰好完全反应后所得溶液中溶质的质量分数。