浙江省温州市2023-2024学年高二上学期1月期末教学质量统一检测化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题(本大题共16小题,每小题3分,共48分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
-
1. 下列属于弱电解质的是( )。A、 B、Fe C、 D、2. 下列化学用语表示不正确的是( )。A、基态F原子的核外电子排布式: B、的空间填充模型:
 C、的VSEPR模型:
C、的VSEPR模型: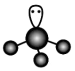 D、的电子式:
3. 下列反应符合如图能量变化的是( )。
D、的电子式:
3. 下列反应符合如图能量变化的是( )。
化学反应中焓的变化示意图
A、灼热的炭与氧气的反应 B、盐酸与碳酸氢钠的反应 C、铁与稀硫酸的反应 D、氢气与氯气的反应4. 下列说法正确的是( )。A、、、轨道相互垂直,能量相等 B、同一族元素的价层电子排布一定相同 C、 符合泡利原理和能量最低原理
D、电子从3s能级跃迁到3p能级,产生的原子光谱为发射光谱
5. 下列各组物质的晶体类型不相同的是( )。A、晶体硅和二氧化硅 B、氯化铯和氯化钠 C、金刚石和石墨 D、碳钢和金属铝6. 一定温度下,在恒容密闭容器中充入3种气体M、N和Q,它们的物质的量随时间变化如图所示。下列说法不正确的是( )。
符合泡利原理和能量最低原理
D、电子从3s能级跃迁到3p能级,产生的原子光谱为发射光谱
5. 下列各组物质的晶体类型不相同的是( )。A、晶体硅和二氧化硅 B、氯化铯和氯化钠 C、金刚石和石墨 D、碳钢和金属铝6. 一定温度下,在恒容密闭容器中充入3种气体M、N和Q,它们的物质的量随时间变化如图所示。下列说法不正确的是( )。 A、该反应的化学方程式: B、内N的平均反应速率为 C、 D、升高体系温度,正反应速率减小,逆反应速率增大7. 恒容密闭容器中,加入和 , 发生反应: , 在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法不正确的是( )。
A、该反应的化学方程式: B、内N的平均反应速率为 C、 D、升高体系温度,正反应速率减小,逆反应速率增大7. 恒容密闭容器中,加入和 , 发生反应: , 在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法不正确的是( )。 A、该反应的 B、向平衡体系中加入 , 的平衡转化率增大 C、该反应的平衡常数表达式 D、向平衡体系中充入稀有气体,平衡不移动8. 下列分子中,键角最小的是( )。A、 B、 C、 D、9. 乳酸分子的结构式如图所示。关于乳酸的说法不正确的是( )
A、该反应的 B、向平衡体系中加入 , 的平衡转化率增大 C、该反应的平衡常数表达式 D、向平衡体系中充入稀有气体,平衡不移动8. 下列分子中,键角最小的是( )。A、 B、 C、 D、9. 乳酸分子的结构式如图所示。关于乳酸的说法不正确的是( ) A、碳原子的杂化方式为、 B、该乳酸分子含有1个手性碳原子 C、该乳酸分子中含有个键 D、含有2种官能团10. 某研究小组利用氢氧燃料电池作为电源,进行电解饱和溶液的实验,装置如图所示。下列说法正确的是( )。
A、碳原子的杂化方式为、 B、该乳酸分子含有1个手性碳原子 C、该乳酸分子中含有个键 D、含有2种官能团10. 某研究小组利用氢氧燃料电池作为电源,进行电解饱和溶液的实验,装置如图所示。下列说法正确的是( )。 A、a电极上得到的是 B、氢氧燃料电池工作时,负极的电极反应为: C、当电路中通过电子的电量时,理论上会有生成 D、若将两极石墨棒换成Fe棒,溶液中发生的总反应式不变11. X、Y、Z、W、R是周期表中的短周期主族元素,原子序数依次增大。X在所有元素中原子半径最小,Y、W基态原子核外均有2个未成对电子,R具有11种不同运动状态的电子。下列说法不正确的是( )。A、原子半径: B、元素第一电离能:Y<W<Z C、Y、Z最高价氧化物对应水化物的酸性:Y>Z D、中含有极性共价键和非极性共价键12. 某学习小组同学研究过氧化氢溶液与氢碘酸(HI)反应: , 室温下的实验数据如下表。已知:该反应的速率方程可表示为;
A、a电极上得到的是 B、氢氧燃料电池工作时,负极的电极反应为: C、当电路中通过电子的电量时,理论上会有生成 D、若将两极石墨棒换成Fe棒,溶液中发生的总反应式不变11. X、Y、Z、W、R是周期表中的短周期主族元素,原子序数依次增大。X在所有元素中原子半径最小,Y、W基态原子核外均有2个未成对电子,R具有11种不同运动状态的电子。下列说法不正确的是( )。A、原子半径: B、元素第一电离能:Y<W<Z C、Y、Z最高价氧化物对应水化物的酸性:Y>Z D、中含有极性共价键和非极性共价键12. 某学习小组同学研究过氧化氢溶液与氢碘酸(HI)反应: , 室温下的实验数据如下表。已知:该反应的速率方程可表示为;实验编号
①
②
③
④
⑤
0.1
0.1
0.1
0.2
0.3
0.1
0.2
0.3
0.1
0.1
从混合至溶液出现棕黄色的时间/s
13
6.5
4.3
6.5
4.3
下列有关说法不正确的是( )。
A、实验①进行后测得 , 则 B、由编号为①②③的实验数据可知,当浓度不变时,增大HI浓度,该反应速率加快 C、对比表中数据, , D、将实验⑤的温度升高,溶液出现棕黄色时间变长,可能是温度升高使双氧水分解13. 25℃时,部分弱酸的电离平衡常数如下表:化学式
电离平衡常数
下列说法正确的是( )。
A、相同物质的量浓度的溶液中,由水电离出的: B、溶液中通入少量发生反应: C、同一溶液中,当时,则 D、溶液加水稀释,溶液中、、离子的浓度均减少14. 25℃时,下列说法正确的是( )。A、等pH的溶液和溶液,后者的较大 B、等浓度等体积的醋酸溶液与溶液混合,溶液中 C、将溶液加热至80℃,溶液的pH不变 D、将的氨水加水稀释100倍后溶液的15. 一定温度下,将足量的固体溶于水中,充分搅拌,慢慢加入固体,随着增大,溶液中的变化曲线如图所示。下列说法正确的是( )。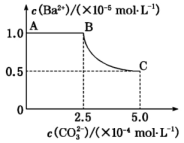 A、该温度下, B、加入固体,立即有固体生成 C、B点表示的溶液中, D、该温度下,在水中的大于在溶液中的16. 下列实验操作、现象和结论都正确的是( )。
A、该温度下, B、加入固体,立即有固体生成 C、B点表示的溶液中, D、该温度下,在水中的大于在溶液中的16. 下列实验操作、现象和结论都正确的是( )。选项
实验操作
现象
结论
A
常温下,测定溶液的pH
的电离平衡常数小于的水解平衡常数
B
往溶液中加入盐酸,将产生的气体通入溶液中
溶液中有沉淀生成
非金属性:Cl>C>Si
C
向溶液中先滴加4滴溶液,再滴加4滴溶液
先产生白色沉淀,再产生黄色沉淀
溶解度:
D
向溶液中加入溶液
有白色沉淀生成
结合的能力比强
A、A B、B C、C D、D二、非选择题(本大题共5小题,共52分)
-
17. 氧族元素及其化合物在生产、生活中发挥着重要的作用。回答如下问题:(1)、氧元素在元素周期表中的位置。基态氧原子的价层电子轨道表示式为 , 电子占据最高能级的电子云轮廓图为形。(2)、硫为区元素,P、S、Cl的电负性由大到小的顺序为。(3)、、、沸点由大到小的顺序为。(4)、硫酸的结构式如图 , 比较酸性:(填“大于”“小于”或“等于”),并说明原因:。18. 亚硝酸钠是一种无色、无味晶体,具有防腐和抗氧化作用,常用作食品添加剂,但在使用时必须严格控制其用量。
为了测定某样品中的含量,某同学进行如下实验:①称取样品a g,加水溶解配制成溶液;②取溶液于锥形瓶中,用酸性标准溶液进行滴定,滴定结束后消耗溶液V mL。
(1)、上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外,还需;在进行滴定操作时,溶液盛装在如图中的(填“甲”或“乙”)滴定管中。 (2)、用标准溶液滴定可分为如下几步,按实验操作先后顺序排序(填字母)。
(2)、用标准溶液滴定可分为如下几步,按实验操作先后顺序排序(填字母)。
A.用标准溶液润洗滴定管2~3次
B.固定盛有标准溶液的滴定管,赶出尖嘴处气泡
C.用标准溶液滴定至终点,读数
D.取标准溶液注入滴定管至“0”刻度线以上
E.调节液面至0刻度线以下,读数(3)、滴定过程中发生如下反应的离子方程式,请补充完成。===
(4)、当滴入最后半滴溶液, , 即到达滴定终点。若滴定过程中刚出现颜色变化就停止滴定,则测定结果。(填“偏大”“偏小”或“无影响”)(5)、测得该样品中的质量分数为。19. 甲醇是重要的化工原料,应用前景广阔。研究表明,二氧化碳与氢气可以合成甲醇:一般认为可通过如下两个步骤来实现:
步骤①
步骤②
(1)、 , 该反应在条件下能自发进行(填“高温”、“低温”、“任意温度”)。(2)、步骤①为慢反应,下列示意图中能体现上述反应能量变化的是____。A、 B、
B、 C、
C、 D、
D、 (3)、在恒温恒压条件下,若和的物质的量之比为 , 相应平衡体系中的物质的量分数为x , 请在下图中绘制x随n变化的示意图(不考虑副反应)
(3)、在恒温恒压条件下,若和的物质的量之比为 , 相应平衡体系中的物质的量分数为x , 请在下图中绘制x随n变化的示意图(不考虑副反应) (4)、恒压条件下,按和的物质的量之比为投料,发生反应Ⅰ、Ⅱ。实验测得的平衡转化率和平衡时的选择性随温度的变化如下图所示。
(4)、恒压条件下,按和的物质的量之比为投料,发生反应Ⅰ、Ⅱ。实验测得的平衡转化率和平衡时的选择性随温度的变化如下图所示。Ⅰ.
Ⅱ.

已知:的选择性=×100%
①下列能说明体系已达到平衡状态的是。
A.混合气体的密度不再变化
B.混合气体的总压强不再变化
C.的物质的量不再变化
②温度高于300℃时,平衡转化率随温度升高而上升的原因:。
(5)、常温常压下,甲醇作为燃料,每完全燃烧生成二氧化碳和水时放出的热量为 , 请写出甲醇燃烧热的热化学方程式。20. 新型储氢合金的晶胞如图所示,该晶胞为立方体,晶胞棱长为a nm。 (1)、基态Fe原子共有种空间运动状态的电子;基态的价层电子排布式为。(2)、下列说法正确的是____。A、该晶胞与金刚石晶胞结构相似 B、铁原子之间最短距离为 C、该合金储氢过程是化学吸附 D、储氢后材料中存在离子键、共价键和分子间作用力(3)、该晶体化学式为;设阿伏加德罗常数的值为 , 则该晶胞密度为。(只需列出计算的表达式)(4)、每个Fe周围与它最近且等距的Mg有个。21.(1)、Ⅰ.实验室用的氢氧化钠溶液吸收多余的氯气。测得吸收后的溶液中 , 和的物质的量浓度之比为。(不考虑反应前后溶液的体积变化)。
(1)、基态Fe原子共有种空间运动状态的电子;基态的价层电子排布式为。(2)、下列说法正确的是____。A、该晶胞与金刚石晶胞结构相似 B、铁原子之间最短距离为 C、该合金储氢过程是化学吸附 D、储氢后材料中存在离子键、共价键和分子间作用力(3)、该晶体化学式为;设阿伏加德罗常数的值为 , 则该晶胞密度为。(只需列出计算的表达式)(4)、每个Fe周围与它最近且等距的Mg有个。21.(1)、Ⅰ.实验室用的氢氧化钠溶液吸收多余的氯气。测得吸收后的溶液中 , 和的物质的量浓度之比为。(不考虑反应前后溶液的体积变化)。
吸收氯气所消耗的氢氧化钠物质的量为。(2)、被氧化与被还原的氯气的物质的量之比为。(3)、Ⅱ.无水与作用会生成。现有无水 , 吸收后变成 , 试回答下列问题:中。
(4)、为配合物,其中的配位数为6,经测定该配合物和足量溶液反应得到沉淀,则该配合物的化学式可表示为。