四川省自贡市2023-2024学年高二上学期期末考试化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
-
1. 化学与科学、技术、社会、环境关系密切,下列说法错误的是( )A、明矾净水时能沉降水中的悬浮物,但不能杀菌消毒 B、草木灰与铵态氮肥混合施用会降低氮肥的肥效 C、金属焊接时可用饱和氯化铵溶液作除锈剂 D、用石墨电极电解熔融氯化铝可以制备金属铝2. 某反应过程的能量变化如图所示,下列说法错误的是( )
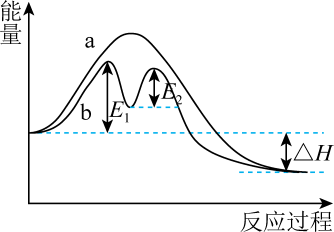 A、该反应为放热反应, B、过程b有催化剂参与 C、过程a的活化能大于 D、过程b中第二步反应是决速步骤3. 下列说法正确的是( )A、已知C(石墨,s)(金刚石,s) , 则金刚石比石墨稳定 B、已知 , , 则 C、氢气的燃烧热为285.8 , 则表示氢气燃烧热的热化学方程式为 D、在一定条件下,将和置于密闭容器中充分反应,放出热量79.2 kJ,则该反应的热化学方程式为4. 下列对化学反应速率增大原因的分析正确的是( )A、对有气体参加的化学反应,增大压强使容器容积减小,单位体积内活化分子数增多 B、向反应体系中加入相同浓度的反应物,使活化分子百分数增大 C、升高温度,使反应物分子中活化分子数增多,活化分子百分数不变 D、加入适宜的催化剂,使反应物分子中活化分子数增多,活化分子百分数不变5. 下列说法中,正确的是( )A、难溶电解质达到沉淀溶解平衡时,保持温度不变增加难溶电解质的量,平衡向溶解方向移动 B、难溶电解质都是弱电解质 C、室温下,在水中的溶解度大于在饱和溶液中的溶解度 D、在白色沉淀上滴加溶液,沉淀变黑,说明比更难溶于水6. 在恒温恒容的密闭容器中发生反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0,下列能说明该反应达到平衡状态的是( )
A、该反应为放热反应, B、过程b有催化剂参与 C、过程a的活化能大于 D、过程b中第二步反应是决速步骤3. 下列说法正确的是( )A、已知C(石墨,s)(金刚石,s) , 则金刚石比石墨稳定 B、已知 , , 则 C、氢气的燃烧热为285.8 , 则表示氢气燃烧热的热化学方程式为 D、在一定条件下,将和置于密闭容器中充分反应,放出热量79.2 kJ,则该反应的热化学方程式为4. 下列对化学反应速率增大原因的分析正确的是( )A、对有气体参加的化学反应,增大压强使容器容积减小,单位体积内活化分子数增多 B、向反应体系中加入相同浓度的反应物,使活化分子百分数增大 C、升高温度,使反应物分子中活化分子数增多,活化分子百分数不变 D、加入适宜的催化剂,使反应物分子中活化分子数增多,活化分子百分数不变5. 下列说法中,正确的是( )A、难溶电解质达到沉淀溶解平衡时,保持温度不变增加难溶电解质的量,平衡向溶解方向移动 B、难溶电解质都是弱电解质 C、室温下,在水中的溶解度大于在饱和溶液中的溶解度 D、在白色沉淀上滴加溶液,沉淀变黑,说明比更难溶于水6. 在恒温恒容的密闭容器中发生反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0,下列能说明该反应达到平衡状态的是( )①反应速率5v(NH3)=4v(O2) ②体系的压强不再发生变化 ③混合气体的密度不再发生变化 ④气体的平均摩尔质量不再发生变化 ⑤单位时间内生成5 mol O2 , 同时断裂12 mol O—H键 ⑥NO的浓度不变
A、②④⑥ B、①②④⑥ C、②⑤⑥ D、①②③④⑤7. 将和通入密闭容器中发生反应 , 通过实验得到不同条件下达到平衡时Z的物质的量分数与温度和压强的关系如图。下列关于该反应的的判断正确的是 ( ) A、 B、 C、 D、8. 下列事实能用勒夏特列原理解释的是( )A、500℃左右高温比室温下更利于合成氨 B、工业制硫酸中SO2氧化为SO3 , 往往需要使用催化剂 C、H2、I2、HI平衡混合气体加压后颜色加深 D、工业制取金属钾Na(l)+KCl(l)NaCl(l)+K(g),使K变成蒸气从混合体系中分离9. 下列各组离子,一定能在溶液中大量共存的是( )A、使甲基橙变红的溶液:、、、 B、溶液中:、、、 C、的溶液:、、、 D、水电离的的溶液中:、、、10. 对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )A、的溶液中: B、的溶液中: C、的氨水中: D、在溶液中:11. 铅酸蓄电池是典型的可充电电池,电池总反应式为 , 工作原理如图所示,下列说法正确的是( )
A、 B、 C、 D、8. 下列事实能用勒夏特列原理解释的是( )A、500℃左右高温比室温下更利于合成氨 B、工业制硫酸中SO2氧化为SO3 , 往往需要使用催化剂 C、H2、I2、HI平衡混合气体加压后颜色加深 D、工业制取金属钾Na(l)+KCl(l)NaCl(l)+K(g),使K变成蒸气从混合体系中分离9. 下列各组离子,一定能在溶液中大量共存的是( )A、使甲基橙变红的溶液:、、、 B、溶液中:、、、 C、的溶液:、、、 D、水电离的的溶液中:、、、10. 对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )A、的溶液中: B、的溶液中: C、的氨水中: D、在溶液中:11. 铅酸蓄电池是典型的可充电电池,电池总反应式为 , 工作原理如图所示,下列说法正确的是( ) A、放电时,负极反应为: B、放电时,移向X极 C、充电时,Y极连接电源正极 D、充电时,Y极的电极反应为:12. 关于下列电化学装置的说法正确的是( )
A、放电时,负极反应为: B、放电时,移向X极 C、充电时,Y极连接电源正极 D、充电时,Y极的电极反应为:12. 关于下列电化学装置的说法正确的是( )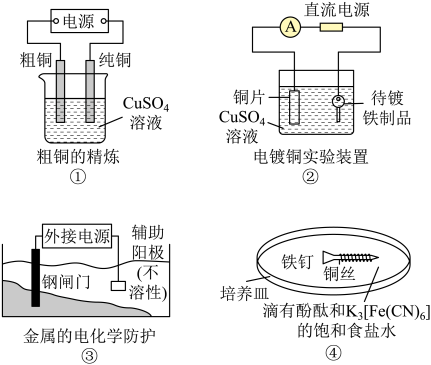 A、装置①的粗铜应与电源正极相连,精炼过程中两极质量的改变量相等 B、装置②的待镀铁制品应与电源正极相连,电镀过程中溶液的浓度保持不变 C、装置的钢闸门应与电源负极相连,属于“牺牲阳极的阴极保护法” D、装置④中靠近铜丝处出现红色,靠近裸露在外的铁钉处出现蓝色13. 室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )A、溶液中导电粒子的数目减少 B、再加入10mLpH=11的NaOH溶液,混合液pH=7 C、醋酸的电离程度增大,c(H+)亦增大 D、溶液中不变14. 某温度下,体积和pH都相同的NaOH溶液与CH3COONa溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
A、装置①的粗铜应与电源正极相连,精炼过程中两极质量的改变量相等 B、装置②的待镀铁制品应与电源正极相连,电镀过程中溶液的浓度保持不变 C、装置的钢闸门应与电源负极相连,属于“牺牲阳极的阴极保护法” D、装置④中靠近铜丝处出现红色,靠近裸露在外的铁钉处出现蓝色13. 室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )A、溶液中导电粒子的数目减少 B、再加入10mLpH=11的NaOH溶液,混合液pH=7 C、醋酸的电离程度增大,c(H+)亦增大 D、溶液中不变14. 某温度下,体积和pH都相同的NaOH溶液与CH3COONa溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )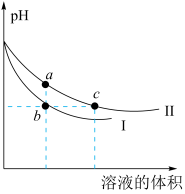 A、c点的溶液中c(OH−)+c(CH3COOH)=c(H+) B、a、b两点溶液的导电性:a>b C、b、c两点溶液中水的电离程度:b=c D、用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
A、c点的溶液中c(OH−)+c(CH3COOH)=c(H+) B、a、b两点溶液的导电性:a>b C、b、c两点溶液中水的电离程度:b=c D、用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc二、非选择题(本题共4小题,共58分。)
-
15. 、、、、是原子序数依次增大的五种短周期元素,其元素性质或原子结构如表。
元素
元素性质或原子结构
原子核外能级上的电子总数与能级上的电子总数相等,但第一电离能低于同周期相邻元素
在同周期元素中,原子半径最大
电离能()数据:;;;……
其价电子中,在不同形状的原子轨道中运动的电子数相等
只有一个不成对电子
(1)、的元素符号为、的基态原子价层电子轨道表示式为。(2)、元素处于元素周期表中的区(填“”或“”),其基态原子核外电子排布式为。(3)、的元素符号为 , 元素的第一电离能同周期相邻元素(填“高于”、“低于”或“等于”)。(4)、、和元素的电负性由大到小的顺序是(填元素符号)。(5)、、的最高价氧化物的水化物酸性更强的是(填化学式)。(6)、、和可以形成多种化合物,其中在室温下水溶液且的化合价为+1价的化合物是(填化学式)。16. 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中为离子交换膜。请按要求回答相关问题: (1)、甲烷燃料电池负极反应式是。(2)、电极的电极反应式为。(3)、应使用离子交换膜(填“阴”或“阳”)。(4)、写出图中电解饱和食盐水反应的离子方程式。(5)、若用装置丙模拟粗铜的精炼,则溶液中的铜离子应移向(填“”或“”)极,反应结束后硫酸铜溶液的浓度(填“变大”、“变小”或“不变”)。(6)、若在标准状况下,有氧气参加反应,则乙装置中铁电极上生成的气体体积为。17. 纯碱是一种重要的无机化工原料,广泛用于生活洗涤、酸类中和以及食品加工等。某纯碱样品中含有少量易溶性杂质(不与盐酸反应),现用滴定法测定该纯碱样品的纯度。其操作为准确称量1.5g样品,配成250mL待测液,每次取出待测液25mL,以甲基橙作指示剂,用0.1000mol/L的盐酸标准液进行滴定。(1)、配制待测液所需的玻璃仪器主要有玻璃棒、烧杯、、。(2)、可用(填“a”或“b”)量取待测液。向滴定管中注入待测液的前一步操作为。
(1)、甲烷燃料电池负极反应式是。(2)、电极的电极反应式为。(3)、应使用离子交换膜(填“阴”或“阳”)。(4)、写出图中电解饱和食盐水反应的离子方程式。(5)、若用装置丙模拟粗铜的精炼,则溶液中的铜离子应移向(填“”或“”)极,反应结束后硫酸铜溶液的浓度(填“变大”、“变小”或“不变”)。(6)、若在标准状况下,有氧气参加反应,则乙装置中铁电极上生成的气体体积为。17. 纯碱是一种重要的无机化工原料,广泛用于生活洗涤、酸类中和以及食品加工等。某纯碱样品中含有少量易溶性杂质(不与盐酸反应),现用滴定法测定该纯碱样品的纯度。其操作为准确称量1.5g样品,配成250mL待测液,每次取出待测液25mL,以甲基橙作指示剂,用0.1000mol/L的盐酸标准液进行滴定。(1)、配制待测液所需的玻璃仪器主要有玻璃棒、烧杯、、。(2)、可用(填“a”或“b”)量取待测液。向滴定管中注入待测液的前一步操作为。 (3)、滴定过程中眼睛应观察 , 若用酚酞作指示剂,则达到滴定终点时的标志是。(4)、实验记录的数据如下表:
(3)、滴定过程中眼睛应观察 , 若用酚酞作指示剂,则达到滴定终点时的标志是。(4)、实验记录的数据如下表:实验次数
第一次
第二次
第三次
消耗盐酸溶液体积/mL
27.00
27.02
26.98
经计算,该纯碱样品的纯度为。
(5)、下列实验操作会使样品纯度偏大的是____(填标号)。A、滴定过程中锥形瓶内有溶液溅出 B、注入待测液前锥形瓶未干燥 C、滴定前平视读数,滴定后俯视读数 D、滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失18. 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)、若某反应的平衡常数表达式为K= , 请写出此反应的热化学方程式:;下列措施能够增大此反应中NO的转化率的是(填字母代号)。a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)、向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。物质的量/mol
T1/℃
T2/℃
0
5 min
10 min
15 min
20 min
15 min
30 min
NO
2.0
1.16
0.80
0.80
0.50
0.40
0.40
N2
0
0.42
0.60
0.60
0.75
0.80
0.80
①T1℃,0~5min内,以CO2表示的该反应速率v(CO2)= , 该条件下的平衡常数K=。
②第15 min后,温度调整到T2 , 数据变化如上表所示,则T1 T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=。