四川省宜宾市叙州区2023-2024学年高一上学期期末考试化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题(本题共14个小题,每小题只有一个选项符合题意,每小题3分,共42分)
-
1. 根据物质的组成对物质进行分类,下列物质属于碱性氧化物的是( )A、 B、 C、 D、HClO2. 化学上把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物叫做分散系。分散系按分散质粒子直径分类如图:
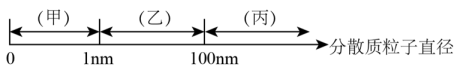
下列说法正确的是( )
A、澄清石灰水分类属于乙,澄清石灰水变浑浊后分类属于丙 B、云、雾、有色玻璃的分散质粒子直径范围在乙 C、甲、乙、丙的本质区别是能够发生丁达尔效应 D、向氢氧化钠溶液中缓慢滴加足量的氯化铁饱和溶液可制得氢氧化铁胶体3. 下列水溶液中的电离方程式正确的是( )A、 B、 C、 D、4. 下列有关钠的叙述中,错误的是( )A、钠燃烧时发出黄色火焰,钠应保存在石蜡油或煤油中 B、钠的活泼性强于铜,因此钠可从溶液中置换出铜 C、在坩埚中加热钠,可观察到钠先融化,之后发出黄色火焰,生成淡黄色固体 D、钠的化学性质非常活泼,钠元素在自然界中只以化合态存在5. 下列有关钠及其化合物的性质与用途具有对应关系的是( )A、NaHCO3 受热易分解,可用于制膨松剂 B、Na2O2呈淡黄色,可用于消防员呼吸面具中的供氧剂 C、氢氧化钠具有强碱性,可用作干燥剂 D、碳酸钠显碱性,可以用于制抗酸药物6. 工业上高温炼铁的反应原理为: , 下列说法正确的是( )A、该反应是置换反应 B、Fe是还原剂 C、CO2是还原产物 D、CO是还原剂7. 钠、氯元素及其化合物十分重要。海水中蕴含着丰富的氯元素,主要以氯化钠、氯化镁等氯化物形式存在。人们通过物理方法和化学方法可以制得多种钠、氯化工产品,这些产品广泛地应用于生产生活中。下列有关Na2CO3和NaHCO3叙述错误的是( )A、热稳定性:Na2CO3>NaHCO3 B、澄清石灰水可用来鉴别Na2CO3和NaHCO3 C、在一定条件下,Na2CO3和NaHCO3之间可以相互转化 D、等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,放出的CO2的质量一样多8. 下列离子方程式书写正确的是( )A、通入水中: B、过量的与澄清石灰水反应: C、溶液和溶液反应: D、钠与水反应:9. 下列对于“摩尔”的理解正确的是( )A、摩尔是国际科学界建议采用的一种物理量 B、摩尔可以把物质的宏观数量与微观粒子的数量联系起来 C、摩尔是物质的量的单位,简称摩,符号为mol D、国际上规定0.012kg碳中所含有的碳原子数目约为6.02×102310. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、和反应生成时转移电子数为0.4NA B、和混合物中所含的离子总数为0.3NA C、常温常压下,和混合气体中含有的碳原子数目为0.5NA D、足量的与的浓盐酸充分反应可制得氯气的分子数为0.3NA11. 下列关于原子结构及微粒间的数量关系的说法正确的是( )A、同种元素的原子均有相同的质子数和中子数 B、微粒Na+、Mg2+、O2-具有相同的电子层结构 C、某元素原子的最外层只有2个电子,则该元素一定是金属元素 D、Ca2+的质子数比核外电子数少212. 为了验证与能够相互转化,按下表操作进行实验:操作顺序
对应现象
①向溶液中加入过量铁粉
②滴加溶液
③再滴加几滴氯水
①溶液由黄色变为浅绿色
②溶液无明显变化
③溶液变红
下列分析中不合理的是( )
A、解释现象①的反应为 B、操作②可说明操作①后的溶液中无 C、溶液变红涉及的反应有 D、比较氧化性:13. 短周期元素X、Y、Z、W、E的原子序数依次增大,由它们组成的一种医用试剂的结构式如图所示。X的原子核内有1个质子,E的原子比W的原子多8个电子。下列说法错误的是( )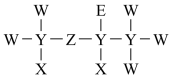 A、原子半径: B、非金属性: C、X、Y、Z三种元素可以形成二元酸,不能形成一元酸 D、X与Z和E均能形成含有18个电子的分子14. 铁、铜混合粉末18g加入到溶液中,充分反应后,剩余固体的质量为2.8g。若反应前后溶液体积不变,下列说法正确的是( )A、反应后溶液中 B、原固体混合物中Cu的质量是9.6g C、反应后溶液中 D、反应后溶液中
A、原子半径: B、非金属性: C、X、Y、Z三种元素可以形成二元酸,不能形成一元酸 D、X与Z和E均能形成含有18个电子的分子14. 铁、铜混合粉末18g加入到溶液中,充分反应后,剩余固体的质量为2.8g。若反应前后溶液体积不变,下列说法正确的是( )A、反应后溶液中 B、原固体混合物中Cu的质量是9.6g C、反应后溶液中 D、反应后溶液中二、非选择题(本题包括15~19题,共5题)
-
15. 下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。针对表中①~⑩号元素回答下列问题。
 (1)、①元素的名称是 , ⑨元素的原子结构示意图为。(2)、②、③、④、⑤、⑥五种元素中,原子半径由小到大的顺序是(填元素符号);这五种元素分别形成的简单离子中离子半径最小的是(填离子符号)。(3)、镓(Ga)与⑥同主族,其氢氧化物为两性氢氧化物,请写出氢氧化镓与NaOH反应的化学方程式。(4)、元素①和⑧的单质化合形成的化合物KH中H元素的化合价为;KH能与水反应生成氢气,在反应后的溶液中滴入酚酞,溶液变红,反应的化学方程式为。(5)、表中元素⑦和⑩的最高价氧化物对应水化物的酸性最强的是(填化学式)。(6)、元素④和⑥相比,金属性较强的是(填元素符号),下列能证明这一事实的有(填序号)。
(1)、①元素的名称是 , ⑨元素的原子结构示意图为。(2)、②、③、④、⑤、⑥五种元素中,原子半径由小到大的顺序是(填元素符号);这五种元素分别形成的简单离子中离子半径最小的是(填离子符号)。(3)、镓(Ga)与⑥同主族,其氢氧化物为两性氢氧化物,请写出氢氧化镓与NaOH反应的化学方程式。(4)、元素①和⑧的单质化合形成的化合物KH中H元素的化合价为;KH能与水反应生成氢气,在反应后的溶液中滴入酚酞,溶液变红,反应的化学方程式为。(5)、表中元素⑦和⑩的最高价氧化物对应水化物的酸性最强的是(填化学式)。(6)、元素④和⑥相比,金属性较强的是(填元素符号),下列能证明这一事实的有(填序号)。A.在化合物中④的化合价比⑥的低
B.④的单质能与冷水剧烈反应而⑥的单质不能
C.④的最高价氧化物对应水化物的碱性比⑥强
D.④单质的熔点比⑥单质的低
16. 高铁酸钾()具有强氧化性,是一种环保、高效、多功能的水处理剂,实验室用含少量杂质的铁屑原料,经过如下流程制备少量。 (1)、中铁元素的化合价是。(2)、往原料中添加过量KOH所发生反应的离子方程式为。(3)、检验“预氧化”环节是否已经实现要求的方法是。(4)、“制备”的反应中,还原剂和氧化剂的物质的量之比为。(5)、“熔融法”是最早发现+6价高铁酸盐的方法,该法制备高铁酸盐的原理如下:
(1)、中铁元素的化合价是。(2)、往原料中添加过量KOH所发生反应的离子方程式为。(3)、检验“预氧化”环节是否已经实现要求的方法是。(4)、“制备”的反应中,还原剂和氧化剂的物质的量之比为。(5)、“熔融法”是最早发现+6价高铁酸盐的方法,该法制备高铁酸盐的原理如下:若反应中被氧化的与被还原的之物质的量比为1∶4,请写出该反应配平后的方程式:。此时,若反应产生11.2L(标准状况) , 则转移的电子为mol。
17. 实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。氯气和氢氧化钙在温度较高时会生成副产物氯酸钙,甲、乙、丙三位同学分别设计了三个实验装置如下图所示: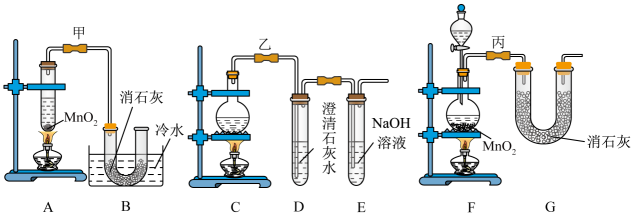 (1)、请写出实验室使用浓盐酸、二氧化锰共热制氯气的离子方程式:。(2)、哪位同学的装置能够有效地防止副反应的发生?。(3)、请写出氯气和氢氧化钙制备漂白粉的化学方程式:。(4)、上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)。(5)、实验中若用12mol·L-1的浓盐酸200mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3mol,其可能的主要原因是(假定各步反应均无反应损耗且无副反应发生)。18. 已知A是一种常见金属,B的俗称为磁性氧化铁,C溶液呈浅绿色。试根据图中转化关系,回答下列问题。
(1)、请写出实验室使用浓盐酸、二氧化锰共热制氯气的离子方程式:。(2)、哪位同学的装置能够有效地防止副反应的发生?。(3)、请写出氯气和氢氧化钙制备漂白粉的化学方程式:。(4)、上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)。(5)、实验中若用12mol·L-1的浓盐酸200mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3mol,其可能的主要原因是(假定各步反应均无反应损耗且无副反应发生)。18. 已知A是一种常见金属,B的俗称为磁性氧化铁,C溶液呈浅绿色。试根据图中转化关系,回答下列问题。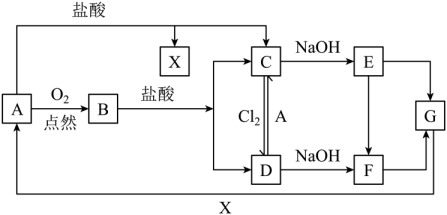 (1)、写出B和G的化学式:B、G;(2)、检验D中少量阳离子的最佳试剂的化学式是;(3)、实验室在长期保存C溶液的过程中会加入少量;(4)、写出下列转化的化学方程式:
(1)、写出B和G的化学式:B、G;(2)、检验D中少量阳离子的最佳试剂的化学式是;(3)、实验室在长期保存C溶液的过程中会加入少量;(4)、写出下列转化的化学方程式:① D→C ;
② C→D ;
(5)、E在空气中放置容易转化为F,产生的现象为。19.(1)、按要求写出下列反应的方程式。①醋酸电离方程式:。
②一水合氨电离方程式:。
③碳酸氢钠与氢氧化钠反应离子方程式:。
(2)、在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如下图所示,回答下列问题:
①该混合液中,NaCl的物质的量为mol,含溶质MgCl2的质量为g。
②该混合液中CaCl2的物质的量为mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为mol·L-1。