重庆市乌江新高考协作体2023-2024学年高二上学期1月期末学业质量联合调研抽测化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、单选题
-
1. 常温下,某地土壤的pH约为8,则土壤中的c(OH-)最接近于多少mol/L( )A、1×10-5 B、1×10-6 C、1×10-8 D、1×10-92. 在测定中和热的实验中,下列说法正确的是( )A、在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、温度计、玻璃棒 B、完成一次中和反应反应热测定实验,温度计需要使用2次,分别用于测混合液的初始温度和反应最高温度 C、用50mL0.55mol/L的NaOH溶液与60mL0.50mol/L的盐酸反应,测得的中和热数值偏大 D、使用环形玻璃搅拌棒是为了使反应物充分混合减小实验误差3. 下列说法中正确的是( )A、用过滤方法提纯胶体 B、1molCH4和2molO2完全反应放出的热量就是CH4的燃烧热 C、1molO2在任何反应中完全反应时,都将得到4mole- D、NaClO溶液呈碱性的原因是:ClO-+H2O
 HClO+OH-
4. 下列说法正确的是( )A、在25℃、101 kPa,1 mol CH4(g)和2 mol CH4(g)的燃烧热相等 B、1 mol浓硫酸与1 mol NaOH溶液完全中和所放出的热量为中和热 C、工业合成氨的反应中加入催化剂可增大反应速率,同时提高反应物的平衡转化率 D、△H越大,说明反应热量变化越大5. 肌肉中大量肌红蛋白Mb可以结合O2形成MbO2维持人体的生理活动,发生反应:Mb(aq)+O2(g)MbO2(aq) ΔH,该过程可自发进行。温度为T时,平衡常数K= =2.0 kPa-1(气体分压=气体总压体积分数),下列说法中不正确的是( )A、ΔH<0 B、提高p(O2),K值变大 C、提高氧气浓度,有利于Mb(aq)的转化 D、当n(MbO2)/n(Mb)=4.0时,吸入的空气中p(O2)=21 kPa,该反应正向进行6. 下列热化学方程式中,△H能正确表示物质的燃烧热的是( )A、S(s)+O2(g)=SO2(g) △H B、C(s)+O2(g)=CO(g) △H C、H2(g)+O2(g)=H2O(g) △H D、2H2(g)+O2(g)=2H2O(g) △H7. 下列说法中正确的是( )A、FeCl3溶液和Fe2(SO4)3溶液分别加热、蒸发、浓缩结晶、灼烧,所得固体的成分相同 B、实验室配制FeCl3溶液时,先将FeCl3溶于水,再加入少量的盐酸 C、向MgCl2溶液中加入MgO调节pH,可除去溶液中混有的Fe3+ D、室温下pH相同、体积相同的醋酸和盐酸两种溶液加水稀释相同的倍数后,两溶液的pH:醋酸>盐酸8. 下列实验操作、实验现象和所得结论描述正确的是( )
HClO+OH-
4. 下列说法正确的是( )A、在25℃、101 kPa,1 mol CH4(g)和2 mol CH4(g)的燃烧热相等 B、1 mol浓硫酸与1 mol NaOH溶液完全中和所放出的热量为中和热 C、工业合成氨的反应中加入催化剂可增大反应速率,同时提高反应物的平衡转化率 D、△H越大,说明反应热量变化越大5. 肌肉中大量肌红蛋白Mb可以结合O2形成MbO2维持人体的生理活动,发生反应:Mb(aq)+O2(g)MbO2(aq) ΔH,该过程可自发进行。温度为T时,平衡常数K= =2.0 kPa-1(气体分压=气体总压体积分数),下列说法中不正确的是( )A、ΔH<0 B、提高p(O2),K值变大 C、提高氧气浓度,有利于Mb(aq)的转化 D、当n(MbO2)/n(Mb)=4.0时,吸入的空气中p(O2)=21 kPa,该反应正向进行6. 下列热化学方程式中,△H能正确表示物质的燃烧热的是( )A、S(s)+O2(g)=SO2(g) △H B、C(s)+O2(g)=CO(g) △H C、H2(g)+O2(g)=H2O(g) △H D、2H2(g)+O2(g)=2H2O(g) △H7. 下列说法中正确的是( )A、FeCl3溶液和Fe2(SO4)3溶液分别加热、蒸发、浓缩结晶、灼烧,所得固体的成分相同 B、实验室配制FeCl3溶液时,先将FeCl3溶于水,再加入少量的盐酸 C、向MgCl2溶液中加入MgO调节pH,可除去溶液中混有的Fe3+ D、室温下pH相同、体积相同的醋酸和盐酸两种溶液加水稀释相同的倍数后,两溶液的pH:醋酸>盐酸8. 下列实验操作、实验现象和所得结论描述正确的是( )选项
实验操作和现象
结论
A
向盛有饱和Na2S2O3溶液的试管中滴加稀盐酸,溶液变浑浊且有气体生成
说明生成了S和H2S
B
向氨水中滴加少量AgNO3溶液,无沉淀生成
Ag+与NH3·H2O能大量共存
C
常温下,测得0.1 mol/LNaA溶液的pH大于0.1 mol/L Na2CO3溶液的pH
酸性:HA<H2CO3
D
向CuS的悬浊液中加入饱和MnSO4溶液可生成浅红色沉淀(MnS为浅红色)
说明Ksp(MnS) < Ksp(CuS)
A、A B、B C、C D、D9. 我国科学家首次探索的碱性锌-空气电池放电时的工作原理如图所示。下列叙述错误的是( )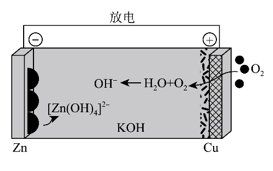 A、放电时,KOH溶液的浓度增大 B、放电时,负极的电极反应式为 C、充电时,铜极与直流电源的正极连接 D、充电时,当阴极质量净增26g时,理论上转移0.8mol电子10. 若NA表示阿伏加 德罗常数的值,下列叙述正确的是( )
A、放电时,KOH溶液的浓度增大 B、放电时,负极的电极反应式为 C、充电时,铜极与直流电源的正极连接 D、充电时,当阴极质量净增26g时,理论上转移0.8mol电子10. 若NA表示阿伏加 德罗常数的值,下列叙述正确的是( )①标准状况下,2.24 L四氯化碳含碳原子数为0.1NA
②标准状况下,a L的氧气和氮气的混合物含有的分子数为NA
③电解精炼铜时,若阴极得到电子数为2NA , 则阳极质量减少64 g
④7 g CnH2n中含有的氢原子数为2NA
⑤常温下,7.1 g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA
⑥1 L 2 mol·L-1的FeCl3溶液中含Fe3+数为2NA
⑦2 L 1 mol·L-1的盐酸中所含氯化氢分子数为2NA
A、①④ B、②⑥ C、③④⑤ D、②⑤11. 下列有关实验及其分析叙述正确的是( )A、向2.0mL浓度均为0.1mol⋅L-l的KCl、KI混合溶液中滴加1~2滴0.01mol/LAgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大 B、在稀硫酸中加入铜粉,铜粉不溶解;再加入适量的H2O2 , 铜粉仍不溶解 C、向AlCl3溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀不消失 D、将CO2通入Ba(NO3)2溶液中至饱和,无沉淀产生;再通入SO2 , 也无沉淀产生12. 已知: pH=-lgc(H+), pOH=-lgc(OH-)。 常温下,向某浓度的盐酸溶液中滴加氢氧化钠溶液,所得溶液pOH和pH变化如图所示。 下列说法正确的是( )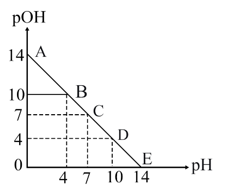 A、盐酸与NaOH溶液的浓度相等 B、B点和D点水的电离程度相同 C、滴加NaOH溶液改为滴加氨水溶液,该图曲线不变 D、升高温度,滴定过程中pOH+pH>1413. 溶液A中可能含有K+、Na+、Fe3+、Al3+、、、Cl-、中的若干种,且各离子浓度均相同,某同学设计并完成如下实验。
A、盐酸与NaOH溶液的浓度相等 B、B点和D点水的电离程度相同 C、滴加NaOH溶液改为滴加氨水溶液,该图曲线不变 D、升高温度,滴定过程中pOH+pH>1413. 溶液A中可能含有K+、Na+、Fe3+、Al3+、、、Cl-、中的若干种,且各离子浓度均相同,某同学设计并完成如下实验。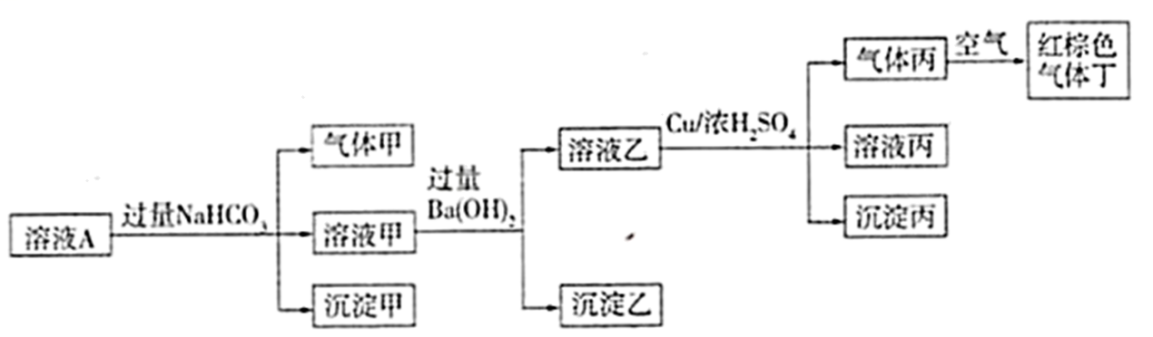
根据以上的实验操作与现象,下列有关说法不正确的是( )
A、Fe3+和Al3+不能同时存在 B、要确定溶液A中是否存在Na+或K+中的一种,只能通过焰色反应 C、沉淀乙中一定含有BaCO3和BaSO4 D、溶液A可能是由AlCl3、NaNO3、Al2(SO4)3按物质的量之比为1:3:1混合而成的溶液14. 已知H2C2O4是一种二元弱酸。室温下,通过下列实验探究NaHC2O4溶液的性质。实验
实验操作和现象
1
测得10mL0.1mol·L-1NaHC2O4溶液的pH约为5.5
2
向酸性KMnO4溶液中滴加过量0.1mol·L-1NaHC2O4溶液,溶液紫红色褪色
3
向0.1mol·L-1NaHC2O4溶液中加入等体积0.1mol·L-1Ba(OH)2溶液,溶液变浑浊
4
向10mL0.1mol·L-1NaHC2O4溶液中滴加少量0.1mol·L-1NaOH溶液,无明显现象
下列说法正确的是( )
A、依据实验1推测:Kw<Ka1(H2C2O4)×Ka2(H2C2O4) B、实验2说明:NaHC2O4溶液具有漂白性 C、依据实验3推测:Ksp(BaC2O4)>2.5×10-3 D、实验4反应后的溶液中存在:c(Na+)=c(H2C2O4)+c(HC2O)+(C2O)二、非选择题
-
15. 某废合金的主要成分为Sn、Cu、Pb、Fe,一种综合回收的工艺流程如图所示:
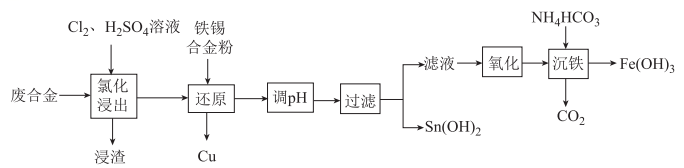
已知:常温下, , , 。
回答下列问题:
(1)、“氯化浸出”浸出液中金属阳离子主要有、、;浸渣的主要成分为(填化学式)。“氯化没出”时温度不宜过高或过低的原因是。(2)、写出“还原”中Fe与反应的化学方程式:。(3)、常温下,为使完全沉淀,“调pH”时应使溶液pH不低于(结果保留1位小数)。(4)、“氧化”时为检验是否已被充分氧化,可取样滴加(填化学式)溶液。(5)、写出“沉铁”时发生反应的离子反应方程式:。(6)、受热后可制得物质A,写出物质A的一种用途:。16.(1)、已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/molC(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:(填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=kJ/mol。(2)、在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:①5秒内,v(NO2)=mol/(L·s);
②若将该容器置于冰水中,气体颜色将(填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=。
(3)、NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:HSO3-⇌H++SO32- Ka2
HSO3-+H2O⇌H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2 , 则0.1 mol/L NaHSO3溶液:
①溶液呈(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)c(HSO3-)(填“>”“<”或“=”)。
(4)、将除锈后的铁钉用饱和食盐水浸泡一下,放入右图所示的具支试管中。①几分钟后,可观察到导管中的水柱;
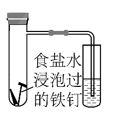
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为。
17. 科学家模拟光合作用,利用太阳能制备甲烷和异丙醇等燃料。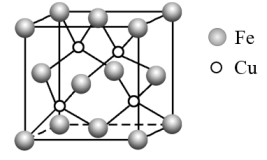 (1)、利用一种新型高效二元铜铁催化剂,在光照条件下,将、转化为。
(1)、利用一种新型高效二元铜铁催化剂,在光照条件下,将、转化为。①目前测定晶体结构可靠的科学方法是。一种铜铁催化剂的晶胞如图所示,基态原子的电子排布式为 , 该晶胞中与一个原子相紧邻的原子有个。
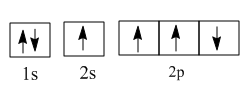
②在光照和铜铁催化剂条件下,基态碳原子吸收能量变为激发态原子。下列3种不同状态的碳原子轨道表示式中,能量状态最高的是(填字母)。
a.

b.
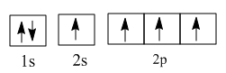
c.
 (2)、某光电催化反应器如图所示,利用电化学原理模拟光合作用由制异丙醇。
(2)、某光电催化反应器如图所示,利用电化学原理模拟光合作用由制异丙醇。
①已知Ti元素的电负性为1.5,O元素的电负性为3.5,则、O原子之间通过键形成稳定的化合物。
②电极表面生成异丙醇的电极反应式为 , 此电极反应需选用高活性和高选择性的电化学催化剂,其目的是。
18. 为探究锌和FeCl3溶液的反应,室温下某小组同学进行了如下实验。(1)、配置1000mL 1mol/L的FeCl3溶液,pH约为0.70,即c(H+)=0.2mol·L−1。①从反应条件考虑,影响FeCl3水解平衡的因素有(答两点)。
②取10mL 1mol/L的FeCl3溶液加水稀释,盐的水解程度(填“增大”、“减小”或“不变”)。
(2)、小组同学利用上述FeCl3溶液探究其与锌粉的反应。向500mL FeCl3溶液中加入65g锌粉,实现现象记录如下:
i.实验前期,溶液的pH逐渐增大,锌粉表面未发现气泡;
ⅱ.随着反应的进行,观察到瓶底产生红褐色沉淀,同时出现少量气泡;
ⅲ.15分钟后溶液中产生大量气泡;
ⅳ.……
①经实验确认“实验前期”溶液中有Fe2+生成,确认有Fe2+的实验操作和现象是 , 结合平衡移动原理解释:实验前期溶液pH增大的原因。
②查阅资料发现:Fe(OH)3常温下的溶度积常数为2.810-39 , 请写出Fe(OH)3的沉淀溶解平衡表达式 , 试从Ksp-Q关系角度结合具体数值分析反应开始c(H+)=0.2mol·L−1时,没有出现红褐色沉淀的原因。
③结合离子方程式解释反应过程中气泡变化的原因。
(3)、锌和FeCl3溶液反应后溶液中Cl-浓度的测定。用c mol·L-1AgNO3标准溶液滴定反应后溶液中的Cl- , 采用K2CrO4为指示剂,利用Ag+与CrO生成砖红色沉淀指示滴定终点,实现操作如下:
i.以醋酸纤维滤膜过滤掉水样中的悬浮物,调节水样pH在6.5~10.5;
ⅱ.取10.00mL水样,加入K2CrO4溶液作指示剂,用AgNO3标准溶液滴定至终点,消耗AgNO3溶液VmL。
①滴定时,AgNO3标准溶液应加到(填玻璃仪器名称)中。
②锌和FeCl3溶液反应后溶液中Cl-浓度为(用含c的代数式表示)mol·L-1
③已知:Cr2O(黄色)+H2O2H++2CrO(橙色),解释滴定时调节水样pH在6.5~10.5的原因。