重庆市缙云教育联盟2023-2024学年高一上学期1月期末质量检测化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题
-
1. 下列实验过程中不会出现颜色变化的是( )A、木炭粉与氧化铜共热 B、二氧化碳通入烧碱溶液 C、活性炭加入红墨水中 D、二氧化碳通入石蕊溶液2. 北京奥运会主场馆“鸟巢”堪称建筑上的一个奇迹,它的主要建筑材料是合金。下列物质中属于合金的是( )A、金 B、银 C、钢 D、铜3. 人类对原子结构的认识经历了漫长的历史阶段。其中最早提出“原子核外电子是在原子轨道上运动的,并遵循一定的规律。”的科学家是( )A、道尔顿 B、汤姆生 C、卢瑟福 D、玻尔4. 上海环保部门为了使城市生活垃圾得到合理利用,近年来逐步实现了生活垃圾分类投放的方法。其中塑料袋、废纸、旧橡胶制品等属于( )A、无机物 B、有机物 C、盐类 D、非金属单质5. 《本草纲目》中“石碱”条目下记载:“彼人采蒿蓼之属……晒干烧灰,以原水淋汁……久则凝淀如石……浣衣发面……”石碱的主要成分为。某同学按照如图所示流程制备少量石碱,下列说法错误的是( )
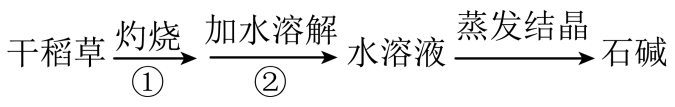 A、过程①涉及氧化还原反应 B、加水溶解时可适当加热,以增大的溶解度和溶解速率 C、的热稳定性很差,受热易分解生成 D、图示方法的不足之处有二氧化碳排放较多和原料来源受限制等6. 下列叙述不正确的是( )A、将与HCl混合气体通过饱和食盐水可得到纯净的 B、漂白粉可用于生活用水的消毒 C、液氯可以储存在钢瓶中 D、氯水可用于漂白纸张、织物等7. 下列反应的现象描述与离子方程式都正确的是( )A、锌片插入硝酸银溶液中,有银析出:Zn+Ag+=Zn2++Ag B、氢氧化钡溶液与稀硫酸反应,有白色沉淀生成: +Ba2+=BaSO4↓ C、氢氧化铜加到盐酸中,无明显现象:Cu(OH)2+2H+=Cu2++2H2O D、碳酸钡中加入稀盐酸,固体溶解,生成无色无味气体:BaCO3↓+2H+=Ba2++CO2↑+H2O8. 工业用溶液刻蚀电路板的废液中主要含有、、、 , 实验室从废液中回收某些物质的流程如下:
A、过程①涉及氧化还原反应 B、加水溶解时可适当加热,以增大的溶解度和溶解速率 C、的热稳定性很差,受热易分解生成 D、图示方法的不足之处有二氧化碳排放较多和原料来源受限制等6. 下列叙述不正确的是( )A、将与HCl混合气体通过饱和食盐水可得到纯净的 B、漂白粉可用于生活用水的消毒 C、液氯可以储存在钢瓶中 D、氯水可用于漂白纸张、织物等7. 下列反应的现象描述与离子方程式都正确的是( )A、锌片插入硝酸银溶液中,有银析出:Zn+Ag+=Zn2++Ag B、氢氧化钡溶液与稀硫酸反应,有白色沉淀生成: +Ba2+=BaSO4↓ C、氢氧化铜加到盐酸中,无明显现象:Cu(OH)2+2H+=Cu2++2H2O D、碳酸钡中加入稀盐酸,固体溶解,生成无色无味气体:BaCO3↓+2H+=Ba2++CO2↑+H2O8. 工业用溶液刻蚀电路板的废液中主要含有、、、 , 实验室从废液中回收某些物质的流程如下: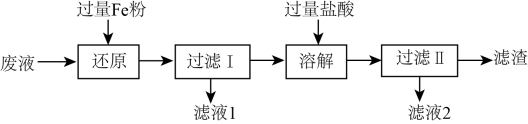
下列说法正确的是( )
A、还原过程中,溶液中可能存在的阳离子只有、、 B、溶解过程中反应的离子方程式: C、滤液1、滤液2合并后通入过量的重新获得溶液 D、滤渣的成分为Fe和Cu9. 用NA表示阿伏加 德罗常数的值,下列叙述正确的是( )A、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA B、用CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA C、Na2O2与H2O反应生成1.12LO2(标准状况),反应转移的电子数为0.2NA D、标准状况下,80gSO3中含3NA个氧原子,体积约为22.4L10. 将Na2O2投入FeCl2溶液中,可观察到的现象是 ( )A、生成白色沉淀及气泡 B、生成红褐色沉淀及气泡 C、仅有气泡产生 D、无变化11. 下列根据实验现象所得出的结论中,一定正确的是( )A、无色溶液加入盐酸酸化的BaCl2溶液产生白色沉淀,结论:溶液中含SO42- B、无色溶液焰色反应呈黄色,结论:溶液是钠盐溶液 C、无色溶液加入稀盐酸产生无色无味的气体,结论:溶液中含CO32- D、无色溶液中加入氢氧化钠溶液,加热产生的气体使湿润的红色石蕊试纸变蓝,结论:溶液中含NH4+12. 为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(气密性良好)。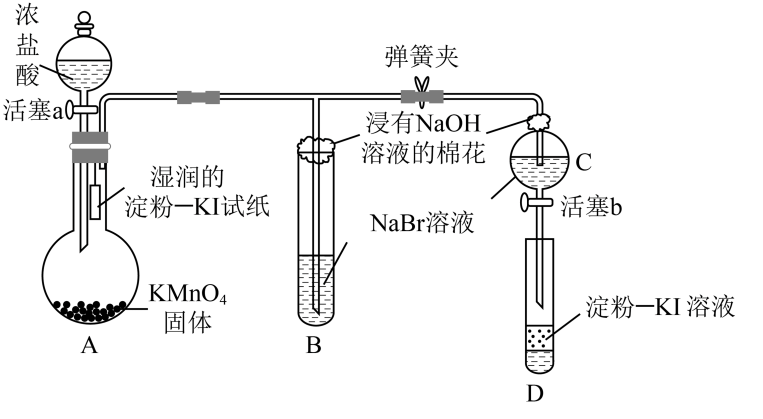
已知:浓盐酸与固体混合会产生。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.……
下列说法错误的是( )
A、A中湿润的淀粉-KI试纸变蓝,证明氯气的氧化性强于碘单质 B、B中溶液变黄色,证明氯气的氧化性强于溴单质 C、B中发生反应的离子方程式为 D、实验过程Ⅲ为关闭活塞a,打开活塞b,滴加溶液后充分振荡试管D,观察到D中溶液变蓝,即证明了溴单质的氧化性强于碘单质13. 下列各组反应,最终一定能得到白色沉淀的是( )A、向NaAlO2溶液中通入HCl气体 B、向Ba(OH)2溶液中通入过量CO2气体 C、向FeCl2溶液中加入过量NaOH溶液 D、向Al2(SO4)3溶液中加入过量NH3·H2O14. 某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-):Na+、NH、SO、CO、NO。取200 mL该溶液,分为等体积的两份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224 mL。实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33 g。下列说法正确的是 ( )A、该溶液中一定含有Na+ , 且c(Na+)≥0.1 mol·L-1 B、该溶液中可能含有Na+ C、该溶液中一定不含NO D、该溶液中肯定含有NH、SO、CO、NO二、非选择题
-
15. 某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如图:
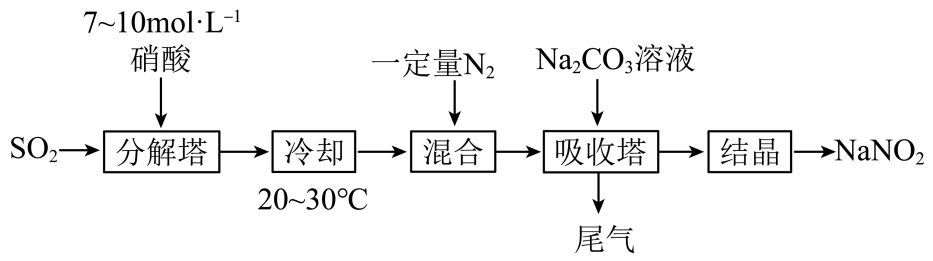
已知:Na2CO3+NO+NO2=2NaNO2+CO2
(1)、“分解塔”中SO2从塔底进入,硝酸从塔顶喷淋,其目的是。(2)、“分解塔”中的温度不宜过高,其原因是。(3)、按一定计量比在“分解塔”中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1:1,则“分解塔”中发生反应的化学方程式为。(4)、为提高氮氧化物的转化率,可向“尾气”中通入一定量的气体,再通入“吸收塔”中,实现循环吸收。(5)、“吸收塔”所得溶液中除含有NaNO2、NaNO3和少量Na2CO3外,还含有的溶质为(填化学式)。(6)、工业废气中NO2可用NaOH溶液吸收生成NaNO2和NaNO3 , 反应的离子方程式为。16. 氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3)。(1)、氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质的结构式为 , 二氯胺与水反应的化学方程式为。将0.01 mol NCl3通入100 mL 0.5 mol/L Na2SO3溶液中,转移电子的物质的量为mol。(2)、已知部分化学键的键能和化学反应的能量变化如下表和下图所示。化学键
N-H
N-Cl
H-Cl
键能
391.3
x
431.8

则反应过程中的△H2=kJ·mol-1 , 表中的x=。
(3)、在密闭容器中反应NH3(g)+Cl2(g)NH2Cl(g)+HCl(g)达到平衡,通过热力学定律计算,不同温度下理论上NH2Cl的体积分数随的变化如下图所示。
①a、b、c三点对应平衡常数的大小关系是(分别用Ka、Kb、Kc表示)。b点时,该反应的平衡常数为;
②T2℃,Q点对应的速率:(填“>”、“<”或“=”);
③在氨氯比一定时,提高NH3的转化率的方法是(任写1种);
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是。
17. 如图列出了①~⑩十种元素在周期表中的位置:族
周期
ⅠA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
3
⑤
⑥
⑦
⑧
⑨
4
⑩
请回答下列问题:
(1)、上述元素中,M层电子数最多的是(填元素名称),最高价氧化物对应的水化物酸性最强的是(填酸的化学式)。(2)、由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是(用离子符号表示)。(3)、由元素①和④形成的18电子的物质的电子式为;由元素⑥和⑨形成化合物乙,请用电子式表示物质乙的形成过程:。(4)、元素⑦的最高价氧化物对应的水化物与元素⑨的最简单氢化物的水溶液反应的离子方程式为。(5)、请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系:。(6)、下列可以比较⑤、⑥两元素金属性强弱的实验是___________(填字母)。A、比较这两种元素最高价氧化物对应的水化物的碱性 B、将⑤的单质投入到⑥的盐溶液中 C、将形状、大小相同的这两种元素的单质分别与等体积 的水反应 D、比较这两种元素的单质与酸反应时失电子的数目18. 实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题: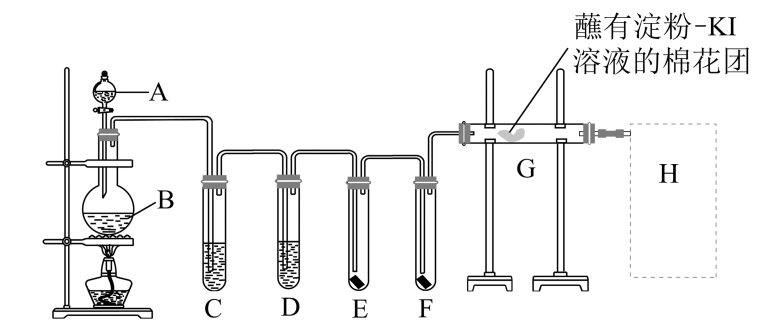 (1)、仪器A的名称是 , B中发生反应的离子方程式。(2)、D装置的作用是。(3)、E中为干燥的红色布条,F中为湿润的红色布条,可观察到的现象是 , 对比E和F中现象的差异可得出的结论是(4)、G处的现象是。(5)、H为尾气吸收装置,写出发生的化学方程式。
(1)、仪器A的名称是 , B中发生反应的离子方程式。(2)、D装置的作用是。(3)、E中为干燥的红色布条,F中为湿润的红色布条,可观察到的现象是 , 对比E和F中现象的差异可得出的结论是(4)、G处的现象是。(5)、H为尾气吸收装置,写出发生的化学方程式。