广东省深圳市龙岗区2023-2024学年高三上学期1月期末考试化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题(本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求。)
-
1. 调味料是烹饪食物的重要物质。下列调味料的主要成分属于无机物的是( )




A.白糖
B.食盐
C.辣椒
D.大蒜
A、A B、B C、C D、D2. “高质量发展是全面建设社会主义现代化国家的首要任务”。下列做法不符合“高质量发展”理念的是( )A、“火力发电”,将煤炭直接燃烧进行火力发电 B、“煤炭气化”,将固体煤转化为、等可燃气体 C、“二氧化碳合成淀粉”,将二氧化碳转化为淀粉 D、“变废为宝”,将农作物秸秆转化为基本化工原料3. 化学之美,对称之美。下列说法正确的是( )A、乙烯( )存在顺反异构体
B、对苯二甲酸(
)存在顺反异构体
B、对苯二甲酸( )属于芳香烃
C、雪花呈六角形,属于分子晶体
D、脱氧核糖核酸(DNA)分子中存在的化学键:共价键和氢键
4. 实验室制备氨气的原理为: , 下列说法正确的是( )A、的电子式
)属于芳香烃
C、雪花呈六角形,属于分子晶体
D、脱氧核糖核酸(DNA)分子中存在的化学键:共价键和氢键
4. 实验室制备氨气的原理为: , 下列说法正确的是( )A、的电子式 B、的原子结构示意图
B、的原子结构示意图 C、的VSEPR模型
C、的VSEPR模型 D、基态原子占据的最高能级原子轨道
D、基态原子占据的最高能级原子轨道 5. 化学使生活更美好。下列生产生活对应化学原理解释错误的是( )
5. 化学使生活更美好。下列生产生活对应化学原理解释错误的是( )选项
生产生活
化学原理
A
焊接金属时用溶液除锈
加热易分解
B
可用于治疗胃酸过多
能与酸反应
C
是常用的自来水消毒剂
具有强氧化性
D
酿制葡萄酒过程中添加适量二氧化硫
二氧化硫有还原性和杀菌作用
A、A B、B C、C D、D6. 3-吲哚乙酸(如图所示)是一种植物生长调节剂。下列有关于该化合物的说法错误的是( )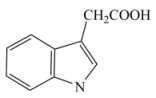 A、能发生加成反应 B、分子式为 C、能与乙醇反应生成酯类物质 D、既能与盐酸反应,又能与溶液反应7. 铁合金是用途最为广泛的合金材料。下列说法错误的是( )A、生铁比纯铁更容易生锈 B、海水呈弱碱性,轮船钢板在海水中易发生析氢腐蚀 C、钢闸门连接直流电源负极,是采用了外加电流保护法 D、人行道铁栏杆喷漆可以延缓钢铁腐蚀的速率8. 我国科学家以、及等物质为原料通过电催化法制备尿素(
A、能发生加成反应 B、分子式为 C、能与乙醇反应生成酯类物质 D、既能与盐酸反应,又能与溶液反应7. 铁合金是用途最为广泛的合金材料。下列说法错误的是( )A、生铁比纯铁更容易生锈 B、海水呈弱碱性,轮船钢板在海水中易发生析氢腐蚀 C、钢闸门连接直流电源负极,是采用了外加电流保护法 D、人行道铁栏杆喷漆可以延缓钢铁腐蚀的速率8. 我国科学家以、及等物质为原料通过电催化法制备尿素(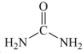 ),设为阿伏加德罗常数的值。下列说法正确的是( ) A、标准状况下,与混合气体的体积为 B、含有的电子数目为 C、尿素中所含有的键的数目为 D、体积为的的溶液中,数目为9. 关于氨气的制备、净化、收集、尾气处理操作正确的是( )
),设为阿伏加德罗常数的值。下列说法正确的是( ) A、标准状况下,与混合气体的体积为 B、含有的电子数目为 C、尿素中所含有的键的数目为 D、体积为的的溶液中,数目为9. 关于氨气的制备、净化、收集、尾气处理操作正确的是( )



A.制备
B.干燥
C.收集
D.尾气处理
A、A B、B C、C D、D10. 一种可完全生物降解的Zn-Mo原电池结构如图所示。电池使用过程中在Zn表面形成一层薄膜,下列说法正确的是( ) A、Mo作原电池负极 B、电子由经电解质流向Mo C、表面发生的电极反应: D、每消耗 , 理论上转移的电子数目为11. 部分含氮物质的类别与相应化合价的关系如图所示。下列推断不合理的是( )
A、Mo作原电池负极 B、电子由经电解质流向Mo C、表面发生的电极反应: D、每消耗 , 理论上转移的电子数目为11. 部分含氮物质的类别与相应化合价的关系如图所示。下列推断不合理的是( ) A、的转化属于氮的固定 B、既有氧化性又有还原性 C、实验室收集可用排水法 D、一定条件下,可以与反应可以得到12. 下列实验现象所涉及的离子方程式书写错误的是( )
A、的转化属于氮的固定 B、既有氧化性又有还原性 C、实验室收集可用排水法 D、一定条件下,可以与反应可以得到12. 下列实验现象所涉及的离子方程式书写错误的是( )选项
实验操作
离子方程式
A
将通入苯酚钠溶液中,出现浑浊

B
向草酸溶液中滴加几滴酸性溶液,溶液褪色
C
实验室电解饱和食盐水生成黄绿色气体
D
酚酞滴入醋酸钠溶液变为浅红色
A、A B、B C、C D、D13. 由短周期非金属主族元素组成的化合物可治疗心绞痛。E、M、X、Y原子序数依次增大,的一种核素常用于测定文物的年代,的基态原子最外层只有一种自旋方向的电子,元素原子的价层电子排布式是。下列说法错误的是( )A、第一电离能: B、元素的电负性: C、简单氢化物沸点: D、空间结构:和均为三角锥形14. 以下实验操作、现象以及对应的结论均正确的是( )选项
操作
现象
结论
A
向溶液中滴加几滴石蕊溶液
溶液不变色
不水解
B
向待测液中滴加溶液
生成蓝色沉淀
溶液中有
C
向溶液逐滴滴加过量氨水
先生成蓝色沉淀,然后沉淀溶解
为两性氢氧化物
D
向酸性溶液滴加几滴乙醇
溶液紫红色变浅
乙醇被还原生成乙酸
A、A B、B C、C D、D15. 某温度条件下,在某恒压容器中发生反应 , 部分反应物和生成物的物质的量随时间变化如图所示(曲线、)。下列说法正确的是( ) A、表示的物质的量随时间的变化 B、时刻反应速率: C、此反应的平衡常数 D、平衡后充入 , 再次达到平衡时物质的物质的量大于16. 我国科学家发现锂介导的氮还原法可实现电化学高效合成氨。下列说法正确的是( )
A、表示的物质的量随时间的变化 B、时刻反应速率: C、此反应的平衡常数 D、平衡后充入 , 再次达到平衡时物质的物质的量大于16. 我国科学家发现锂介导的氮还原法可实现电化学高效合成氨。下列说法正确的是( )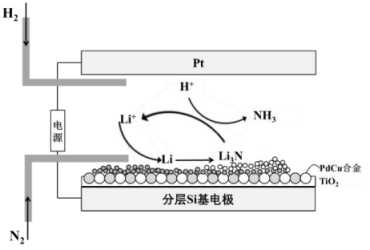 A、Pt电极连接电源负极 B、该电解池可以采用溶液做电解质 C、分层基电极附近发生的反应为: D、外电路转移电子时,理论上生成的体积为
A、Pt电极连接电源负极 B、该电解池可以采用溶液做电解质 C、分层基电极附近发生的反应为: D、外电路转移电子时,理论上生成的体积为二、非选择题
-
17. 某化学兴趣小组探究和的化学性质。(1)、
Ⅰ.实验准备:饱和氯水的制备
图中仪器的名称为。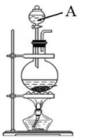 (2)、实验室使用右图装置制取氯气的化学方程式为:。(3)、实验室最适合用于处理多余氯气的是____(填字母)。A、溶液 B、溶液 C、溶液(4)、Ⅱ.实验探究
(2)、实验室使用右图装置制取氯气的化学方程式为:。(3)、实验室最适合用于处理多余氯气的是____(填字母)。A、溶液 B、溶液 C、溶液(4)、Ⅱ.实验探究①取溶液于试管中,滴加3滴溶液,溶液变红色;
②取溶液于试管中,先滴加3滴溶液,振荡,溶液无现象,再滴加3滴饱和氯水,溶液变黄色。
【发现问题】小组成员针对实验②中溶液未变红色,而呈现黄色的现象展开了探究。
【查阅文献】
i.能将氧化成 , 硫氰常温下为黄色液体,易挥发,可与水发生反应:;
ii. , 为无色配合物。
【提出猜想】猜想一 被氯水氧化成 , 使溶液呈黄色;
猜想二 加入氯水后部分被氧化为 , (红色),但由于存在反应: , 实验②生成的浓度比实验①的小,溶液在浓度较低时呈黄色。
【验证猜想】为验证猜想,小组成员设计了以下实验,请补充表格中的操作及现象
实验序号
实验操作
现象
实验结论
③
取少量实验①的溶液于试管中,
猜想二正确
④
取少量实验②的溶液于试管中,滴加3滴饱和溶液
溶液变浑浊
猜想一也正确
(5)、【提出质疑】甲同学提出,实验④并不能证明猜想一正确,理由是。(6)、【再次探究】小组成员进行进一步探究,请完成表格中的实验操作及现象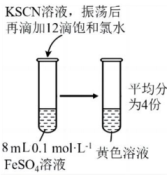
实验序号
实验操作
现象
⑤
滴加3滴蒸馏水
无明显现象
⑥
滴加3滴饱和氯水
无明显现象
⑦
溶液变橙红色
⑧
滴加3滴溶液
得出结论
i.由实验⑥的现象可以判断:猜想一不正确,
ii.结合实验⑤⑦⑧的现象可以判断:猜想二正确。
(7)、【得出结论】由实验结论可以判断:本实验条件下还原性强弱:(填“强于”“弱于”或“等于”)。18. 某钴土矿主要含有镍、钴、铁、铝、钙、硅等元素的氧化物,一种综合回收利用钴土矿的部分流程如下:
已知:①25℃时,相关金属离子形成氢氧化物沉淀的范围如下:
金属离子
开始沉淀的
6.3
1.8
3.4
6.9
7.1
沉淀完全的
8.3
3.2
4.7
8.9
9.1
②氧化前后,溶液中、元素的化合价均为+2价。
(1)、“酸浸”时,滤渣的主要成分为(填化学式)。(2)、“除铁、铝”时,应控制溶液范围为 , 使用溶液可将滤渣2中铁、铝元素分离,涉及化学方程式为。(3)、“沉钴”时,滤渣3的成分为亚硝酸钴钾 , 同时有无色气体(遇空气变为红棕色)生成,写出“沉钴”步骤的离子方程式。(4)、亚硝酸钴钾的中心离子的配位数为 , 配体中配位原子的杂化方式为。(5)、的一种氧化物是重要的化工原料。晶体为尖晶石结构,其晶胞结构如下图所示。已知晶胞边长为 , 设为阿伏加德罗常数的值,则该晶体中与的个数比为 , 晶体的密度为(列出计算式)。 19. 甲醛(是主要的室内环境污染物,同时又是重要的化工原料。(1)、Ⅰ.利用分光光度法测定室内含量
19. 甲醛(是主要的室内环境污染物,同时又是重要的化工原料。(1)、Ⅰ.利用分光光度法测定室内含量
测定原理:将痕量加入过量酸性溶液中,被还原为 , 再加入过量KI-淀粉溶液,溶液显蓝色。已知:溶液吸光度大小与溶液颜色深浅成正比。
①基态原子的核外电子排布式:。
②完成离子方程式:
(2)、测定方法:实验①:向一定量待测溶液中滴加过量酸性溶液,振荡后加入过量的淀粉-KI溶液。
实验②:用等体积去离子水代替实验①中的溶液,重复上述操作。
两组实验充分反应后,测得不同波长下吸光度 , 绘制吸收光谱曲线如下图所示。

①请你判断表现实验①中溶液吸光度的曲线为。
②根据上图曲线,选定在波长下,测定不同浓度溶液的吸光度 , 得到之间的关系为:。 , 某待测溶液的吸光度为0.182,则该溶液中含量为。
(3)、Ⅱ.甲醛的制备:甲醇脱氢法已知反应a:
反应b:
反应c:
反应d:
。
(4)、在一个恒容密闭容器中充入 , 在催化剂作用下发生反应a、d。在不同温度下连续反应后,测得甲醇的转化率、甲醛的选择性与温度的关系如下图所示。
①600℃时,体系中的物质的量为 , 平均反应速率。
②当温度高于650℃,甲醛的选择性下降的原因不可能是。
A.升高温度使催化剂活性降低 B.升高温度使反应逆向移动
C.温度升高反应速率加快 D.升高温度使反应正向移动
20. 利多卡因(vi)是常用的局部麻醉剂,其合成路线如图所示: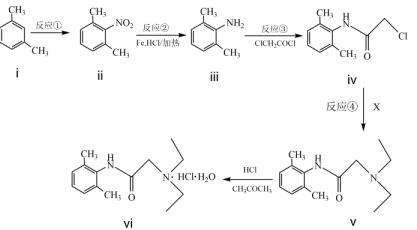 (1)、化合物i的名称为。(2)、反应②的反应类型为。(3)、化合物Y为iii的同分异构体,属于芳香族化合物且核磁共振氢谱中峰组数目与iii的相同,写出一种符合上述条件的的结构简式。(4)、的分子式为 , 有关化合物的说法正确的是____(填字母)。A、属于非极性分子 B、分子中含有手性碳原子 C、分子的核磁共振氢谱中有三组峰 D、反应④的过程中有的断裂(5)、根据化合物的结构特征,分析其可能具有的化学性质,完成下表。
(1)、化合物i的名称为。(2)、反应②的反应类型为。(3)、化合物Y为iii的同分异构体,属于芳香族化合物且核磁共振氢谱中峰组数目与iii的相同,写出一种符合上述条件的的结构简式。(4)、的分子式为 , 有关化合物的说法正确的是____(填字母)。A、属于非极性分子 B、分子中含有手性碳原子 C、分子的核磁共振氢谱中有三组峰 D、反应④的过程中有的断裂(5)、根据化合物的结构特征,分析其可能具有的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
a
加成反应
b
氧化反应(生成有机产物)
(6)、以苯胺(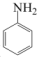 )为原料,利用反应③和④的原理,合成化合物
)为原料,利用反应③和④的原理,合成化合物 。
。已知
 。
。基于你设计的合成路线,回答下列问题:
(a)合成路线中,填(“有”或“没有”)涉及到碳原子杂化类型的改变。
(b)步骤中涉及反应④原理的化学方程式为。