广东省深圳市罗湖区2023-2024学年高三上学期1月期末化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 文物承载着灿烂文明,传承着历史文化。下列文物的主要材料属于硅酸盐的是( )A、鹰形陶鼎
 B、“盠”青铜驹尊
B、“盠”青铜驹尊 C、佛山丝绸“香云纱”
C、佛山丝绸“香云纱” D、九霄环佩木古琴
D、九霄环佩木古琴 2. 反应是我国科学家发明的低压高效电催化还原的新方法。下列有关说法正确的是( )A、氯离子的结构示意图为
2. 反应是我国科学家发明的低压高效电催化还原的新方法。下列有关说法正确的是( )A、氯离子的结构示意图为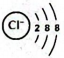 B、NaClO的电子式为
B、NaClO的电子式为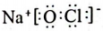 C、CO是非极性分子
D、的结构式为
C、CO是非极性分子
D、的结构式为 3. 科技是第一生产力。下列说法不正确的是( )A、“神州十七号”发动机的耐高温结构材料属于分子晶体 B、“天问一号”火星车的热控保温材料——纳米气凝胶属于胶体 C、杭州亚运会主火炬的燃料为“零碳甲醇”,甲醇具有还原性 D、“玉兔号”月球车采用的太阳能刚性电池阵可将太阳能转化为电能4. 下列实验操作能达到对应目的是( )
3. 科技是第一生产力。下列说法不正确的是( )A、“神州十七号”发动机的耐高温结构材料属于分子晶体 B、“天问一号”火星车的热控保温材料——纳米气凝胶属于胶体 C、杭州亚运会主火炬的燃料为“零碳甲醇”,甲醇具有还原性 D、“玉兔号”月球车采用的太阳能刚性电池阵可将太阳能转化为电能4. 下列实验操作能达到对应目的是( )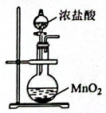
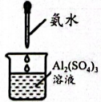
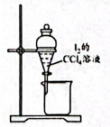
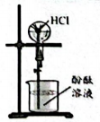
A.制备氯气
B.制备氢氧化铝
C.从的溶液中分离出单质
D.引发红色喷泉
A、A B、B C、C D、D5. “中国芯”的主要原料是单晶硅,制取纯硅的过程如图所示。下列说法正确的是( )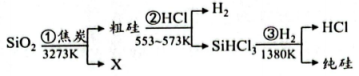 A、步骤①中的反应为 B、二氧化硅是酸性氧化物,能与水反应生成硅酸 C、步骤②和③均属于置换反应 D、28g纯硅中含有4molSi-Si键6. 美好生活靠劳动创造。下列化学知识正确且与劳动项目有关联的是( )
A、步骤①中的反应为 B、二氧化硅是酸性氧化物,能与水反应生成硅酸 C、步骤②和③均属于置换反应 D、28g纯硅中含有4molSi-Si键6. 美好生活靠劳动创造。下列化学知识正确且与劳动项目有关联的是( )选项
劳动项目
化学知识
A
劳动后用免洗酒精洗手
酒精的强氧化性能灭活病毒
B
用氢氟酸刻蚀玻璃
强酸制弱酸
C
用明矾处理含有悬浮物的水
具有吸附性
D
研究性学习:焊接两根铁棒
铝粉与氧化铁发生铝热反应
A、A B、B C、C D、D7. 我国科学家设计的“海泥电池”工作原理如图所示,其中微生物代谢产物显酸性。下列说法正确的是( )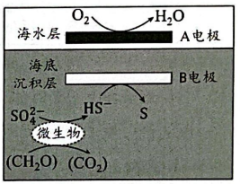 A、电极A上发生氧化反应 B、工作时,B电极附近pH变大 C、质子从海水层通过交接面向海底沉积层移动 D、微生物代谢反应中,氧化剂与还原剂的物质的量之比为1:28. X、Y、Z、M四种元素原子序数依次增大。X核外未成对电子数为3,Z是周期表中电负性最大的元素,M是地壳中含量最多的金属元素。下列说法不正确的是( )A、简单氢化物的沸点:Z>Y B、第一电离能:X>Y C、简单离子半径:Y>M D、分子空间构型为三角锥形9. 颠茄酮合成方法如图所示,下列关于该合成所涉及的物质说法不正确的是( )
A、电极A上发生氧化反应 B、工作时,B电极附近pH变大 C、质子从海水层通过交接面向海底沉积层移动 D、微生物代谢反应中,氧化剂与还原剂的物质的量之比为1:28. X、Y、Z、M四种元素原子序数依次增大。X核外未成对电子数为3,Z是周期表中电负性最大的元素,M是地壳中含量最多的金属元素。下列说法不正确的是( )A、简单氢化物的沸点:Z>Y B、第一电离能:X>Y C、简单离子半径:Y>M D、分子空间构型为三角锥形9. 颠茄酮合成方法如图所示,下列关于该合成所涉及的物质说法不正确的是( )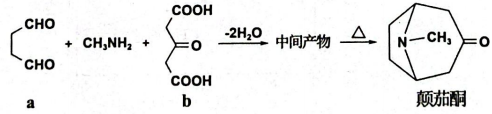 A、化合物a中所有碳原子一定共面 B、化合物b分子式为 C、颠茄酮中的N原子能与形成配位键 D、化合物a和化合物b均可与发生加成反应10. 2023年诺贝尔化学奖授予了研究“量子点”的科学家。铜铟硫()量子点是尺寸在纳米量级(通常2~20nm)的半导体晶体。下列说法正确的是( )A、基态Cu的价层电子排布式为 B、得到的量子点能够产生丁达尔效应 C、可利用X射线衍射仪测定量子点的晶体结构 D、已知In的原子序数为49,可推知In位于元素周期表第四周期11. 下列陈述Ⅰ和陈述Ⅱ均正确且有因果关系的是( )
A、化合物a中所有碳原子一定共面 B、化合物b分子式为 C、颠茄酮中的N原子能与形成配位键 D、化合物a和化合物b均可与发生加成反应10. 2023年诺贝尔化学奖授予了研究“量子点”的科学家。铜铟硫()量子点是尺寸在纳米量级(通常2~20nm)的半导体晶体。下列说法正确的是( )A、基态Cu的价层电子排布式为 B、得到的量子点能够产生丁达尔效应 C、可利用X射线衍射仪测定量子点的晶体结构 D、已知In的原子序数为49,可推知In位于元素周期表第四周期11. 下列陈述Ⅰ和陈述Ⅱ均正确且有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
分子间作用力:
稳定性:
B
电负性:F>Cl
酸性:
C
工业合成氨采用高温、高压、催化剂
高温有利于提高的平衡产率
D
水蒸气通过灼热铁粉,固体变为红棕色
铁粉与水蒸气在高温下发生反应
A、A B、B C、C D、D12. 右图为硫元素的“价—类”二维图。下列说法正确的是( )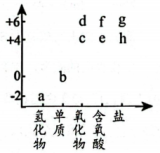 A、a与氧气反应可直接生成b或d B、c能使新制氯水褪色,说明c具有漂白性 C、f的浓溶液和稀溶液均具有氧化性 D、h在空气中不能直接转化成g13. 用、的混合溶液可吸收工厂排放的废气,从而减少空气污染并回收S,其过程如图所示(各步均进行完全)。下列叙述正确的是( )
A、a与氧气反应可直接生成b或d B、c能使新制氯水褪色,说明c具有漂白性 C、f的浓溶液和稀溶液均具有氧化性 D、h在空气中不能直接转化成g13. 用、的混合溶液可吸收工厂排放的废气,从而减少空气污染并回收S,其过程如图所示(各步均进行完全)。下列叙述正确的是( )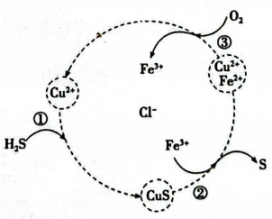 A、吸收前后混合溶液中、浓度不变 B、在转化过程中化合价没有变化的元素只有Cu C、回收32gS时,理论上需要消耗 D、反应①的离子方程式为14. 某同学用下列实验装置探究氨气与氧气的反应,观察到d中产生“白烟”。下列叙述不正确的是( )
A、吸收前后混合溶液中、浓度不变 B、在转化过程中化合价没有变化的元素只有Cu C、回收32gS时,理论上需要消耗 D、反应①的离子方程式为14. 某同学用下列实验装置探究氨气与氧气的反应,观察到d中产生“白烟”。下列叙述不正确的是( )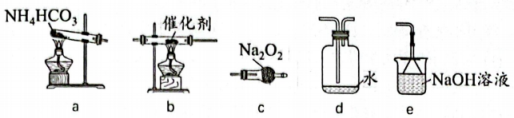 A、装置连接顺序为a-c-b-d-e B、实验前应先检查装置气密性 C、装置c的作用是干燥氨气 D、装置d中“白烟”为固体颗粒15. 新型电池可有效捕获 , 其装置如图所示。下列说法不正确的是( )
A、装置连接顺序为a-c-b-d-e B、实验前应先检查装置气密性 C、装置c的作用是干燥氨气 D、装置d中“白烟”为固体颗粒15. 新型电池可有效捕获 , 其装置如图所示。下列说法不正确的是( )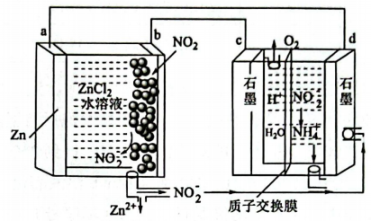 A、a电极作负极 B、b电极的质量增加 C、每捕获 , c电极产生(标准状况) D、d电极反应式为16. 已知的吸光度(A)与溶液中的成正比,其标准曲线如图所示。常温时,测得饱和溶液的吸光度A=0.217,下列说法不正确的是( )
A、a电极作负极 B、b电极的质量增加 C、每捕获 , c电极产生(标准状况) D、d电极反应式为16. 已知的吸光度(A)与溶液中的成正比,其标准曲线如图所示。常温时,测得饱和溶液的吸光度A=0.217,下列说法不正确的是( )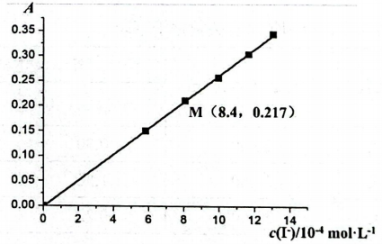 A、向悬浊液中加入少量水,不变 B、饱和溶液中 C、的溶度积常数的数量级为 D、测得40℃时饱和溶液的吸光度A=0.343,说明的溶解为吸热过程
A、向悬浊液中加入少量水,不变 B、饱和溶液中 C、的溶度积常数的数量级为 D、测得40℃时饱和溶液的吸光度A=0.343,说明的溶解为吸热过程二、非选择题:本题共4小题,共56分。
-
17. 菠菜中含有丰富的草酸()和草酸盐,人体内的钙离子易与草酸结合形成草酸钙,某学习小组对此展开了实验探究。(1)、Ⅰ.学习小组查阅资料发现不同的烹饪方式对菠菜中草酸的含量有所影响。
常温下,甲同学用pH计测得的溶液的pH为1.49,解释的溶液pH不为1的原因。(2)、乙同学查到:将菠菜进行水煮后可除去其中大部分草酸。实验装置图
实验序号
实验试剂a
实验现象

①
草酸溶液
产生白色沉淀
②
2mL“生菠菜”榨出的汁
产生白色沉淀
③
2mL“熟菠菜”榨出的汁
(3)、Ⅱ.学习小组欲进一步检测菠菜中草酸和草酸盐的含量,主要操作包括:①称取650g菠菜样品研磨成汁,用稀硫酸浸泡后取澄清溶液(假设草酸和草酸盐全部浸出);②将步骤①中的澄清溶液定容,得到250mL待测液;③移取25.00mL待测液,用的酸性溶液滴定。
上述操作中,不需要的仪器有。(填序号)
①达到滴定终点的现象依据是。
②滴定时:+
(4)、平行实验3次,分别记录有关数据于下表:滴定次数
草酸溶液体积/mL
标准液体积/mL
滴定前读数
滴定后读数
第一次
25.00
0.00
25.99
第二次
25.00
1.56
30.30
第三次
25.00
0.22
26.23
计算:菠菜样品中草酸和草酸盐的总含量为%(均以草酸计)。
(5)、下列操作中可能使测定结果偏高的是____(填字母)。A、滴定管未用标准液润洗就直接注入标准液 B、滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥 C、滴定管尖嘴部分在滴定前有气泡,滴定结束后没有气泡18. 以软锰矿与黄铁矿为主要原料制备高品质的工艺流程:
已知:①软锰矿与黄铁矿的主要成分分别为、 , 还均含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子形成氢氧化物沉淀的pH:
金属离子
开始沉淀的pH
6.9
1.9
6.6
9.1
3.4
沉淀完全()的pH
8.3
3.2
10.1
10.9
4.7
回答下列问题:
(1)、基态的价层电子排布图为。(2)、“酸浸”过程中,为提高反应速率可以采取的措施有(写一条)。(3)、“酸浸”加入后,主要反应的离子方程式:滤渣1的主要成分为S、 , 加入后迅速产生大量气泡,可减少滤渣1在矿粉表面的附着,有利于酸浸。分析迅速产生气泡的原因:。
(4)、“调pH”操作中需调节溶液pH范围为4.7~6.0,此时滤渣2的主要成分为(填化学式)。(5)、“沉锰”步骤发生主要反应的离子方程式为。(6)、利用惰性电极电解体系获得的机理如左图所示,硫酸浓度与电流效率η的关系如右图所示。硫酸浓度超过时,电流效率η降低的原因是。() 19. 2023年杭州亚运会开幕式首次使用“零碳甲醇”作为主火炬塔燃料。(1)、分子中O的杂化轨道类型为。(2)、以为原料加氢可以合成甲醇 , 该反应能量变化如右图。
19. 2023年杭州亚运会开幕式首次使用“零碳甲醇”作为主火炬塔燃料。(1)、分子中O的杂化轨道类型为。(2)、以为原料加氢可以合成甲醇 , 该反应能量变化如右图。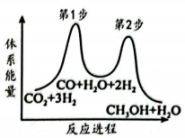
①第步(填“1”或“2”)是上述反应的决速步。
②恒容时,下列措施中能使该平衡体系中增大且加快化学反应速率的是(填字母)。
A.充入He(g),使体系压强增大 B.升高温度
C.将从体系中分离出去 D.再充入
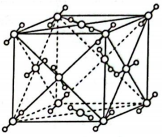
③干冰()的晶胞结构如图所示,若该晶胞边长为apm,则干冰晶体的密度为。(已知:;表示阿伏加德罗常数的值)
 (3)、在体积为1L的恒容密闭容器中,充入和 , 一定条件下发生反应: , 测得浓度随时间的变化:
(3)、在体积为1L的恒容密闭容器中,充入和 , 一定条件下发生反应: , 测得浓度随时间的变化:时间/min
0
3
5
10
15
浓度
0
0.3
0.45
0.5
0.5
测得该条件下平衡时体系的压强为P,求该反应的(物质的分压=总压×物质的量分数)。
(4)、可催化的氢化,体系中产生和CO。现将一定比例的、以一定流速通过催化剂,某温度下,得到的转化率、或CO的选择性[]与催化剂中NiO质量分数的关系图:
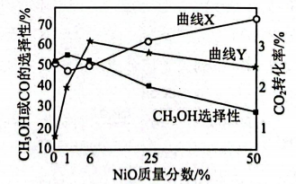
①曲线(填“X”或“Y”)表示的转化率随催化剂中NiO的质量分数的变化。
②有利于提高选择性的反应条件是(填标号)。
A.减小压强 B.使用更合适的催化剂 C.原料气中掺入适量的CO
20. 木质纤维素代替传统的化石原料可以缓解日益紧张的能源危机,进而实现碳减排,聚合物Ⅷ的合成路线如下: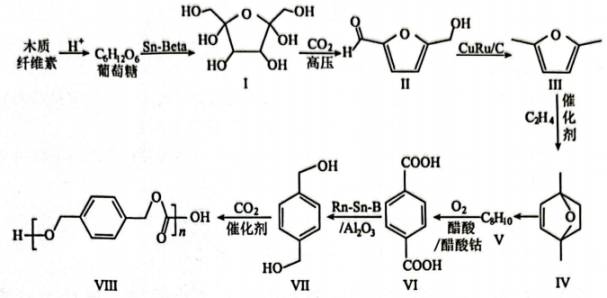
回答下列问题:
(1)、葡萄糖中各原子的电负性由大到小的顺序为。(2)、化合物Ⅰ中的含氧官能团的名称为。(3)、Ⅲ→Ⅳ的反应类型为;化合物Ⅵ的名称为。(4)、化合物Ⅶ的芳香族同分异构体中符合下列条件的有种(不含立体异构)。①最多能与相同物质的量的NaOH反应
②1mol该有机物能与2mol金属Na反应
(5)、写出Ⅶ→Ⅷ的化学方程式:。(6)、参照上述信息,写出以丙烯和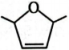 为起始有机原料合成
为起始有机原料合成 的路线中最后一步反应的化学方程式。
的路线中最后一步反应的化学方程式。