湖北省武汉市武昌区2023-2024学年高三上学期期末质量检测化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 合金是生活中常用的材料之一。下列关于合金的叙述正确的是( )A、青铜是我国历史上使用最早的合金 B、铝合金是目前用量最大的合金材料 C、地铁列车中使用的不锈钢是一种常见的碳素钢 D、储氢合金与氢气结合成氢化物发生了物理变化2. 下列化学事实中没有体现“量变引起质变”的哲学观点的是( )A、向浓硫酸溶液中加入锌粉至过量,产生了二氧化硫和氢气 B、向苯酚钠溶液中通入二氧化碳气体至过量,产生白色沉淀 C、向淀粉碘化钾溶液中通入氯气至过量,溶液先变蓝后褪色 D、向硝酸银溶液中滴加氨水至过量,白色沉淀先产生后溶解3. 设为阿伏加德罗常数的值。下列说法正确的是( )A、晶体中化学键的数目为 B、1mol
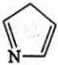 中含σ键的数目为
C、90g葡萄糖和醋酸的混合物中碳原子数目为
D、标况下与充分反应生成HClO的数目为
4. 某有机物是头痛药的主要成分,其结构简式如图所示。下列说法错误的是( )
中含σ键的数目为
C、90g葡萄糖和醋酸的混合物中碳原子数目为
D、标况下与充分反应生成HClO的数目为
4. 某有机物是头痛药的主要成分,其结构简式如图所示。下列说法错误的是( )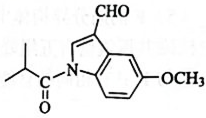 A、该物质的分子式为 B、该分子中碳原子的杂化方式有2种 C、利用溴水褪色实验可检验分子中含有不饱和碳碳双键 D、该分子完全氢化还原后的产物中含有5个手性碳原子5. 化学与生活密切相关。下列说法错误的是( )A、天然水中加入的明矾可作杀菌消毒剂 B、罐头中加入的维生素C可作抗氧化剂 C、食盐中加入的碘酸钾可作营养强化剂 D、面团中加入的小苏打可作食品膨松剂6. 下列离子方程式正确的是( )A、向溶液中滴加溶液: B、金溶于王水中: C、酸性环境下Cu发生腐蚀的正极反应式: D、酸性溶液氧化:7. 由同周期元素X、Y、Z、W构成的离子导体阴离子结构如图。已知Y、W的核外电子总数分别是X的最外层电子数的2倍和3倍。下列说法正确的是( )
A、该物质的分子式为 B、该分子中碳原子的杂化方式有2种 C、利用溴水褪色实验可检验分子中含有不饱和碳碳双键 D、该分子完全氢化还原后的产物中含有5个手性碳原子5. 化学与生活密切相关。下列说法错误的是( )A、天然水中加入的明矾可作杀菌消毒剂 B、罐头中加入的维生素C可作抗氧化剂 C、食盐中加入的碘酸钾可作营养强化剂 D、面团中加入的小苏打可作食品膨松剂6. 下列离子方程式正确的是( )A、向溶液中滴加溶液: B、金溶于王水中: C、酸性环境下Cu发生腐蚀的正极反应式: D、酸性溶液氧化:7. 由同周期元素X、Y、Z、W构成的离子导体阴离子结构如图。已知Y、W的核外电子总数分别是X的最外层电子数的2倍和3倍。下列说法正确的是( )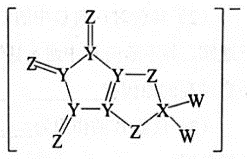 A、第一电离能:X<Y<Z<W B、简单氢化物的稳定性:X>Y>Z>W C、X的最高价氧化物对应的水化物具有两性 D、化合物是由极性共价键形成的极性分子8. 下列实验操作正确的是( )
A、第一电离能:X<Y<Z<W B、简单氢化物的稳定性:X>Y>Z>W C、X的最高价氧化物对应的水化物具有两性 D、化合物是由极性共价键形成的极性分子8. 下列实验操作正确的是( )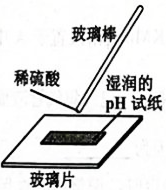
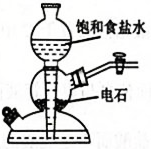
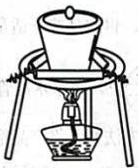
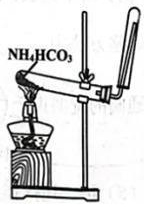
A.测定溶液的pH
B.实验室制取乙炔
C.制备氧化铝
D.实验室制取
A、A B、B C、C D、D9. 了解分子结构有利于物质性质的学习。下列关于结构和性质的说法正确的是( )A、和的VSEPR模型均为四面体形 B、和HF很稳定均是因为分子间存在氢键 C、和均是键角为109°28'的正四面体形分子 D、HCOOH的酸性强于是因为烷基是推电子基团10. 科学家合成的某电子陶瓷材料有着广泛用途,其晶胞结构如图所示;该立方晶胞边长为apm,半径为bpm。设阿伏加德罗常数的值为 , 下列叙述错误的是( )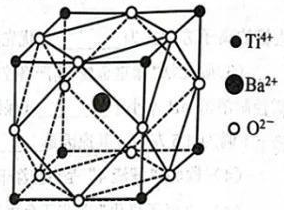 A、晶体的化学式为 B、晶体中构成的多面体有12个面 C、半径为 D、晶体的密度为11. 海水提锂是一项具有巨大应用前景的技术。某电化学海水提锂的装置如图所示:
A、晶体的化学式为 B、晶体中构成的多面体有12个面 C、半径为 D、晶体的密度为11. 海水提锂是一项具有巨大应用前景的技术。某电化学海水提锂的装置如图所示: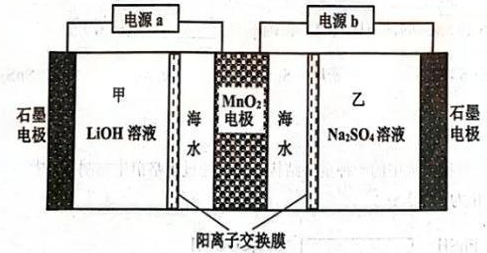
该装置工作步骤如下:
①打开电源b,海水中的嵌入电极形成;
②关闭电源b,打开电源a,同时向石墨电极通入空气(其中体积分数为20%),使中的脱出进入甲溶液。下列说法错误的是( )
A、步骤①中,电极应该与电源b的负极相连 B、步骤②中,电极应该与电源a的负极相连 C、步骤②中,阴极发生的电极反应为 D、每有进入甲溶液,理论上消耗标准状况下的空气28L12. 在银离子催化作用下,过二硫酸钠可将氧化为 , 反应的离子方程式为:。下列有关说法正确的是( )A、的酚酞溶液呈红色 B、中硫元素的化合价为+7价 C、反应中的氧化产物是 D、转移时可生成13. 为了探究浓硫酸与木炭粉在加热条件下的反应产物,某同学设计了如图所示的实验装置。下列说法正确的是( ) A、装置甲中浓硫酸的作用是强氧化性和酸性 B、装置乙固体变蓝不能说明反应中有水生成 C、装置丙的作用是检验并除净二氧化硫气体 D、装置丁的作用是吸收尾气以防止空气污染14. Wacker法主要用于乙烯制取乙醛,其催化循环过程如图所示。下列说法错误的是( )
A、装置甲中浓硫酸的作用是强氧化性和酸性 B、装置乙固体变蓝不能说明反应中有水生成 C、装置丙的作用是检验并除净二氧化硫气体 D、装置丁的作用是吸收尾气以防止空气污染14. Wacker法主要用于乙烯制取乙醛,其催化循环过程如图所示。下列说法错误的是( )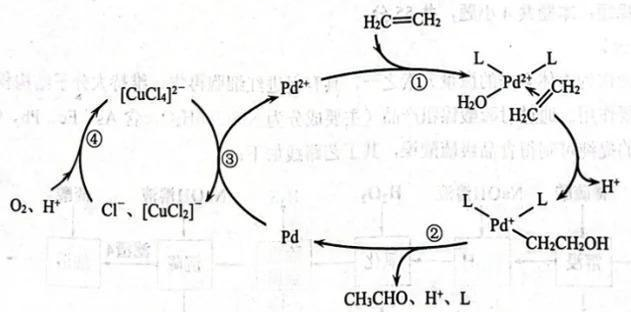 A、微粒
A、微粒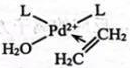 中乙烯提供π电子与形成配位键
B、若反应物换为丙烯,可能制得两种官能团不同的有机物
C、乙醛制取过程中、、均是催化剂
D、反应③的离D子方程式为
15. 常温下,向20.00mL0.100mol/L的乙二酸()溶液中滴加同浓度的NaOH溶液,过程中lgX(X为或)、V(NaOH)与pH的变化关系如图所示。下列说法错误的是( )
中乙烯提供π电子与形成配位键
B、若反应物换为丙烯,可能制得两种官能团不同的有机物
C、乙醛制取过程中、、均是催化剂
D、反应③的离D子方程式为
15. 常温下,向20.00mL0.100mol/L的乙二酸()溶液中滴加同浓度的NaOH溶液,过程中lgX(X为或)、V(NaOH)与pH的变化关系如图所示。下列说法错误的是( )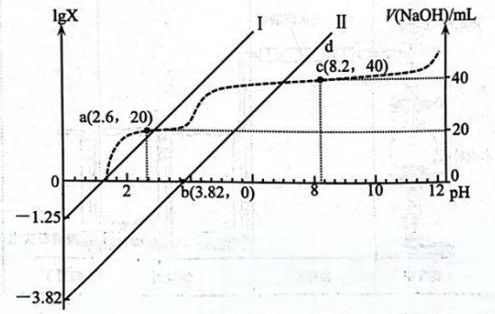 A、直线Ⅰ中X表示 B、乙二酸的 C、c点溶液中 D、pH=7时,
A、直线Ⅰ中X表示 B、乙二酸的 C、c点溶液中 D、pH=7时,二、非选择题:本题共4小题,共55分。
-
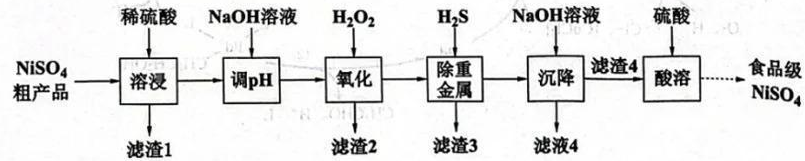
16. 镍元素作为人体必需的微量元素之一,具有促进红细胞再生、维持大分子结构和膜结构稳定等重要作用。通过对硫酸镍粗产品(主要成分为 , 含As、Fe、Pb、Cd、Hg等元素)的提纯可制得食品级硫酸镍,其工艺路线如下:
常温下,某些物质的相关常数数据见下表:
回答下列问题:
(1)、Fe的价层电子的空间运动状态有种。(2)、已知粗品中As元素含量较Fe、Pb元素高,且以的形式存在,则“氧化”除去铅的离子方程式为 , 优先除去的金属元素为(填Ni、Fe或Pb)。(3)、硫化法“除重金属”需严格控制溶液的pH,若要使滤液中的浓度小于 , 需控制溶液pH不小于(保留一位小数)。但在实际反应时为了提高产量,要将溶液pH调为4.5左右,其原因是。(已知常温下饱和溶液的浓度为0.1mol/L)(4)、检验“滤渣4”是否洗涤干净的操作是。(5)、“离子极化”是指正负离子的电子云受到对方电场的影响而导致形变的现象。化合物中正离子电荷越高、离子半径越小,极化作用越大,则化学键中离子键成分的百分数越小。化合物和的性质比较中,正确的是(填标号)。a.熔点: b.密度: c.溶解度:
17. 苯并卟啉是有机合成中的一种重要结构,可以通过吡咯衍生物制备。吡咯衍生物F的合成路线如下(Ph为苯基):
回答下列问题:
(1)、有机物A的名称为。(2)、A→B的化学方程式为。(3)、B→C的反应类型为。(4)、D的结构简式为;下列说法正确的有(填标号)。a.C和D之间存在构造异构现象 b.C和D的化学性质完全相同
c.C和D之间存在立体异构现象 d.C和D的物理性质有一定的差异
(5)、F的同分异构体中能同时满足以下三个条件的有种(不考虑立体异构),其中核磁共振氢谱有五组峰,且峰面积之比为4:2:2:2:1的结构简式为。①与F具有相同的官能团;②苯环上有三个取代基;③N原子上无不饱和键。
18. 过氧化钙()可用于地表水质改善、医用应急供氧等;过氧化钙难溶于水(在水中以形式存在),不溶于乙醇,可溶于酸。实验室用30%溶液与溶液在碱性条件下制取过氧化钙,并测定过氧化钙的产率(装置如图所示,夹持类装置未画出)。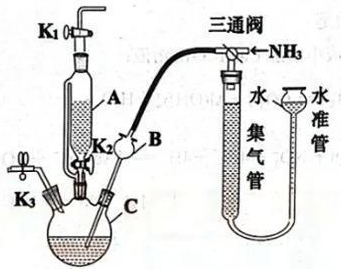
回答下列问题:
(1)、的电子式为。(2)、实验时,向C中的溶液中滴入A中足量的30%溶液,打开 , 调整三通阀,并不断向C中通入氨气,发生反应的化学方程式为 , 反应时仪器C的温度不宜过高的原因有、。(3)、仪器B的作用为。实验结束后,将C中所得产品取出,过滤,乙醇洗涤,干燥备用。(4)、将上述A、B、C装置清洗干净,重新组装,并做适当调整用于过氧化钙产率的测定,调整方法为。将产品溶于适量盐酸溶液后置于C中,溶液置于A中,将三通阀的旋塞调于 位,调整水准管液面使之与集气管液面相平,记录集气管液面刻度后,(填操作方法)。将产品溶于盐酸而不是硫酸的原因为。 (5)、按上述操作进行实验,一段时间后,当集气管液面保持稳定时,调整水准管与集气管液面相平,记录集气管刻度,测得集气管液面前后相差31.36mL(折合成标准状况下),则的产率为(保留两位小数)。19. 甲烷水蒸气重整反应是制备甲醇的重要方法之一。传统的方式是在高温、高压条件下进行生产,有操作成本高、设备投资高等缺点。(1)、反应在加热炉中进行,通过冷凝将气体产物和液体产物进行分离,得到的气体产物为CO、、 , 液体产物为。若已知C-H键、C-O键、O-H键、C-C键、H-H键的键能,则下列反应中可以计算反应热的有(填反应序号)。
位,调整水准管液面使之与集气管液面相平,记录集气管液面刻度后,(填操作方法)。将产品溶于盐酸而不是硫酸的原因为。 (5)、按上述操作进行实验,一段时间后,当集气管液面保持稳定时,调整水准管与集气管液面相平,记录集气管刻度,测得集气管液面前后相差31.36mL(折合成标准状况下),则的产率为(保留两位小数)。19. 甲烷水蒸气重整反应是制备甲醇的重要方法之一。传统的方式是在高温、高压条件下进行生产,有操作成本高、设备投资高等缺点。(1)、反应在加热炉中进行,通过冷凝将气体产物和液体产物进行分离,得到的气体产物为CO、、 , 液体产物为。若已知C-H键、C-O键、O-H键、C-C键、H-H键的键能,则下列反应中可以计算反应热的有(填反应序号)。反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
(2)、利用等离子体催化,可在温和条件下制备甲醇。下列关于等离子体的叙述中,错误的有(填标号)。a.等离子体是带电的物质聚集体
b.等离子体是熔点低的离子化合物
c.等离子体是一种不同于固态、液态、气态的物质聚集状态
d.等离子体具有丰富的高能电子,可将不活泼的原料分子活化
(3)、在15W放电功率和14kHz放电频率条件下,将、、Ar以1:4:2的比例投入反应区,反应区温度对转化率和产物选择性的影响如图所示:【产物A的选择性】

①在130℃到200℃的温度范围内,随着反应区温度的升高,选择性先升高后降低的产物是(填化学式)。
②在170℃、250℃、300℃的条件下,生成的量最多的温度为 , 若此时投入 , 生成的的物质的量为。
③170℃时,反应Ⅰ的平衡常数(以分压表示,分压=总压×物质的量分数,列出计算式即可)。
(4)、在反应温度为170℃的条件下,不改变其他条件,投料比逐渐降低时,的转化率不断下降,原因是。