四川省成都市蓉城名校2023-2024学年高二上学期期末联考化学试
试卷更新日期:2024-02-01 类型:期末考试
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 下列说法错误的是( )A、废旧电池应回收利用 B、草木灰与铵态氮肥不能混合使用 C、工业上常用Na2S处理废水中的Cu2+、Hg2+等重金属离子 D、合成氨工业中可寻找更高效的催化剂来提高氮气的平衡转化率2. 下列事实对应的电极反应式或离子方程式书写正确的是( )A、硫化氢在水中电离:H2S+H2O⇌H3O++HS− B、滴加酚酞的苏打水呈红色:CO+2H2O⇌H2CO3+2OH− C、铁在潮湿空气中生成红褐色的铁锈,其负极的电极反应式为:Fe-3e−=Fe3+ D、向NaAlO2溶液中滴加NaHCO3溶液:AlO+HCO+H2O=Al(OH)3↓+CO2↑3. 下列反应可以自发进行但不能利用熵判据解释的是( )A、NaHCO3(s)+HCl(aq)=NaCl(aq)+CO2(g)+H2O(l) B、Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) C、4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s) D、2KClO3(s)=2KCl(s)+3O2(g)4. 图为中和反应反应热的测定实验装置,下列说法错误的是( )
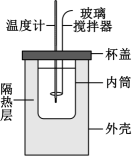 A、使用玻璃搅拌器是为了使反应更充分 B、隔热层的作用是减少热量损失,减小实验误差 C、每完成一次实验只需要用温度计测量两次温度即可 D、实验中用等体积等浓度的氨水代替氢氧化钠与盐酸反应,测得反应热的数值不同5. 室温下欲配制并测量1mol·L−1Na2S溶液的pH值,下列预测或做法错误的是( )A、该溶液pH>7 B、若加水稀释,溶液pH减小 C、实验室配制Na2S溶液时,常常加几滴NaOH溶液 D、将Na2S溶液直接滴在润湿的pH试纸上,然后与标准比色卡比较6. 实验室用如图所示装置测定化学反应速率,下列说法错误的是( )
A、使用玻璃搅拌器是为了使反应更充分 B、隔热层的作用是减少热量损失,减小实验误差 C、每完成一次实验只需要用温度计测量两次温度即可 D、实验中用等体积等浓度的氨水代替氢氧化钠与盐酸反应,测得反应热的数值不同5. 室温下欲配制并测量1mol·L−1Na2S溶液的pH值,下列预测或做法错误的是( )A、该溶液pH>7 B、若加水稀释,溶液pH减小 C、实验室配制Na2S溶液时,常常加几滴NaOH溶液 D、将Na2S溶液直接滴在润湿的pH试纸上,然后与标准比色卡比较6. 实验室用如图所示装置测定化学反应速率,下列说法错误的是( ) A、实验中可用秒表进行计时 B、在锥形瓶中加入适量NaHSO4固体,则ʋ(H2)增大 C、可用一段时间内H2的浓度变化表示化学反应速率 D、为减小误差,可在锥形瓶和分液漏斗上口间连接一橡胶管保证液体能够顺利流下7. 室温下,向0.01mol·L−1氨水中加入少量醋酸铵固体(醋酸铵水溶液pH≈7),溶液pH随加入醋酸铵固体质量的变化曲线如图所示。下列分析正确的是( )
A、实验中可用秒表进行计时 B、在锥形瓶中加入适量NaHSO4固体,则ʋ(H2)增大 C、可用一段时间内H2的浓度变化表示化学反应速率 D、为减小误差,可在锥形瓶和分液漏斗上口间连接一橡胶管保证液体能够顺利流下7. 室温下,向0.01mol·L−1氨水中加入少量醋酸铵固体(醋酸铵水溶液pH≈7),溶液pH随加入醋酸铵固体质量的变化曲线如图所示。下列分析正确的是( ) A、a点:pH=12 B、b点:c(NH)>c(CH3COO−) C、c点:pH可能小于7 D、a点到c点,溶液pH减小是因为醋酸铵水解呈酸性8. 下列关于常见的化学电源说法错误的是( )A、铅酸蓄电池放电时,负极质量减轻 B、碱性锌锰电池正极反应式为:MnO2+H2O+e−=MnO(OH)+OH− C、锂离子电池具有质量小、体积小、储存和输出能量大等特点 D、氢氧燃料电池中,若把H2改为等物质的量的甲醇进行充分反应,O2的用量增加9. 在一定温度下,向装有一定量N2的固定容积的容器中逐步通入H2 , 发生反应:N2(g)+3H2(g)⇌2NH3(g)ΔH<0,平衡时NH3体积分数随通入的n(H2)的变化如图所示(图中T表示温度)。下列说法错误的是( )
A、a点:pH=12 B、b点:c(NH)>c(CH3COO−) C、c点:pH可能小于7 D、a点到c点,溶液pH减小是因为醋酸铵水解呈酸性8. 下列关于常见的化学电源说法错误的是( )A、铅酸蓄电池放电时,负极质量减轻 B、碱性锌锰电池正极反应式为:MnO2+H2O+e−=MnO(OH)+OH− C、锂离子电池具有质量小、体积小、储存和输出能量大等特点 D、氢氧燃料电池中,若把H2改为等物质的量的甲醇进行充分反应,O2的用量增加9. 在一定温度下,向装有一定量N2的固定容积的容器中逐步通入H2 , 发生反应:N2(g)+3H2(g)⇌2NH3(g)ΔH<0,平衡时NH3体积分数随通入的n(H2)的变化如图所示(图中T表示温度)。下列说法错误的是( ) A、T1>T2 B、NH3的物质的量大小为:c>b>a C、相同温度下,平衡常数与投料比无关 D、b点到c点,NH3的平衡体积分数减小,是由平衡逆向移动引起的10. 如图所示进行实验,下列分析错误的是( )
A、T1>T2 B、NH3的物质的量大小为:c>b>a C、相同温度下,平衡常数与投料比无关 D、b点到c点,NH3的平衡体积分数减小,是由平衡逆向移动引起的10. 如图所示进行实验,下列分析错误的是( ) A、②中黄色沉淀变成黑色沉淀 B、该实验可以说明溶度积Ksp(AgI)>Ksp(Ag2S) C、反应后的溶液中c(Ag+):①<② D、②中反应为:2AgI(s)+S2−(aq)⇌Ag2S(s)+2I−(aq)11. 1799年,意大利科学家伏打发明了世界上最早的电池——伏打电池(电解质溶液可以是稀硫酸或海水)。如图是伏打电堆的一种,下列说法正确的是( )
A、②中黄色沉淀变成黑色沉淀 B、该实验可以说明溶度积Ksp(AgI)>Ksp(Ag2S) C、反应后的溶液中c(Ag+):①<② D、②中反应为:2AgI(s)+S2−(aq)⇌Ag2S(s)+2I−(aq)11. 1799年,意大利科学家伏打发明了世界上最早的电池——伏打电池(电解质溶液可以是稀硫酸或海水)。如图是伏打电堆的一种,下列说法正确的是( ) A、工作时,电子由锌片通过湿布片流向铜片 B、电池工作一段时间后,湿布片上可能会有Zn(OH)2生成 C、该电池正极反应式一定为O2+4e−+2H2O=4OH− D、若湿布片所含溶液为饱和食盐水,则铜片附件有Cl2生成12. 如图是常温下向10mL某浓度的盐酸(滴有酚酞)中逐滴加入0.10mol·L−1NaOH溶液时,溶液的pH随NaOH溶液的体积V变化的曲线,下列相关判断错误的是( )
A、工作时,电子由锌片通过湿布片流向铜片 B、电池工作一段时间后,湿布片上可能会有Zn(OH)2生成 C、该电池正极反应式一定为O2+4e−+2H2O=4OH− D、若湿布片所含溶液为饱和食盐水,则铜片附件有Cl2生成12. 如图是常温下向10mL某浓度的盐酸(滴有酚酞)中逐滴加入0.10mol·L−1NaOH溶液时,溶液的pH随NaOH溶液的体积V变化的曲线,下列相关判断错误的是( ) A、原盐酸的浓度为0.10mol·L−1 B、滴定过程中,眼睛应注视锥形瓶中溶液颜色的变化 C、达到滴定终点时不慎多加了1滴NaOH溶液(约0.04mL),继续加水至40mL,所得溶液的pH为10 D、滴定后仰视读数,则最终测得的待测盐酸浓度偏小13. 室温下,有如下四种溶液,下列有关叙述正确的是( )
A、原盐酸的浓度为0.10mol·L−1 B、滴定过程中,眼睛应注视锥形瓶中溶液颜色的变化 C、达到滴定终点时不慎多加了1滴NaOH溶液(约0.04mL),继续加水至40mL,所得溶液的pH为10 D、滴定后仰视读数,则最终测得的待测盐酸浓度偏小13. 室温下,有如下四种溶液,下列有关叙述正确的是( )编号
①
②
③
④
pH
4
4
10
10
溶液
盐酸
醋酸溶液
氢氧化钠溶液
氨水
A、相同体积的①、②分别与③完全反应消耗NaOH的物质的量:①>② B、相同体积的③、④分别加水稀释10倍所得溶液pH:③<④ C、②、④溶液由水电离出的H+浓度不相等 D、VaL①与VbL③混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=9,则Va∶Vb=11∶914. 某温度下,向10mL0.1mol·L−1Pb(NO3)2溶液中滴加0.1mol·L−1Na2S溶液,溶液中-lgc(Pb2+)与滴加的Na2S溶液体积V的关系如图所示(忽略体积变化)。已知:Ksp(PbS)<Ksp(FeS)。下列判断正确的是( ) A、a、b、c三点中Ksp(PbS)从大到小的顺序为:a>b>c B、b点:c(Pb2+)<c(S2−) C、c点:2c(Pb2+)+c(H+)=c(NO3−)+c(OH−) D、其他条件相同时,若将Pb(NO3)2溶液换成同浓度、同体积的Fe(NO3)2溶液,图中-lgc(Pb2+)换成-lgc(Fe2+),则b点会沿虚线向下移动
A、a、b、c三点中Ksp(PbS)从大到小的顺序为:a>b>c B、b点:c(Pb2+)<c(S2−) C、c点:2c(Pb2+)+c(H+)=c(NO3−)+c(OH−) D、其他条件相同时,若将Pb(NO3)2溶液换成同浓度、同体积的Fe(NO3)2溶液,图中-lgc(Pb2+)换成-lgc(Fe2+),则b点会沿虚线向下移动二、非选择题:本题共4小题,共58分。
-
15. HCOOH、CH3COOH、H2C2O4是典型的有机酸,常温下,其电离常数如下表:
有机酸
HCOOH
CH3COOH
H2C2O4
电离常数
Ka=1.8×10−4
Ka=1.75×10−5
Ka1=5.6×10−2
Ka2=1.5×10−4
回答下列问题(以常温为研究温度):
(1)、H2C2O4对应Ka2的表达式为。(2)、等物质的量浓度、等体积的HCOOH和CH3COOH,其pH的大小关系为:HCOOHCH3COOH(填“>”“<”或“=”)。(3)、等物质的量浓度、等体积的HCOOH和CH3COOH均用蒸馏水稀释至原体积的10倍,其溶液的导电性强弱关系为:HCOOHCH3COOH(填“>”“<”或“=”)。(4)、等物质的量浓度的HCOONa溶液和CH3COONa溶液中,由水电离的c(OH−)大小关系为:HCOONaCH3COONa(填“>”“<”或“=”)。(5)、KHC2O4的水溶液呈性。(6)、将pH之和等于14的CH3COOH和NaOH溶液等体积混合,溶液呈性。(7)、在H2C2O4溶液中加入过量的HCOONa溶液,其反应的离子方程式为。(8)、将物质的量浓度比为2:1的HCOOH和NaOH溶液等体积混合,混合后溶液中的微粒浓度关系中,c(H+)-c(OH−)=(用HCOOH及HCOO−的浓度符号表示)。16. 据报道,CH4也是一种温室气体,对环境的影响是相同条件下CO2的40倍。研究CH4和CO2的转化技术对环境改善有着积极的意义。一个比较好的思路是,首先两者在一定条件下反应转化为CO和H2 , 然后再将CO和H2反应转化为CH3OH。已知:①甲烷的燃烧热为890.3kJ·mol−1;
②CO(g)+O2(g)=CO2(g) ΔH1=-283kJ·mol−1;
③H2(g)+O2(g)=H2O(l) ΔH2=-285.8kJ·mol−1;
回答下列问题:
(1)、写出符合甲烷燃烧热的热化学方程式:。(2)、常温下,CH4(g)+CO2(g)=2CO(g)+2H2(g),其反应热ΔH= , 若在恒温恒容条件下,增大起始CO2的体积分数(增加CO2的用量),反应速率(填“增大”“减小”或“不变”),CO2的转化率(填“提高”“降低”或“不变”)。(3)、若已知以下两个反应的平衡常数分别为:CO2(g)+CH4(g)⇌2H2(g)+2CO(g) K1
CO(g)+2H2(g)⇌CH3OH(g) K2
则CO2(g)+2H2(g)+CH4(g)⇌2CH3OH(g)的平衡常数为(用K1、K2表示)。
(4)、有人提出分开处理温室气体的思路如下:ⅰ.将CO2转化为CO(NH2)2 , 其原理为:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g),若该反应在恒温恒容条件下进行,下列说法能说明该反应已达到平衡的有(填标号);
A.断裂3molN—H键的同时断裂2molO—H键
B.NH3、CO2、H2O的物质的量恰好相等
C.混合气体的平均相对分子质量不再发生改变
D.体系的压强不再发生改变
ⅱ.将CH4纯化后制作成燃料电池,则在酸性条件下,该燃料电池工作时负极的电极反应式为。
(5)、研究发现,CO2和H2在催化剂作用下可以按照不同的计量数之比进行反应。其原理如下:①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1<0
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2>0
向体积恒定的容器中通入一定量的CO2和H2发生反应,温度升高,则平衡时CH3OH的平衡浓度(填“逐渐增大”“逐渐减小”或“不发生改变”)。若在反应过程中,随着温度的升高,持续监测CH3OH与CO的浓度比,测得的数据先增大后减小,其先增大的原因可能是。
17. 某化学兴趣小组想要研究氯化铜溶液的相关性质,但实验室无氯化铜样品,大家想出两种制备方案并完成有关性质实验:【方案一】
用固体CuO(含少量Fe2O3)和盐酸反应:将固体CuO缓慢加入到盛有稀盐酸的烧杯中,边加边搅拌,直至固体完全溶解,得溶液A。
【方案二】
用铜和石墨作电极,电解稀盐酸:将两个电极和直流电源相连,插入到盛有稀盐酸的烧杯中,电解一段时间后,得溶液B。
已知:①氧化性:Fe3+>Cu2+;
②CuCl是一种白色不溶于水的固体;
③在该实验环境下,有关参数如下表:
物质
Fe(OH)3
Cu(OH)2
Ksp
2.8×10−39
2.2×10−20
阳离子完全沉淀时的pH
≥2.8
≥6.5
回答下列问题:
(1)、方案一中,为了制备不含铁元素的CuCl2溶液,有同学提议在溶液A中加入过量的铜,充分反应后过滤,该方法(填“能”或“不能”)达到目的,理由是(结合方程式解释)。也有同学提议用调整溶液pH的方法来除去Fe3+ , 假设Cu2+起始浓度为2.2mol·L−1 , 则在不损失铜元素的情况下,调整溶液pH的范围为。(2)、方案二中,Cu电极应该与电源的(填“正”或“负”)极相连,其电解的总反应方程式为。实验过程中,有同学观察到阳极周围有气泡出现,则出现气泡最可能的原因是。(3)、若将方案二中的稀盐酸换作饱和食盐水,发现电解过程中未有蓝绿色溶液出现,但在其中一个电极附近出现了白色固体,则生成该固体的电极反应式为。(4)、取少量方案二中B的稀溶液于试管,在酒精灯上加热,发现溶液由蓝色变为蓝绿色,其原因是(用平衡移动原理解释)。(5)、取纯化的A的稀溶液20mL于烧杯中,加入2gKCl固体,用玻璃棒搅拌,发现溶液由蓝色变为蓝绿色,(填“能”或“不能”)用勒夏特列原理解释该现象。18. 电解二氧化锰具有高能量密度、长寿命、低自放电率等优点,被广泛应用于移动电源、电动汽车、无人机等领域。工业上利用碳酸锰矿(含碳酸亚铁及其它重金属化合物)通过一系列过程制备电解二氧化锰的原理如下:
已知:在生产时对应温度下,有关物质的溶度积常数如下:
物质
Fe(OH)3
Fe(OH)2
Ksp
2.8×10−39
4.7×10−17
回答下列问题:
(1)、为了加快碳酸锰矿的溶解,可采取的措施有(答出一种即可)。(2)、氧化过程的目的是。(3)、石灰石除铁的原理是(结合方程式回答)。(4)、电解是在酸性环境下进行,生成二氧化锰的电极反应式为。(5)、在电解过程中,其中一个电极生成的气体物质可以用于制成燃料电池,若该电池在碱性条件下工作,其负极发生的电极反应式为。(6)、电解时Mn2+的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中Mn2+的浓度,其原理为:。某同学进行了如下操作:取过滤后的溶液10mL,稀释至100mL,取25mL稀释后的溶液于锥形瓶中,用浓度为0.1000mol·L−1KMnO4溶液进行滴定,滴定终点时,用去的KMnO4溶液体积平均值为12.50mL。①滴定终点时的现象是;
②经计算,此次实验测得的原过滤后溶液中Mn2+的浓度为;
③滴定终点后读数时发现滴定管尖嘴处有一个气泡,若其它环节无误,则此次实验测得的Mn2+浓度(填“偏大”“偏小”或“不受影响”)。