河北省张家口市2023-2024学年高一上学期1月期末考试化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
-
1. 2023年10月8日第19届亚运会在杭州圆满闭幕,本届亚运会秉持“绿色、智能、节俭、文明”的办会理念。下列说法正确的是( )A、本届亚运会的火炬燃料是零碳甲醇,甲醇属于电解质 B、火炬“薪火”的火焰呈黄色,是因为发生了化学变化 C、亚运会纪念章“琮琮”是由锌合金镀金制成的,锌合金熔点低于锌 D、吉祥物“江南忆”机器人所采用芯片的主要成分为硅,属于金属材料2. 下列化学用语正确的是( )A、用电子式表示CO2的形成:
 B、S2-的结构示意图:
B、S2-的结构示意图: C、溴化钠的电子式:
C、溴化钠的电子式: D、HClO的结构式:H—Cl—O
3. 常温下,在溶液中不能大量共存的离子组是( )A、Fe2+、K+、、Cl- B、Mg2+、Na+、Br-、 C、Ag+、H+、、I- D、Ba2+、、Cl-、4. 下列各组物质的性质比较正确的是( )A、微粒半径:S2->S>Na+>H+ B、氢化物的水溶液的酸性:HF>H2S>Hl C、碱性:NaOH>Mg(OH)2>Ca(OH)2>KOH D、熔点:F2>Cl2>Br2>I25. 一种具有磁性的“纳米药物”如图所示,可利用磁性引导该药物到达人体内的病变部位。该技术可大大提高治疗效果。下列有关说法正确的是( )
D、HClO的结构式:H—Cl—O
3. 常温下,在溶液中不能大量共存的离子组是( )A、Fe2+、K+、、Cl- B、Mg2+、Na+、Br-、 C、Ag+、H+、、I- D、Ba2+、、Cl-、4. 下列各组物质的性质比较正确的是( )A、微粒半径:S2->S>Na+>H+ B、氢化物的水溶液的酸性:HF>H2S>Hl C、碱性:NaOH>Mg(OH)2>Ca(OH)2>KOH D、熔点:F2>Cl2>Br2>I25. 一种具有磁性的“纳米药物”如图所示,可利用磁性引导该药物到达人体内的病变部位。该技术可大大提高治疗效果。下列有关说法正确的是( ) A、该药物具有磁性与Fe3O4外壳有关,Fe3O4为红棕色粉末 B、Fe3O4可通过Fe与水蒸气在高温下反应制得 C、二氧化硅属于酸性氧化物,可溶于水生成硅酸 D、该药物分散于水中得到的分散系可以产生丁达尔效应6. 碘元素的一种核素可用于治疗肿瘤。下列说法正确的是( )A、1mol有的中子数为53NA B、和互为同素异形体 C、含有碘元素的物质均可使淀粉变蓝 D、1个原子的质量g7. 现有短周期主族元素X、Y,Z、R、T,X与Y可形成X2Y、X2Y2型化合物,R的一种原子可以用于测定文物的年代,Z是短周期中金属性最强的元素,Z与T形成化学式为Z2T的化合物,五种元素的原子半径与原子序数的关系如图所示。下列说法正确的是( )
A、该药物具有磁性与Fe3O4外壳有关,Fe3O4为红棕色粉末 B、Fe3O4可通过Fe与水蒸气在高温下反应制得 C、二氧化硅属于酸性氧化物,可溶于水生成硅酸 D、该药物分散于水中得到的分散系可以产生丁达尔效应6. 碘元素的一种核素可用于治疗肿瘤。下列说法正确的是( )A、1mol有的中子数为53NA B、和互为同素异形体 C、含有碘元素的物质均可使淀粉变蓝 D、1个原子的质量g7. 现有短周期主族元素X、Y,Z、R、T,X与Y可形成X2Y、X2Y2型化合物,R的一种原子可以用于测定文物的年代,Z是短周期中金属性最强的元素,Z与T形成化学式为Z2T的化合物,五种元素的原子半径与原子序数的关系如图所示。下列说法正确的是( ) A、Y与Z形成的化合物阴阳离子个数比是1:1 B、1molZ2Y2与足量的RY2反应,转移电子数为2NA C、含氧酸酸性:T>R D、X2Y、X2Y2的化学键类型不完全相同8. 根据下列实验操作和现象所得到的结论正确的是( )
A、Y与Z形成的化合物阴阳离子个数比是1:1 B、1molZ2Y2与足量的RY2反应,转移电子数为2NA C、含氧酸酸性:T>R D、X2Y、X2Y2的化学键类型不完全相同8. 根据下列实验操作和现象所得到的结论正确的是( )选项
操作和现象
结论
A
向某钠盐溶液中加入盐酸,产生的无色无味气体能使澄清石灰水变浑浊
原溶液为碳酸钠溶液
B
亚磷酸(H3PO3)中加入过量NaOH溶液生成NaHPO3
H3PO3属于二元酸
C
足量Fe在少量Cl2中燃烧,铁有剩余
铁在少量氯气中燃烧生成FeCl2
D
在硫酸酸化的KMnO4溶液中加入Na2S溶液,再滴加BaCl2溶液,产生白色沉淀
将S2-氧化成
A、A B、B C、C D、D9. 下列有关金属及其化合物的说法正确的是( )A、FeSO4溶液若变质,可加入Cu复原 B、FeO不稳定,在空气中受热迅速转化为Fe2O3 C、金属元素在自然界中都以化合态形式存在 D、将mg组成不同的铝钠合金分别投入足量盐酸中,铝的质量分数越大,放出H2越多10. 设NA为阿伏加德罗常数的值,下列说法不正确的是( )A、25℃101kPa,2.24LSO2分子中含有的氧原子数小于0.2NA B、22gCO2和N2O混合气体中含有电子数为11 NA C、常温下,将7.1gCl2通入水中,转移的电子数为0.1NA D、1L0.1mol/L的HCl溶液中含氢原子数大于0.1NA11. 下列关于元素周期表及周期律的叙述,其中不正确的有( )①两原子的核外电子排布完全相同,则其物理性质一定相同
②K在氧气中剧烈燃烧,产物是K2O,其水溶液是一种强碱
③砹(At)为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸
④稀有气体元素原子的最外层都排有8个电子
⑤氟元素原子的核外电子排布示意图为
 , 则
, 则 的化学性质与氟元素原子相似
的化学性质与氟元素原子相似⑥非金属元素呈现的正化合价不超过该元素原子核外最外层电子数
A、2个 B、3个 C、4个 D、5个12. 配制450mL1.00mol/L的NaOH溶液,下列说法不正确的是( ) A、上述实验操作的顺序为:④②①③ B、将NaOH固体在烧杯中溶解后,立即转移到容量瓶中 C、实验中可用④称量20.0gNaOH固体 D、③操作时,若俯视刻度线,配得的NaOH溶液浓度偏高13. 下列实验装置能达到实验目的的是( )
A、上述实验操作的顺序为:④②①③ B、将NaOH固体在烧杯中溶解后,立即转移到容量瓶中 C、实验中可用④称量20.0gNaOH固体 D、③操作时,若俯视刻度线,配得的NaOH溶液浓度偏高13. 下列实验装置能达到实验目的的是( )A
B
C
D

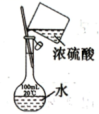


验证C的非金属性强于Si
浓硫酸的稀释
除二氧化碳中的氯化氢气体
制备NaHCO3
A、A B、B C、C D、D14. 利用绿矾制备还原铁粉的工业流程如下,下列说法正确的是( ) A、“转化”步骤中理论上消耗的NH4HCO3与FeSO4·7H2O的物质的量之比为1:1 B、干燥过程若在空气中进行,会有少量FeCO3被氧化为FeOOH,发生反应的化学方程式为2FeCO3+O2+H2O=2FeOOH+2CO2 C、“焙烧”操作应在蒸发皿中进行 D、“焙烧”中氧化剂和还原剂的物质的量之比为1:2:
A、“转化”步骤中理论上消耗的NH4HCO3与FeSO4·7H2O的物质的量之比为1:1 B、干燥过程若在空气中进行,会有少量FeCO3被氧化为FeOOH,发生反应的化学方程式为2FeCO3+O2+H2O=2FeOOH+2CO2 C、“焙烧”操作应在蒸发皿中进行 D、“焙烧”中氧化剂和还原剂的物质的量之比为1:2:二、非选择题:本题共4小题,共58分。
-
15. 1869年,俄国化学家门捷列夫制作了第一张元素周期表。下表是元素周期表的一部分,表中所列的字母分别代表某-化学元素。回答下列问题:
 (1)、单质e、f、g分别与足量的盐酸反应产生相同体积的气体,反应最快的是(填化学式),参与反应的e、f、g的质量比是。(2)、g和j形成的化合物溶液中滴加氨水至过量,看到的现象是。(3)、a与b形成的化合物M中a的质量分数为25%,写出该化合物M的结构式。(4)、h、i、j的简单氢化物的稳定性最弱的是(填化学式)。(5)、火箭发动机曾经利用c2a4作燃料,a2d2作助燃剂,产物环保无污染,写出二者反应的化学方程式。(6)、设计实验证明非金属性j>k:。16. 家中的食品、调味品、洗涤剂和药品等都含有化学物质,以下是胃药和加碘食盐的标签,回答下列问题。
(1)、单质e、f、g分别与足量的盐酸反应产生相同体积的气体,反应最快的是(填化学式),参与反应的e、f、g的质量比是。(2)、g和j形成的化合物溶液中滴加氨水至过量,看到的现象是。(3)、a与b形成的化合物M中a的质量分数为25%,写出该化合物M的结构式。(4)、h、i、j的简单氢化物的稳定性最弱的是(填化学式)。(5)、火箭发动机曾经利用c2a4作燃料,a2d2作助燃剂,产物环保无污染,写出二者反应的化学方程式。(6)、设计实验证明非金属性j>k:。16. 家中的食品、调味品、洗涤剂和药品等都含有化学物质,以下是胃药和加碘食盐的标签,回答下列问题。铝镁咀嚼片
【药品名】铝镁咀嚼片
【成分】氢氧化镁、氢氧化铝、二甲基硅油
【适应症】胃酸过多引起的胃痛、烧心等胃胀气的治疗
食用盐
【配料表】精制盐、碘酸钾
【碘含量(以计)】21mgkg-39mgkg
【保质期】36个月
(1)、标签中涉及到的元素Al在周期表中的位置是。(2)、标签中涉及到的元素位于第三周期的有种,原子半径由大到小的排序是。(3)、氢氧化铝治疗胃酸过多时,发生反应的化学方程式是。(4)、食用盐的主要成分为氯化钠,氯化钠含有的化学键是;碘酸钾在水溶液中的电离方程式是;碘酸钾和碘化钾在酸性溶液中能发生反应生成使淀粉变蓝的物质,写出该反应的离子方程式并用单线桥法标出电子转移的方向和数目。17. 为探索工业废料的再利用,某化学兴趣小组用含有铝、铁和铜等合金废料制取纯碱、氧化铝和绿矾(FeSO4·7H2O),其工艺流程如下图。
回答下列问题:
(1)、滤液1中含有的阴离子有。(2)、“反应1”中得到Al(OH)3的离子方程式是。(3)、滤液3长期露置于空气中可能会引入杂质(填离子符号),验证是否存在该杂质离子的灵敏试剂是(填试剂名称)。(4)、若有ag合金废料,热分解2得到的Al2O3的质量为bg,则合金废料中Al的质量分数是;Al与碱液的反应中氧化剂是 , 并写出该氧化剂的电子式是。18. DCCNa( )是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。实验室利用NaClO溶液和氰尿酸(C3H3N3O3)溶液反应制备DCCNa,实验装置如图所示:
)是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。实验室利用NaClO溶液和氰尿酸(C3H3N3O3)溶液反应制备DCCNa,实验装置如图所示:
已知:2NaClO+C3H3N3O3=NaC3N3OCl2↓+NaOH+H2O
回答下列问题:
(1)、盛装KMnO4的仪器名称是。(2)、甲中发生反应的化学方程式是;该反应的氧化剂和还原剂的物质的量之比是。(3)、试剂X是。(4)、NaClO溶液和氰尿酸(C3H3N3O3)溶液的反应是(填“吸热”或“放热”)反应。(5)、实验过程中通入一段时间氯气后,仍会不断的向丙中通入氯气,目的是。(6)、丁中可生成漂白液的离子方程式是;漂白液在空气中的漂白原理是(用文字描述)。