广东省清远市2023-2024学年高二上学期期末教学质量检测化学试卷
试卷更新日期:2024-02-01 类型:期末考试
一、选择题:本题共16小题,共44分.第1-10小题,每小题2分;第11~16小题,每小题4分.在每小题给出的四个选项中,只有一项是符合题目要求的.
-
1. 中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示:

已知几种物质中化学键的键能如表所示:
化学键
键能
463
496
436
138
若反应过程中分解了水,则下列说法不正确的是( )
A、总反应为 B、该反应的 C、过程Ⅰ吸收了能量 D、过程Ⅱ和过程Ⅲ都只有新化学键的形成2. 分解的能量变化曲线如图所示.下列有关判断不正确的是( ) A、该反应为吸热反应 B、过程Ⅰ使用了催化剂,加快了反应速率 C、过程Ⅱ逆反应的活化能 D、催化剂通过参与反应改变反应历程、改变反应的活化能来改变化学反应速率3. 某小组同学查到一份研究过氧化氢溶液与氢碘酸反应的实验资料,具体如下.
A、该反应为吸热反应 B、过程Ⅰ使用了催化剂,加快了反应速率 C、过程Ⅱ逆反应的活化能 D、催化剂通过参与反应改变反应历程、改变反应的活化能来改变化学反应速率3. 某小组同学查到一份研究过氧化氢溶液与氢碘酸反应的实验资料,具体如下.资料1:室温下,过氧化氢溶液可与氢碘酸反应;
资料2:碘单质溶于水后,溶液为棕黄色.
资料3:实验数据见下表.
实验编号
溶液
溶液
蒸馏水
温度/
浓度
体积
浓度
体积
体积
Ⅰ
0.1
1
0.1
1
8
25
Ⅱ
0.1
1
0.1
1
40
Ⅲ
0.1
1
0.1
6
25
下列说法正确的是( )
A、 B、实验原理为 C、若将实验Ⅱ温度调整为 , 溶液出现棕黄色的时间更短 D、对比上述实验数据,推测反应速率最快的是实验Ⅲ4. 一块铆有铁铆钉的铜板暴露在潮湿空气中的示意图如图,下列说法正确的是( ) A、铜板表面有气泡生成 B、在干燥空气中该铜板也容易腐蚀 C、铁铆钉表面的电极反应: D、一段时间后,向水膜滴加一滴酚酞溶液,出现浅红色5. 化学与社会、生活密切相关.下列生活现象与所述的化学知识没有关联的是( )
A、铜板表面有气泡生成 B、在干燥空气中该铜板也容易腐蚀 C、铁铆钉表面的电极反应: D、一段时间后,向水膜滴加一滴酚酞溶液,出现浅红色5. 化学与社会、生活密切相关.下列生活现象与所述的化学知识没有关联的是( )选项
生活现象
化学知识
小苏打作发酵剂
受热易分解
纯碱溶液不能保存在玻璃塞的试剂瓶中
高温下与反应
溶液可作焊接时的除锈剂
溶液呈酸性,能溶解铁锈
长期施用 , 土壤酸性增强
水解显酸性
A、A B、B C、C D、D6. 下列有关滴定实验说法正确的是( )



A.锥形瓶使用前需用待测液醋酸润洗
B.可用该滴定管量取一定体积的溶液
C.碱式滴定管滴定前要排气泡
D.滴定前后滴定管读数方式如图所示,则测得的结果偏大
A、A B、B C、C D、D7. 化学在生产中有广泛的应用.下列说法正确的是( )A、电解冶炼镁、铝通常电解和溶液 B、电解精炼铜时,阳极减少的质量和阴极增加的质量相等 C、电镀银时电解质溶液中保持不变 D、用外加电流法对钢铁进行防护时,钢铁应连接电源的正极8. 在水中存在溶解平衡: , 下列能使减少的是( )A、加入溶液 B、加入少量固体 C、加入溶液 D、加入固体9. 下列相关说法不能用勒夏特列原理解释的是( )A、加压能增大在水中的溶解度 B、升温可促进冰融化成水 C、对组成的平衡体系加压,颜色加深 D、大部分盐类水解符合“越稀越水解”的规律10. 相同状况下,将装有和空气的集气瓶分别按如图甲、乙两种方式放置,中间用玻璃板隔开,抽掉玻璃板后,下列现象预测和分析错误的是( )甲
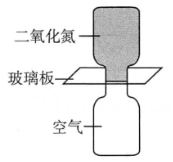 乙
乙
选项
现象预测
分析
A
甲盛的集气瓶气体颜色较快变浅
密度比空气大
B
乙盛空气的集气瓶出现红棕色
熵增的方向是自发的
C
经过足够长的时间,所有瓶中气体颜色相同
最终可以达到相同的平衡状态
D
所有集气瓶中气体颜色均变深
反应逆向移动
A、A B、B C、C D、D11. 活泼自由基与氧气的反应一直是关注的热点.自由基与反应过程的能量变化如图所示,下列说法正确的是( ) A、该反应为吸热反应 B、产物的稳定性: C、该历程中正反应的最大活化能 D、相同条件下,由中间产物转化为产物的速率:12. 部分弱电解质的电离常数如下表:
A、该反应为吸热反应 B、产物的稳定性: C、该历程中正反应的最大活化能 D、相同条件下,由中间产物转化为产物的速率:12. 部分弱电解质的电离常数如下表:弱电解质
电离常数
下列说法错误的是( )
A、结合的能力: B、 C、中和等体积、等的和消耗的量前者小于后者 D、时,反应的平衡常数约为13. 向一恒容密闭容器中加入和一定量的 , 发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是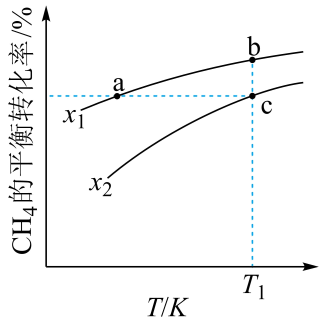 A、 B、反应速率: C、点a、b、c对应的平衡常数: D、反应温度为 , 当容器内压强不变时,反应达到平衡状态14. 时,在水中的沉淀溶解平衡曲线如图.时的 , 下列说法正确的是( )
A、 B、反应速率: C、点a、b、c对应的平衡常数: D、反应温度为 , 当容器内压强不变时,反应达到平衡状态14. 时,在水中的沉淀溶解平衡曲线如图.时的 , 下列说法正确的是( ) A、通过蒸发,可使溶液由点变化到点 B、图中点碳酸钙的结晶速率小于其溶解速率 C、在时,从转化为更容易实现 D、可将锅炉中的转化为 , 再用醋酸去除15. 是我国科学家最近开发的双功能催化剂,它能促进甲醇燃料电池(DMFC)放电.某学习小组设计甲醇燃料电池为电源利用膜技术原理和电化学原理制备绿色硝化剂 , 模拟装置如图所示.下列叙述正确的是( )
A、通过蒸发,可使溶液由点变化到点 B、图中点碳酸钙的结晶速率小于其溶解速率 C、在时,从转化为更容易实现 D、可将锅炉中的转化为 , 再用醋酸去除15. 是我国科学家最近开发的双功能催化剂,它能促进甲醇燃料电池(DMFC)放电.某学习小组设计甲醇燃料电池为电源利用膜技术原理和电化学原理制备绿色硝化剂 , 模拟装置如图所示.下列叙述正确的是( )
甲 乙
A、完全反应时理论上乙池可制备 B、工作时,甲池中由交换膜右侧向左侧迁移 C、阳极电极反应式为 D、在甲池中滴加少量稀硝酸,能降低极反应的活化能16. 乙醇是重要的有机化工原料,可由乙烯气相直接水合法制取,已知等物质的量的和的混合气体在一定的条件下反应: , 乙烯的平衡转化率与温度、压强的关系如图.下列说法不正确的是( )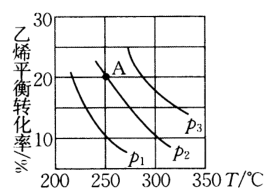 A、压强由小到大顺序为 B、当温度从升高到时,增大的倍数大于 C、A点混合气体中的体积分数为 D、若保持其他条件不变,将容器改为恒压密闭容器,则的平衡转化率将增大
A、压强由小到大顺序为 B、当温度从升高到时,增大的倍数大于 C、A点混合气体中的体积分数为 D、若保持其他条件不变,将容器改为恒压密闭容器,则的平衡转化率将增大二、非选择题:本题共4小题,共56分.
-
17. 用草酸及草酸盐的性质可测定人体血液中钙离子的浓度.方法如下:抽取的血液样品,加入足量的草酸铵溶液,可析出草酸钙沉淀,将此草酸钙沉淀洗涤后溶于足量强酸可得草酸溶液,然后用的酸性标准溶液滴定草酸溶液,根据消耗酸性标准溶液的体积即可测定血液样品中的浓度.已知草酸为二元弱酸.(1)、结合滴定实验原理,分析下列问题:
①酸性标准溶液滴定草酸溶液的离子方程式为;本实验(填“需要”或“不需要”)另加指示剂;如何判断滴定终点: .
②若消耗的酸性标准溶液为 , 则该血液样品中的浓度为 .
③下列操作会使测得的血液样品中的浓度偏高的是 .
A.滴定管未用标准溶液润洗 B.草酸钙沉淀洗涤不充分
C.滴定前仰视读数并记录数据 D.盛放草酸溶液的锥形瓶没有干燥
(2)、为了探究外因对酸性标准溶液和草酸溶液反应速率的影响,现有学习小组完成以下实验:向三只比色血中加入酸性标准溶液各 , 再向其中分别加入稀硫酸各 , 然后再分别加入的溶液 , 通过手持色度计和数据采集器测定溶液透光率随时间的变化曲线如图1所示.

图1 相同浓度与相同浓度溶液在不同酸度下的反应曲线
①由图1分析,你能得出的结论是 .
②以稀硫酸的变化曲线为例.前后曲线变化幅度不同的原因是 .
18. 湿法炼锌净化钴渣中含有和的单质及 , 可利用过硫酸钠氧化水解法实现钴的富集,同时分别回收锌、铜和铁元素,工艺流程如下:
该工艺条件下,有关金属离子开始沉淀和沉淀完全的见下表:
金属离子
开始沉淀的
1.9
7.5
7.7
沉淀完全的
3.2
9.0
9.2
已知:一种离子的浓度时已沉淀完全;的还原产物为 .
回答下列问题:
(1)、将净化钴渣研细的目的是 .(2)、浸渣的主要成分为(填化学式).(3)、钴属于铁系元素,性质与铁相似.根据流程可知:的还原性(填“强于”或“弱于”) .(4)、常温下,利用上述表格数据.计算的 . 如果滤液Ⅰ中浓度为 , 则“除铁”应控制的范围是 .(5)、氨水可代替沉钴工序中的 , 此时发生的主要反应的离子方程式为 .(6)、上述流程中____(填标号)可返回湿法炼锌系统,提高锌的利用率.A、浸渣 B、滤渣Ⅰ C、滤液Ⅱ D、滤渣Ⅱ19. (Ⅰ)环戊二烯( )是重要的有机化工原料,与人们的生活生产密切相关,广泛用于农药、橡胶、塑料等生产.试回答下列问题: (1)、已知反应:①
)是重要的有机化工原料,与人们的生活生产密切相关,广泛用于农药、橡胶、塑料等生产.试回答下列问题: (1)、已知反应:①
②
对于反应:③
 . (2)、某温度下,等物质的量的碘和环戊烯(
. (2)、某温度下,等物质的量的碘和环戊烯( )在刚性容器内仅发生反应③,起始总压为 , 平衡时总压增加了 , 环戊烯的平衡转化率为 , 该反应的平衡常数(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留三位有效数字).达到平衡后,保持不变,欲增加环戊烯的平衡转化率,可采取的措施有(填标号).
)在刚性容器内仅发生反应③,起始总压为 , 平衡时总压增加了 , 环戊烯的平衡转化率为 , 该反应的平衡常数(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留三位有效数字).达到平衡后,保持不变,欲增加环戊烯的平衡转化率,可采取的措施有(填标号).A.通入稀有气体 B.提高温度 C.增加环戊烯浓度 D.增加浓度
(3)、(Ⅱ)近年全国各地雾霾严重,为有效控制雾霾,各地积极采取措施改善大气质量.研究并有效控制空气中氨氧化物等污染物是一项重要而艰巨的工作.一定条件下,将与置于恒容密闭容器中发生反应: , 下列状态能说明该反应达到化学平衡的是____(填字母编号).
A、混合气体的密度保持不变 B、的转化率保持不变 C、和的物质的量之比保持不变 D、的消耗速率和的消耗速率相等(4)、已知反应 , 在不同条件时的体积分数随时间的变化如图1所示.根据图像可以判断曲线对应的下列反应条件中不同的是(填压强、温度、催化剂),理由是 .
图1
20. (Ⅰ)科学家积极探索新技术利用合成低碳烯烃:, 测得温度对的平衡转化率和催化剂催化效率的影响如图1所示,请回答:

图1(1)、上述由合成的反应在(填“高温”或“低温”)下自发进行.理由是 .(2)、在体积为的恒容密闭容器中,充入和 , 测得温度对的平衡转化率和催化剂催化效率的影响如图1所示.下列说法正确的是____.A、平衡常数大小: B、其他条件不变,若不使用催化剂.则时的平衡转化率可能位于点 C、图1中点时,乙烯的体积分数约为 D、压强或不变时均可证明化学反应已达到平衡状态(3)、(Ⅱ)利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响,反应历程的能量变化如图2所示.图2
 图3
图3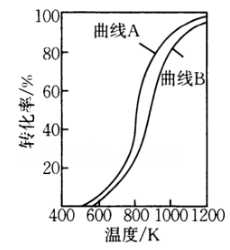
干重整反应的热化学方程式为(选用的关系式表示反应热),反应Ⅱ是(填“慢反应”或“快反应”).
(4)、在恒压条件下,等物质的量的和发生干重整反应时,各物质的平衡转化率随温度变化如图3所示.已知在干重整中还发生了副反应: , 则表示平衡转化率的是曲线(填“A”或“B”),判断的依据是 .