广东省深圳市光明区2023-2024学年高二上学期1月期末学业水平调研化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题:本题16小题,其中1-10小题,每小题2分,第11-16小题,每小题4分,共44分。在每小题给出的四个选项中,只有一个选项符合题目的要求。
-
1. 我国古代染坊常用“碱剂”来精炼丝绸,这种“碱剂”的主要成分是一种盐,向其水溶液中滴入酚酞试液后,溶液变红色,该“碱剂”的主要成分可能是( )A、食盐 B、烧碱 C、纯碱 D、胆矾2. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①石油 ②天然气 ③生物质能 ④氢能
A、①② B、③④ C、①③ D、②④3. 化学与人类生产、生活密切相关,下列叙述中正确的是( )A、明矾主要成分为 , 在净水中作絮凝剂和消毒剂 B、从石墨中剥离出的石墨烯薄片能导电,因此石墨烯是电解质 C、草木灰(主要成分)与氯化铵混合存放后使用,肥效更强 D、向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺4. 下列化学用语表示正确的是( )A、基态钠离子的电子排布图为 B、次氯酸的电子式为
C、含18个中子的氯原子的符号为
D、空间结构模型
B、次氯酸的电子式为
C、含18个中子的氯原子的符号为
D、空间结构模型 可以表示或
5. 下列物质属于强电解质,且溶于水时电离出的离子能使水的电离平衡向左移动的是( )A、 B、 C、 D、6. 金属腐蚀可分为化学腐蚀和电化学腐蚀。下列描述中属于电化学腐蚀的是( )A、高温下铁丝被氧气腐蚀 B、化工厂里的铁与氯气反应被腐蚀 C、铜铝电线接头处铝被腐蚀 D、铜板在氯化铁溶液中被腐蚀7. 为了除去酸性溶液中的 , 可在加热并搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量盐酸,这种试剂是( )A、 B、 C、 D、8. 劳动创造美好生活。下列选项中劳动项目与化学知识没有关联的是( )
可以表示或
5. 下列物质属于强电解质,且溶于水时电离出的离子能使水的电离平衡向左移动的是( )A、 B、 C、 D、6. 金属腐蚀可分为化学腐蚀和电化学腐蚀。下列描述中属于电化学腐蚀的是( )A、高温下铁丝被氧气腐蚀 B、化工厂里的铁与氯气反应被腐蚀 C、铜铝电线接头处铝被腐蚀 D、铜板在氯化铁溶液中被腐蚀7. 为了除去酸性溶液中的 , 可在加热并搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量盐酸,这种试剂是( )A、 B、 C、 D、8. 劳动创造美好生活。下列选项中劳动项目与化学知识没有关联的是( )选项
劳动项目
化学知识
A
电焊工焊接金属时用溶液除锈
受热易分解
B
护士用葡萄糖溶于蒸馏水配制葡萄糖注射液
葡萄糖和水都是极性分子,葡萄糖易溶于水
C
营业员将水果放在冰箱中保鲜
温度降低,反应速率减小
D
烟花燃放人员燃放焰火
电子从高能级向低能级跃迁时放出能量
A、A B、B C、C D、D9. 甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。丁和戊的最高价氧化物对应的水化物均为强酸。下列说法不正确的是( )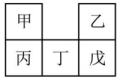 A、原子半径:丙>甲>乙 B、元素电负性:戊>丁>丙 C、氢化物的沸点:戊>乙 D、四个丙原子构成丙分子的空间结构模型是正四面体10. 设为阿伏加德罗常数的值,下列说法正确的是( )A、(重水)含有的电子数为 B、在精炼铜的过程中,当阴极生成时,转移电子数为 C、溶液中阴阳离子数目之和为 D、一定条件下,与充分反应后,产物的分子数为11. 常温下,有关下列四种溶液的叙述中,正确的是( )
A、原子半径:丙>甲>乙 B、元素电负性:戊>丁>丙 C、氢化物的沸点:戊>乙 D、四个丙原子构成丙分子的空间结构模型是正四面体10. 设为阿伏加德罗常数的值,下列说法正确的是( )A、(重水)含有的电子数为 B、在精炼铜的过程中,当阴极生成时,转移电子数为 C、溶液中阴阳离子数目之和为 D、一定条件下,与充分反应后,产物的分子数为11. 常温下,有关下列四种溶液的叙述中,正确的是( )编号
①
②
③
④
溶液
氨水
溶液
醋酸
盐酸
11
11
3
3
A、在溶液①和②中分别加入适量的氯化铵晶体后,两溶液的均增大 B、分别取上述四种溶液稀释到 , 稀释后溶液的:①②③④ C、将溶液②、③等体积混合,所得溶液存在 D、将溶液②与溶液④混合,若所得溶液的 , 体积为 , 则12. 下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
工业用电解熔融制备金属钠
金属钠的还原性很强
B
在高温和高压条件下,和在催化剂作用下合成氨
升高温度、增大压强均可使反应物分子中活化分子的百分数增加
C
氨气作冷库中的制冷剂
氨气极易溶于水
D
溶液导电性比同浓度醋酸强
溶液的比醋酸的高
A、A B、B C、C D、D13. 光照条件下,甲烷氯化反应是一个自由基型的取代反应。在链转移反应过程中,经历两步反应(和分别表示甲基和氯原子)。反应1:;反应2:。各物质的相对能量变化如图所示。下列说法不正确的是( )
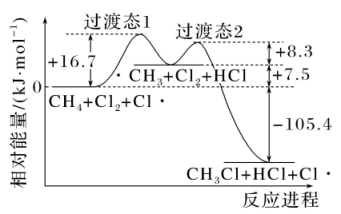 A、链转移反应的反应速率由第1步反应决定 B、反应1的活化能 C、由图可知,过渡态结构的稳定性: D、链转移反应的反应热14. 实验是学习化学的重要途径。下列所示装置图能达到实验目的的是( )
A、链转移反应的反应速率由第1步反应决定 B、反应1的活化能 C、由图可知,过渡态结构的稳定性: D、链转移反应的反应热14. 实验是学习化学的重要途径。下列所示装置图能达到实验目的的是( )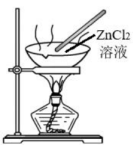
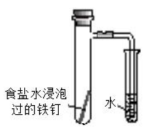
A.制备晶体
B.探究铁的吸氧腐蚀
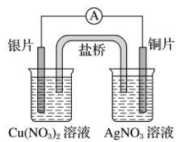
C.铜银原电池装置
D.测定中和反应的反应热
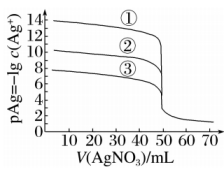
A、A B、B C、C D、D15. 时,用的溶液分别滴定体积均为且浓度均为的及溶液,其滴定曲线如图。已知:时,及溶度积常数依次为 , 下列说法正确的是( )
 A、 B、滴定曲线①表示的滴定曲线 C、滴定时,可加入少量的作指示剂 D、当溶液滴定至时,溶液中16. 臭氧在烟气脱硝中的反应为。向的恒容密闭容器中充入和充分反应,平衡时,的体积分数随温度变化关系如图所示。下列说法正确的( )
A、 B、滴定曲线①表示的滴定曲线 C、滴定时,可加入少量的作指示剂 D、当溶液滴定至时,溶液中16. 臭氧在烟气脱硝中的反应为。向的恒容密闭容器中充入和充分反应,平衡时,的体积分数随温度变化关系如图所示。下列说法正确的( )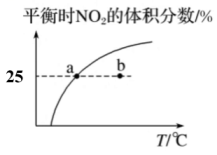 A、该反应的 B、点时,的体积分数为 C、点时, D、正反应速率的大小:点点
A、该反应的 B、点时,的体积分数为 C、点时, D、正反应速率的大小:点点二、非选择题:本题共4个小题,每小题14分,共56分。
-
17. 氨基乙酸铜被广泛应用于染料、涂料、塑料和电池等领域,其化学式为 , 结构如图所示。
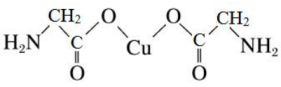 (1)、基态原子的电子排布式为 , 位于元素周期表中区元素(填“s、p、d、ds和f”其中一个)。(2)、氨基乙酸铜中碳原子的杂化方式有、 , 该分子中有个键。(3)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态原子,其价电子自旋磁量子数的代数和为。(4)、原子的第一电离能比原子的(填“大”或“小”),其原因是。(5)、氨基乙酸铜可由碳酸铜、氯乙酸、乙二胺等制得,碳酸铜中的VSEPR模型名称为 , 氯乙酸的酸性大于乙酸的原因是。18. 工业上常用溶液除去烟气中的 , 某小组设计如图所示装置(a、b电极均为石墨),对除硫后产物溶液进行电解,制得和循环再生。
(1)、基态原子的电子排布式为 , 位于元素周期表中区元素(填“s、p、d、ds和f”其中一个)。(2)、氨基乙酸铜中碳原子的杂化方式有、 , 该分子中有个键。(3)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态原子,其价电子自旋磁量子数的代数和为。(4)、原子的第一电离能比原子的(填“大”或“小”),其原因是。(5)、氨基乙酸铜可由碳酸铜、氯乙酸、乙二胺等制得,碳酸铜中的VSEPR模型名称为 , 氯乙酸的酸性大于乙酸的原因是。18. 工业上常用溶液除去烟气中的 , 某小组设计如图所示装置(a、b电极均为石墨),对除硫后产物溶液进行电解,制得和循环再生。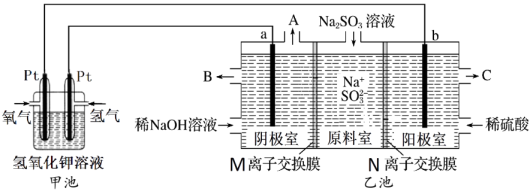 (1)、甲池中通入氧气的一端为极(填“正”或“负”),写出通入氢气的电极反应式。(2)、①乙池中阳极室口流出的是较浓的 , 则为(填“阳”或“阴”)离子交换膜,写出阳极室的电极反应式。
(1)、甲池中通入氧气的一端为极(填“正”或“负”),写出通入氢气的电极反应式。(2)、①乙池中阳极室口流出的是较浓的 , 则为(填“阳”或“阴”)离子交换膜,写出阳极室的电极反应式。②阴极室中溶液浓度增大的原因是:阴极室中水电离出的(用离子符号或化学式填空,下同)得电子反应生成 , 其浓度减小,使溶液中浓度增大,为了保持阴极室溶液中阴阳离子电荷平衡,从原料室向阴极室迁移,从而使阴极室中的浓度增大。
(3)、在标准状况下,若甲池中有参加反应,理论上乙池可生成。(4)、比能量是指参与反应单位质量的电极材料所能输出电能的多少,电池输出电能与反应的电子转移数目成正比。理论上,与均作负极时,它们的比能量之比为。19. 某小组设计实验测定可逆反应的平衡常数并探究影响化学平衡移动的因素。已知:常温下,反应(白色)和(红色)的平衡常数分别为、。
(1)、Ⅰ.配制溶液
用绿矾配制 , 为防止配制过程中变质,常加入少量的和(填试剂名称)。(2)、Ⅱ.测定的平衡常数常温下,将溶液和溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液X。
用溶液滴定测定滤液中浓度。
①量取滤液X。用(填“酸式”或“碱式”)滴定管取一定体积滤液X于锥形瓶中,若滴定管未用滤液润洗,对浓度测定结果是(填“偏高”、“偏低”或“无影响”)。
②用溶液滴定滤液中。滴定终点的现象为:当最后半滴溶液滴入后, , 此时为滴定终点。重复三次实验,实验数据如下表所示。根据表中数据计算出的滤液中的平均浓度是(用含的计算式表示)。
实验编号
滤液的体积
滴定前溶液的体积读数
滴定后溶液的体积读数
1
10.00
3.10
23.06
2
10.00
0.50
20.50
3
10.00
2.36
22.40
(3)、计算。若测得滤液中 , 则该反应的平衡常数。(用含的计算式表示)(4)、Ⅲ.探究稀释对该反应平衡移动方向的影响常温下,用溶液和溶液,按下表配制总体积相同的系列溶液,测定平衡时浓度,记录数据。
实验编号
ⅰ
10
10
0
ⅱ
4
① , 。
②和存在的关系是(用含和的不等式表示),该关系可以作为判断稀释对该反应平衡移动方向影响的证据。
20. 氮及其化合物在科研及生产中均有重要的应用。(1)、转化为是工业制取硝酸的重要一步,一定条件下,与发生催化氧化反应时,可发生不同反应:反应Ⅰ:
反应Ⅱ:
①该条件下,与反应生成的热化学方程式为.
②一定条件下的密闭容器中发生反应Ⅰ,平衡时混合物中的物质的量分数在不同温度(、、)随压强的变化如图所示。
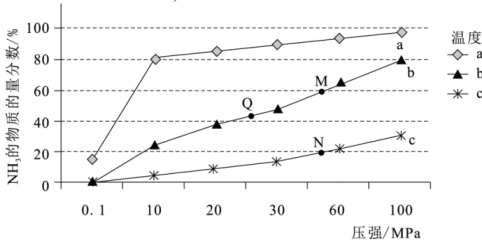
则曲线对应的温度是 , 点平衡常数的大小关系是。
(2)、已知: , 将气体充入的恒容密闭容器中,控制反应温度为随(时间)变化曲线如图。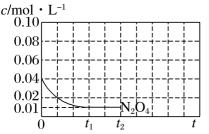
①下列各项中能说明该反应已达到化学平衡状态的是。
A.容器内压强不变 B.
C.混合气体的颜色不变 D.混合气体的密度不变
②时刻反应达到平衡,若 , 计算内的平均反应速率 , 此时的转化率为。
③反应温度时,画出时段,随变化曲线。保持其他条件不变,改变反应温度为 , 再次画出时段,随变化趋势的曲线。(在答题卡方框中完成)