广东省深圳市宝安区2023-2024学年高一上学期1月调研测试期末化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题(下列各题均只有一个合理答案,请将合理答案的序号涂在答题卡上,填在其它地方无效。本题共20小题,每小题3分,共60分。)
-
1. 我国古代文物蕴含着瑰丽的中华历史文化,下列文物主要成分属于合金的是( )




A.兰亭集序书法
B.马王堆素纱禅衣
C.三星堆青铜面具
D.唐兽首玛瑙杯
A、A B、B C、C D、D2. 近年我国在科技领域取得了举世瞩目的成就,下列成就所涉及的化学知识正确的是( )A、北斗三号卫星搭载了精密计时的铷原子钟,铷是金属元素 B、长征系列火箭所用的然料中,为氧化性气体 C、深海一号开采深海的天然气可作清洁燃料,实现零碳排放 D、火星全球影像彩图显示了火星表土颜色,表土中赤铁矿主要成分为3. 化学与生产、生活密切相关。下列物质的应用中,涉及到氧化还原反应的是( )A、用醋酸除去水垢(主要成分) B、含消毒剂用于自来水杀菌消毒 C、用盐酸去除铁锈(主要成分) D、用生石灰作某些包装食品的干燥剂4. 分类是认识元素及其化合物的方法之一。下列有关物质分类的说法,正确的是( )A、纯净物:漂白粉、氯化铁 B、电解质:碳酸钠、食盐水 C、碱性氧化物:氧化铁、氧化钠 D、强酸:次氯酸、硫酸5. 化学处处呈现美。下列描述涉及的化学知识不正确的是( )A、茉莉花的芳香扑鼻而来,体现了分子是运动的 B、晨雾中的光束如梦如幻,是丁达尔效应带来的美景 C、甲烷分子为正四面体结构,四个氢原子完美对称 D、烟花燃放时呈现出五彩缤纷的火花,是锂、钠、铜等金属被氧化所致6. 下列物质中,含共价键的离子化合物是( )A、 B、 C、 D、7. 嫦娥五号返回舱带回的月壤中含有大量的 , 是清洁、安全的核聚变发电的燃料,地球上氦元素主要以的形式存在。下列说法正确的是( )A、的核外电子数为3 B、和互为同位素 C、的化学性质很活泼 D、发生核聚变时吸收大量热量8. 配制溶液,部分实验操作如图所示:
下列说法不正确的是( )
A、实验中用到的玻璃仪器有量筒、容量瓶、烧杯、玻璃棒、胶头滴管等 B、容量瓶用蒸馏水洗涤后无需干燥可使用 C、上述实验操作步骤的正确顺序为②①④①③ D、定容时,仰视容量瓶的刻度线,使配得的溶液浓度偏高9. 劳动创造美好的生活。下列劳动项目与所述的化学知识没有关联的是( )选项
劳动项目
化学知识
A
环保工程师用熟石灰处理酸性废水
熟石灰具有碱性
B
技术人员开发高端耐腐蚀镀铝钢板
铝能形成致密氧化膜
C
面包师用小苏打作发泡剂烘焙面包
可与酸反应
D
工人将模具干燥后再注入熔融钢水
在高温下铁与会反应
A、A B、B C、C D、D10. 在无色溶液中能大量共存的一组离子是( )A、 B、 C、 D、11. 我国南北朝梁代陶弘景在其《本草经集注》条目的“灌钢法”中,记载我国古代冶炼钢铁的方法,将生铁(含碳量约2%)和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法正确的是( )A、生铁的熔点比纯铁高 B、在我国使用最早的合金是生铁 C、“灌钢法”冶炼制得钢过程中提高了生铁中的含碳量 D、钢的硬度比铁大的原因是钢含碳原子,使铁原子层之间的相对滑动变得困难12. 下图为多电子原子的电子层模型示意图。有关描述不正确的是( ) A、K层电子的能量高于L层 B、核外电子从K层开始填充 C、L层最多能容纳8个电子 D、原子由原子核与核外电子构成13. 对实验现象及其内涵的建构能发展学生的宏观辨识和微观探析素养。下列实验对应的离子方程式书写正确的是( )A、铝片插入溶液,析出红色物质: B、稀中滴加溶液,产生白色沉淀: C、在大理石上滴稀盐酸,产生气泡: D、溶液中滴加氨水,产生红褐色沉淀:14. 检验菠菜中铁元素的实验操作有:①剪碎菠菜,研磨;2取少量滤液,滴加稀硝酸;③加入蒸馏水,搅拌,过滤;④滴加几滴硫氰化钾溶液,振荡,观察。正确操作顺序为( )A、③①④② B、①②③④ C、②①④③ D、①③②④15. 下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )
A、K层电子的能量高于L层 B、核外电子从K层开始填充 C、L层最多能容纳8个电子 D、原子由原子核与核外电子构成13. 对实验现象及其内涵的建构能发展学生的宏观辨识和微观探析素养。下列实验对应的离子方程式书写正确的是( )A、铝片插入溶液,析出红色物质: B、稀中滴加溶液,产生白色沉淀: C、在大理石上滴稀盐酸,产生气泡: D、溶液中滴加氨水,产生红褐色沉淀:14. 检验菠菜中铁元素的实验操作有:①剪碎菠菜,研磨;2取少量滤液,滴加稀硝酸;③加入蒸馏水,搅拌,过滤;④滴加几滴硫氰化钾溶液,振荡,观察。正确操作顺序为( )A、③①④② B、①②③④ C、②①④③ D、①③②④15. 下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )选项
物质(括号内为杂质)
除杂试剂
A
溶液
溶液
B
溶液
溶液、稀盐酸
C
、浓硫酸
D
粉粉
溶液
A、A B、B C、C D、D16. 侯德榜制碱法涉及的物质有、饱和食盐水、等。设为阿伏加德罗常数的值,下列叙述正确的是( )A、含有的原子数目为 B、含有离子数目为 C、含有分子数目为 D、常温常压下,含有的原子数目为17. 下列陈述Ⅰ和陈述Ⅱ均正确,且有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
溶液作腐蚀液除去覆铜板上不需要的铜
的还原性比的强
B
的酸性比的强
的非金属性比的强
C
加热条件下,比更容易分解
的非金属性比的强
D
溶于水后能导电
是电解质
A、A B、B C、C D、D18. 下列实验中,不能测定出和的混合物中质量分数的是( )A、取混合物充分加热,质量减少 B、取混合物与足量溶液充分反应,得到溶液 C、取混合物与足量稀盐酸充分反应,加热,蒸干、灼烧,得到固体 D、取混合物与足量稀硫酸反应,逸出气体干燥后用碱石灰吸收,质量增加19. 甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。戊的最高价氧化物对应的水化物为强酸。下列说法不正确的是( ) A、原子半径:丁>戊>乙 B、非金属性:戊>丁>丙 C、甲的最高价氧化物对应的水化物一定是强酸 D、丙的最高价氧化物对应的水化物一定能与强碱反应20. 可用于制备一种新型、多功能绿色水处理剂高铁酸钠 , 主要反应:。下列说法不正确的是( )A、具有强氧化性,能杀菌消毒 B、该反应中,还原剂是和 C、由上述反应可得,的氧化性比的强 D、上述反应中,理论上若有电子发生转移,可生成
A、原子半径:丁>戊>乙 B、非金属性:戊>丁>丙 C、甲的最高价氧化物对应的水化物一定是强酸 D、丙的最高价氧化物对应的水化物一定能与强碱反应20. 可用于制备一种新型、多功能绿色水处理剂高铁酸钠 , 主要反应:。下列说法不正确的是( )A、具有强氧化性,能杀菌消毒 B、该反应中,还原剂是和 C、由上述反应可得,的氧化性比的强 D、上述反应中,理论上若有电子发生转移,可生成二、非选择题(本题共4个小题,共40分。)
-
21. 四种短周期主族元素a、b、c和d的原子序数依次增大,a和c同主族;a原子最外层电子数是次外层电子数3倍,且a与b原子最外层电子数之和等于d原子最外层电子数;常温下,d的单质是一种黄绿色的气体。
回答下列问题(答题时涉及a~d字母,要用对应的元素符号或化学式表示):
(1)、d位于元素周期表中第三周期第族,b和d形成化合物的电子式为。(2)、原子半径:ab(填“>”或“<”,下同),气态氢化物的稳定性:ac。(3)、写出b的单质与水反应的化学方程式;b的单质在空气中点燃生成固体甲,甲呈淡黄色,甲与反应的化学方程式为。(4)、将的单质通入与形成的化合物溶液中,溶液出现浑浊,该反应的离子方程式为。22. 铝土矿的主要成分是 , 此外还含有少量等杂质,某工厂用铝土矿制氧化铝的流程如下图。
已知是酸性氧化物。
回答下列问题:
(1)、“酸浸”步骤中,发生反应的离子方程式为。(2)、流程中“操作”的名称是 , “滤渣1”的主要成分是(填化学式)。(3)、“除铁”步骤中,发生反应的离子化学方程式为。(4)、“沉铝”步骤中,通过量不能用过量盐酸代替的原因是 , “滤液b”中的阴离子主要有、(填离子符号)。23. 某化学小组用“84消毒液”(主要成分是)制备氯气并探究其性质,进行如图所示的实验(a~d中均为浸有相应试液的棉花,夹持装置省略)。已知:的氧化性比的强。
回答下列问题:
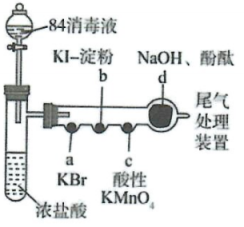 (1)、18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分是)与浓盐酸混合后加热制备了氯气,该浓盐股反应的化学方程式为 , 对比舍勒与该小组两种制备氯气方法的反应条件,推测的氧化性比的(填“强”或“弱”)(2)、处变为橙色,说明的氧化性比的强,该反应的离子方程式为。(3)、处变为蓝色,不能说明的氧化性比的强,其理由是。(4)、处褪色,推测使酸性溶液褪色的物质可能是(填化学式)(5)、实验一段时间后,观察到处红色褪去。对于红色褪去的原因,甲同学认为可能是氯气与水反应生成的酸中和所致,乙同学认为可能是氯气与水反应生成的强氧化性所致;他们进行了如下实验:取出处褪色后的棉花置于烧杯中,向棉花加入 , 若观察到 , 说明同学的观点是正确。24. 价类图(化合价—物质类别)是学习元素化合物性质的视角之一,下列是铁元素的价类图,其中f、g都是铁的氯化物。
(1)、18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分是)与浓盐酸混合后加热制备了氯气,该浓盐股反应的化学方程式为 , 对比舍勒与该小组两种制备氯气方法的反应条件,推测的氧化性比的(填“强”或“弱”)(2)、处变为橙色,说明的氧化性比的强,该反应的离子方程式为。(3)、处变为蓝色,不能说明的氧化性比的强,其理由是。(4)、处褪色,推测使酸性溶液褪色的物质可能是(填化学式)(5)、实验一段时间后,观察到处红色褪去。对于红色褪去的原因,甲同学认为可能是氯气与水反应生成的酸中和所致,乙同学认为可能是氯气与水反应生成的强氧化性所致;他们进行了如下实验:取出处褪色后的棉花置于烧杯中,向棉花加入 , 若观察到 , 说明同学的观点是正确。24. 价类图(化合价—物质类别)是学习元素化合物性质的视角之一,下列是铁元素的价类图,其中f、g都是铁的氯化物。回答下列问题:
 (1)、c的化学式为 , 能与(填试剂名称)反应生成g。(2)、在一定条件下,a、f、g三种物质间可以互相转化。加热条件下,a与(填化学式)反应生成g;f溶液与(填化学式)反应生成a;向g溶液滴入淀粉溶液,溶液变蓝,写出g溶液与溶液反应的离子方程式。(3)、e在潮湿的空气中容易被氧化生成d,该反应的化学方程式为。(4)、硫酸铁铵广泛用于生活饮用水、工业循环水的净化处理等。称取样品,将其溶于水配制成溶液,分成两等份,向其中一份溶液中加入足量溶液,过滤洗涤得到沉淀:向另一份溶液中加入溶液,恰好完全反应。则该硫酸铁铵中为。
(1)、c的化学式为 , 能与(填试剂名称)反应生成g。(2)、在一定条件下,a、f、g三种物质间可以互相转化。加热条件下,a与(填化学式)反应生成g;f溶液与(填化学式)反应生成a;向g溶液滴入淀粉溶液,溶液变蓝,写出g溶液与溶液反应的离子方程式。(3)、e在潮湿的空气中容易被氧化生成d,该反应的化学方程式为。(4)、硫酸铁铵广泛用于生活饮用水、工业循环水的净化处理等。称取样品,将其溶于水配制成溶液,分成两等份,向其中一份溶液中加入足量溶液,过滤洗涤得到沉淀:向另一份溶液中加入溶液,恰好完全反应。则该硫酸铁铵中为。