广东省汕头市潮阳区2023-2024学年高二上学期期末教学质量监测化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题:本题共16小题,共44分,1-10题每小题2分,共20分,11-16题每小题4分,共24分。每小题只有一个选项符合要求。
-
1. 潮汕咸菜风味独特,备受海内外潮汕人的青睐,下列风味特色产生的原因与化学变化无关的是:( )
 A、咸:食盐渗透入芥菜中 B、酸:营养成分转化为乳酸 C、鲜:蛋白质水解产生氨基酸 D、香:蛋白质等转化为酯类物质2. 科教兴国,科技改变生活。下列说法正确的是( )A、天宫课堂“五环实验”,向碳酸钠溶液中滴加甲基橙溶液后变成红色 B、“运-20”机身采用钨碳合金熔合材料,属于无机非金属材料 C、T型碳是中科院预言的一种碳的新型结构,其与金刚石互为同素异形体 D、新能源车飞速发展,因为电池可以把化学能全部转化为电能3. 化学在生产、生活和科学研究中有着广泛的应用。下列说法正确的是( )A、铝制餐具可以长时间存放任何食物 B、硫酸工业中,SO2催化氧化不采用高压,是因为压强对SO2转化率无影响 C、港口处的铁柱容易发生反应Fe-3e-=Fe3+ , 继而形成铁锈 D、食醋可用于水壶除垢4. “水是生存之本、文明之源。”下列关于水处理方法叙述错误的是( )A、用明矾作净水剂,吸附沉降水中悬浮物 B、用石灰处理工业废水中的酸 C、可用FeS作为沉淀剂除去废水中Cu2+、Ag+等重金属离子 D、把核废水直接排放到大海5. 下列说法能证明HF是弱电解质的是( )A、HF溶于水能导电 B、常温下测得0.1 mol·L-1HF溶液的pH=2 C、与等浓度NaOH溶液刚好完全反应,两者消耗的体积之比为1:1 D、往HF溶液中滴加石蕊,溶液显红色6. 乙醇可以被氧化为乙醛,其能量变化如图所示,下列叙述正确的是( )
A、咸:食盐渗透入芥菜中 B、酸:营养成分转化为乳酸 C、鲜:蛋白质水解产生氨基酸 D、香:蛋白质等转化为酯类物质2. 科教兴国,科技改变生活。下列说法正确的是( )A、天宫课堂“五环实验”,向碳酸钠溶液中滴加甲基橙溶液后变成红色 B、“运-20”机身采用钨碳合金熔合材料,属于无机非金属材料 C、T型碳是中科院预言的一种碳的新型结构,其与金刚石互为同素异形体 D、新能源车飞速发展,因为电池可以把化学能全部转化为电能3. 化学在生产、生活和科学研究中有着广泛的应用。下列说法正确的是( )A、铝制餐具可以长时间存放任何食物 B、硫酸工业中,SO2催化氧化不采用高压,是因为压强对SO2转化率无影响 C、港口处的铁柱容易发生反应Fe-3e-=Fe3+ , 继而形成铁锈 D、食醋可用于水壶除垢4. “水是生存之本、文明之源。”下列关于水处理方法叙述错误的是( )A、用明矾作净水剂,吸附沉降水中悬浮物 B、用石灰处理工业废水中的酸 C、可用FeS作为沉淀剂除去废水中Cu2+、Ag+等重金属离子 D、把核废水直接排放到大海5. 下列说法能证明HF是弱电解质的是( )A、HF溶于水能导电 B、常温下测得0.1 mol·L-1HF溶液的pH=2 C、与等浓度NaOH溶液刚好完全反应,两者消耗的体积之比为1:1 D、往HF溶液中滴加石蕊,溶液显红色6. 乙醇可以被氧化为乙醛,其能量变化如图所示,下列叙述正确的是( )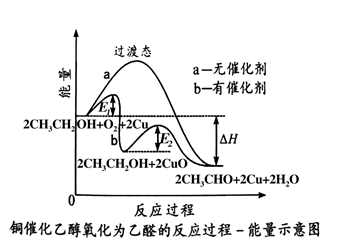 A、该反应是吸热反应 B、使用催化剂可以降低该反应的反应热 C、有催化剂作用下反应分两步进行,且第一步较快 D、有催化剂作用下的反应,E1为正反应的活化能,E2为逆反应的活化能7. 将CO2转化为甲醇是其资源化利用的重要途径之一,发生的反应为CO2(g)+3H2(g) CH3OH (g) + H2O(g) ΔH<0,下列叙述错误的是( )A、平衡后加入少量CO2 , 平衡正向移动,H2的转化率增大 B、平衡后升高温度,平衡逆向移动,平衡常数减小 C、当容器中CH3OH的体积分数不再变化时,反应达到平衡状态 D、平衡后增大压强,平衡正向移动,平衡常数增大8. 下列有关实验装置进行的相应实验,不能达到实验目的的是( )
A、该反应是吸热反应 B、使用催化剂可以降低该反应的反应热 C、有催化剂作用下反应分两步进行,且第一步较快 D、有催化剂作用下的反应,E1为正反应的活化能,E2为逆反应的活化能7. 将CO2转化为甲醇是其资源化利用的重要途径之一,发生的反应为CO2(g)+3H2(g) CH3OH (g) + H2O(g) ΔH<0,下列叙述错误的是( )A、平衡后加入少量CO2 , 平衡正向移动,H2的转化率增大 B、平衡后升高温度,平衡逆向移动,平衡常数减小 C、当容器中CH3OH的体积分数不再变化时,反应达到平衡状态 D、平衡后增大压强,平衡正向移动,平衡常数增大8. 下列有关实验装置进行的相应实验,不能达到实验目的的是( )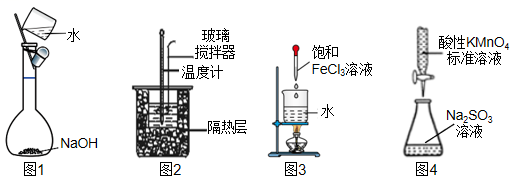 A、图1配制0.10 mol·L-1NaOH溶液 B、图2装置测量HCl与NaOH反应的中和热 C、图3制备Fe(OH)3胶体 D、图4用酸性KMnO4溶液滴定Na2SO3溶液9. 某有机物空间填充模型为
A、图1配制0.10 mol·L-1NaOH溶液 B、图2装置测量HCl与NaOH反应的中和热 C、图3制备Fe(OH)3胶体 D、图4用酸性KMnO4溶液滴定Na2SO3溶液9. 某有机物空间填充模型为 , 3种原子的原子序数均小于10。关于该有机物的说法正确的是( ) A、含有两个官能团 B、能与溴水发生加成反应 C、能与碳酸钠反应生成CO2 D、难溶于水10. 宏观—微观—符号是化学的三重表征,下列有关化学符号表征正确的是( )A、电解精炼Cu时,阴极发生反应:Cu2++2e-═ Cu B、过氧化钠常做供氧剂,发生反应的离子方程式:2O22-+2CO 2═ 2CO32-+O2↑ C、氢气燃烧热的热化学方程式为:H2(g)+ O2(g)= H2O(g) ΔH=-285.8 kJ·mol-1 D、AlCl3溶液显酸性,是因为发生了反应:Al3++3H2O ═Al(OH)3↓+3H+11. 根据下列实验操作和现象所得到的结论正确的是( )
, 3种原子的原子序数均小于10。关于该有机物的说法正确的是( ) A、含有两个官能团 B、能与溴水发生加成反应 C、能与碳酸钠反应生成CO2 D、难溶于水10. 宏观—微观—符号是化学的三重表征,下列有关化学符号表征正确的是( )A、电解精炼Cu时,阴极发生反应:Cu2++2e-═ Cu B、过氧化钠常做供氧剂,发生反应的离子方程式:2O22-+2CO 2═ 2CO32-+O2↑ C、氢气燃烧热的热化学方程式为:H2(g)+ O2(g)= H2O(g) ΔH=-285.8 kJ·mol-1 D、AlCl3溶液显酸性,是因为发生了反应:Al3++3H2O ═Al(OH)3↓+3H+11. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
结论
A
常温下,用pH计分别测定同浓度的CH3COONH4溶液和NaCl溶液的pH,pH均为7
两溶液中水的电离程度相同
B
常温下,用pH计分别测定相同浓度的NaClO溶液和CH3COONa溶液的酸碱性,NaClO溶液pH较大
酸性:HClO < CH3COOH
C
室温下,向 FeCl3溶液中滴加少量 KI 溶液,再滴加几滴淀粉溶液,溶液变蓝色。
Fe3+的还原性比 I2的强
D
向10 mL 0.2 mol/L NaOH溶液中滴加2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,生成红褐色沉淀
相同温度下Ksp:
Mg(OH)2>Fe(OH)3
A、A B、B C、C D、D12. 我国科学家在月球上发现一种硅酸盐矿物 , 该物质含有X、Y、Z、W、E五种主族元素,原子序数依次增大且均不大于20,X、W为非金属元素,Y、Z、E为金属元素,Y的最高正化合价为+1价,Z和E同族。下列说法正确的是( )A、原子半径:E>Y>Z>X>W B、X和Y可形成共价化合物 C、最高价氧化物对应的水化物的碱性: Z < E D、简单气态氢化物稳定性:W>X13. 一种用于季节性过敏性鼻炎的抗组胺药,合成原料之一的分子结构简式如图所示,关于该化合物说法正确的是( )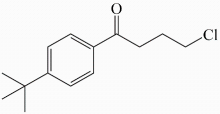 A、该化合物能发生加成反应、取代反应 B、属于醇类物质 C、该化合物有三种官能团 D、该化合物的分子式为C11H13OCl14. 某钠离子电池的负极材料为NaxCy , 正极材料为Na2Mn[Fe(CN)6],其充放电过程是Na+在正负极间的镶嵌与脱嵌(图中箭头指示电子的转移方向)。下列说法正确的是( )
A、该化合物能发生加成反应、取代反应 B、属于醇类物质 C、该化合物有三种官能团 D、该化合物的分子式为C11H13OCl14. 某钠离子电池的负极材料为NaxCy , 正极材料为Na2Mn[Fe(CN)6],其充放电过程是Na+在正负极间的镶嵌与脱嵌(图中箭头指示电子的转移方向)。下列说法正确的是( )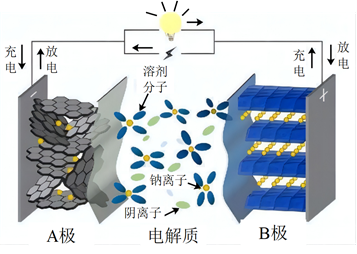 A、放电时,电子的流向为A→外电路→B→电解质溶液→A B、该电池可以选择NaOH溶液为电解质 C、充电时,Na+从B极脱嵌,在A极嵌入 D、放电时,B极的电极反应式为:NaxCy- xe-═ xNa++ Cy15. 长征系列运载火箭是中国自行研制的航天运载工具,偏二甲肼(C2H8N2)是提供动力的燃料之一,发生的反应为:C2H8N2+2N2O4=3N2+2CO2+4H2O。下列说法错误的是( )A、N2的电子式: B、1mol N2和H2O(g)混合物中含有的化学键数目为3NA C、标准状况下,生成22.4L CO2时转移的电子数为8NA D、46gN2O4中含有的电子数为23NA16. 25℃时,满足c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸和醋酸钠混合溶液中,c(CH3COOH)与pH的关系如图所示。下列叙述错误的是( )
A、放电时,电子的流向为A→外电路→B→电解质溶液→A B、该电池可以选择NaOH溶液为电解质 C、充电时,Na+从B极脱嵌,在A极嵌入 D、放电时,B极的电极反应式为:NaxCy- xe-═ xNa++ Cy15. 长征系列运载火箭是中国自行研制的航天运载工具,偏二甲肼(C2H8N2)是提供动力的燃料之一,发生的反应为:C2H8N2+2N2O4=3N2+2CO2+4H2O。下列说法错误的是( )A、N2的电子式: B、1mol N2和H2O(g)混合物中含有的化学键数目为3NA C、标准状况下,生成22.4L CO2时转移的电子数为8NA D、46gN2O4中含有的电子数为23NA16. 25℃时,满足c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸和醋酸钠混合溶液中,c(CH3COOH)与pH的关系如图所示。下列叙述错误的是( )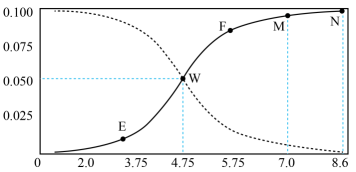 A、该温度下醋酸的电离常数Ka为10-4.75mol/L B、E点所表示的溶液中:c(CH3COO-)>c(Na+)> c(H+)>c(OH-) C、在图中各点中N点水的电离程度最大 D、F点所表示的溶液中:c(Na+)+c(H+)+c(CH3COOH)=0.1 mol/L
A、该温度下醋酸的电离常数Ka为10-4.75mol/L B、E点所表示的溶液中:c(CH3COO-)>c(Na+)> c(H+)>c(OH-) C、在图中各点中N点水的电离程度最大 D、F点所表示的溶液中:c(Na+)+c(H+)+c(CH3COOH)=0.1 mol/L二、非选择题:本题共4道小题,每道题14分,满分56分,请考生根据要求做答。
-
17. H2O2是一种常用的绿色氧化试剂,在化学研究中应用广泛。以下是某研究小组探究影响(H2O2溶液分解)反应速率部分因素的相关实验数据。
实验
序号
30%H2O2溶
液体积/mLH2O溶液体积/mL
温度℃
0.2mol/LFeCl3溶液/mL
收集氧气的体积/mL
反应所需
的时间/s①
3
2
20
2
10
175.65
②
5
0
20
2
10
138.32
③
5
0
35
2
10
89.71
④
5
0
55
2
10
30.96
(1)、通过实验①和②对比可知,;从实验(填实验序号)对比可知,温度越高,反应的速率越快。(2)、实验过程中还发现实验②中的现象为:刚开始时,溶液迅速变红棕色 , 并有较多气泡产生;一段时间后,反应变缓,溶液颜色明显变浅;溶液颜色变深的原因是。(3)、已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:已知反应ii的离子方程式为:2Fe2++ 2H++ H2O2= 2Fe3++ 2H2O;① 反应i离子方程式为。
② 某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴溶液,产生蓝色沉淀。
③ 另有同学用pH传感器测得的pH-时间图像中各段pH变化如图,加入FeCl3时pH值骤降至a点,是因为配制、保存FeCl3时需加入(填名称)抑制其水解。由图像pH值的变化可证明反应分两步进行,且反应速率反应i(填“>”、“=”或“<”)反应ii。
 18. 废旧锌锰电池回收处理可实现资源的再利用,初步处理后的废料中含有MnO2、MnOOH、Zn(OH)2、及Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
18. 废旧锌锰电池回收处理可实现资源的再利用,初步处理后的废料中含有MnO2、MnOOH、Zn(OH)2、及Fe等,用该废料制备Zn和MnO2的一种工艺流程如下: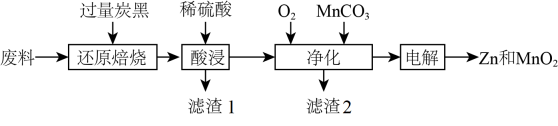
资料a:Mn的金属活动性强于Fe;
Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pHMn(OH)2
Zn(OH)2
Fe(OH)3
开始沉淀时
8.1
6.2
1.9
完全沉淀时
10.1
8.2
3.2
回答下列问题:
(1)、“还原焙烧”是为了把Mn元素转化为MnO,请写出MnOOH发生反应的化学方程式。(2)、为了提高“酸浸”的速率,可以采取的措施有;滤渣1的主要成分为。(3)、 “净化”时通入O2的目的是 , 加入MnCO3时必须控制pH范围为;检验净化后的溶液中是否含有Fe元素的试剂是。(4)、 “电解”时MnO2在(填“阳”或“阴”)极生成,其电极反应式为 。19. 氢能将在实现“双碳”目标中起到重要作用。回答下列问题:(1)、乙醇水蒸气重整制氢反应是将乙醇与水按比例混合,最终转化为H2以及CO2的过程。发生的反应有:I.C2H5OH(g)+H2O(g)2CO(g)+4H2(g)ΔH1=+255.7 kJ·mol-1
II.CO(g)+H2O(g) CO2(g)+H2(g)ΔH2=-41.2 kJ·mol-1
III.C2H5OH(g)+3H2O(g)2CO2(g)+6H2(g)ΔH3

① ΔH3= kJ·mol-1
② 在恒容反应炉内测得平衡时,乙醇转化率、H2产率和含碳产物体积分数与反应温度的关系如图所示,则最佳反应温度是 , 理由是。
③下列能判断反应I在恒容条件下达到平衡状态的是 。

A.混合气体的平均摩尔质量不变
B.单位时间内断开2molO-H键同时断开4molH-H
C.体系的压强不变
D.CO与H2的体积比不变
(2)、压强为100kPa下,C2H5OH(g)和H2O (g)投料比1∶3发生上述反应,平衡时CO2和CO的选择性、乙醇的转化率随温
度的变化曲线如图所示[已知:CO的选择性]
① 表示C2H5OH转化率的曲线是(填标号);
② 573K时,只考虑反应I和反应III,生成氢气的体积分数为(保留2位有效数字);
(3)、乙醇水蒸气重整制氢反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表
则催化剂X(填“优于”或“劣于”)催化剂Y,理由是。
20. 人体每天通过食物和代谢产生酸性或碱性物质,但是人体却能维持一定的酸碱平衡,这是因为人体的肺、血液缓冲系统、肾彼此合作,共同完成酸碱平衡,当酸碱失衡时,会干扰代谢活动,严重时危及生命。表1为正常人血气分析部分结果,回答下列问题: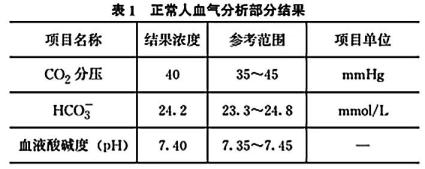 (1)、人体血液呈弱碱性的原因是(用离子方程式表示)。(2)、从平衡角度解释人体血液pH稳定的原因。(3)、当人体代谢性酸中毒严重时,需要血液透析治疗。
(1)、人体血液呈弱碱性的原因是(用离子方程式表示)。(2)、从平衡角度解释人体血液pH稳定的原因。(3)、当人体代谢性酸中毒严重时,需要血液透析治疗。① 预测“酸中毒”时表1“结果浓度”有可能会有哪些变化:。
② 配制某浓缩透析液需要用到的溶质有:0.7mol/LNaCl,0.01mol/LKCl,0.075mol/LCaCl2和0.15mol/LNaHCO3 , 直接混合各溶质会有沉淀(填化学式)和气体(填化学式)生成。
③ 医院透析液分两瓶存放,使用时稀释再混合。其中一瓶为NaHCO3 , 下列说法正确的是。
A. c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B. c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
C. c(CO32-)>c(H2CO3)
D. c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
(4)、常温下,反应CaCO3(s)+2F-(aq)CaF2(s) +CO32-(aq)的平衡常数K=。[Ksp(CaCO3)=3.4×10-9 , Ksp(CaF2)=4×10-11]