新疆乌鲁木齐101中2023-2024学年高二上学期期末化学模拟试卷
试卷更新日期:2024-02-01 类型:期末考试
一、选择题(共20小题,满分40分,每小题2分)
-
1. Fe与稀H2SO4反应制取氢气,下列措施一定能使生成氢气的速率加快的是( )A、增加铁的量 B、增大硫酸的浓度 C、加热 D、增大压强2. 利用浓差电池制备高铁电池的重要材料Na2FeO4 , 反应原理如图所示。下列说法错误的是( )
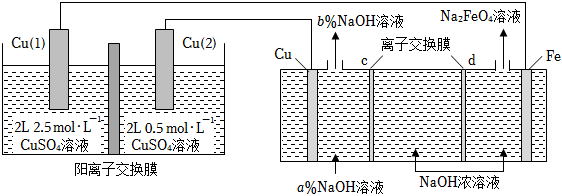 A、a<b B、c为阳离子交换膜,当Cu电极产生1mol气体时,有2molNa+通过阳离子交换膜 C、浓差电池放电过程中,Cu(Ⅰ)电极上的电极反应为Cu﹣2e﹣=Cu2+ D、Fe电极的电极反应为:Fe+8OH﹣﹣6e﹣═FeO42﹣+4H2O3. 硫酸甲酯(CH3OSO3H)是制造染料的甲基化试剂,在有H2O存在的条件下,CH3OH和SO3的反应历程如图所示(分子间的作用力用“…”表示)。下列说法错误的是( )
A、a<b B、c为阳离子交换膜,当Cu电极产生1mol气体时,有2molNa+通过阳离子交换膜 C、浓差电池放电过程中,Cu(Ⅰ)电极上的电极反应为Cu﹣2e﹣=Cu2+ D、Fe电极的电极反应为:Fe+8OH﹣﹣6e﹣═FeO42﹣+4H2O3. 硫酸甲酯(CH3OSO3H)是制造染料的甲基化试剂,在有H2O存在的条件下,CH3OH和SO3的反应历程如图所示(分子间的作用力用“…”表示)。下列说法错误的是( )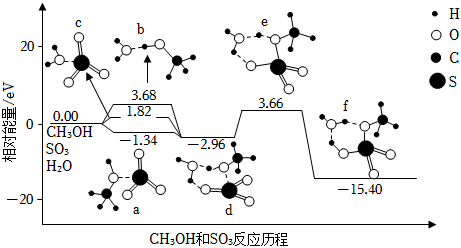 A、CH3OH与SO3反应的△H<0 B、a、b、c三种中间产物中,a最稳定 C、该反应最高能垒(活化能)为19.06eV D、由d转化为f过程中,有硫氧键的断裂和生成4. 下列说法不正确的是( )
A、CH3OH与SO3反应的△H<0 B、a、b、c三种中间产物中,a最稳定 C、该反应最高能垒(活化能)为19.06eV D、由d转化为f过程中,有硫氧键的断裂和生成4. 下列说法不正确的是( )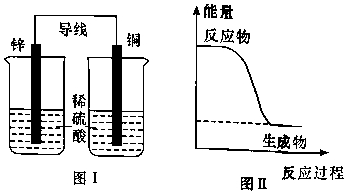 A、图Ⅰ所示装置不能形成原电池 B、铅蓄电池为二次电池,充电时,铅电极接外接电源的正极 C、燃料电池是一种将燃料和氧化剂的化学能直接转化为电能的装置 D、反应NH3(g)+HCl(g)═NH4Cl(s)的能量变化如图Ⅱ所示,则该反应在低温下能自发进行5. 某化学反应X+Y→Z分两步进行:①X→M;②M+Y→Z。其能量变化如图所示。下列说法正确的是( )
A、图Ⅰ所示装置不能形成原电池 B、铅蓄电池为二次电池,充电时,铅电极接外接电源的正极 C、燃料电池是一种将燃料和氧化剂的化学能直接转化为电能的装置 D、反应NH3(g)+HCl(g)═NH4Cl(s)的能量变化如图Ⅱ所示,则该反应在低温下能自发进行5. 某化学反应X+Y→Z分两步进行:①X→M;②M+Y→Z。其能量变化如图所示。下列说法正确的是( )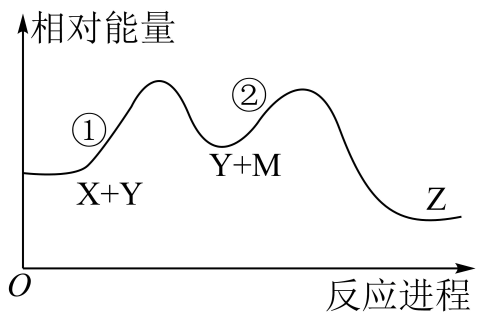 A、M是总反应的催化剂 B、总反应是理想的绿色化学反应 C、反应①②和总反应都是放热反应 D、反应物(X和Y)的总能量低于产物(Z)的总能量6. 绿色电源“二甲醚﹣氧气燃料电池”的工作原理如图,所示下列说法正确的是( )
A、M是总反应的催化剂 B、总反应是理想的绿色化学反应 C、反应①②和总反应都是放热反应 D、反应物(X和Y)的总能量低于产物(Z)的总能量6. 绿色电源“二甲醚﹣氧气燃料电池”的工作原理如图,所示下列说法正确的是( )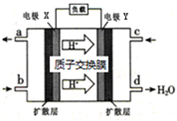 A、氧气应从c处通入,电极Y上发生的反应为O2+4e﹣+2H2O═4OH﹣ B、电池在放电过程中,电极X周围溶液的pH增大 C、二甲醚应从b处加入,电极X上发生的反应为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+ D、当该电池向外电路提供2mol电子时消耗O2约为22.4L7. 国家能源局发布2021年前三季度全国光伏发电建设运行情况,前三季度新增并网容量2555.6万千瓦,下列如图为光伏并网发电装置,甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],其工作原理如图所示,下列叙述中不正确的是( )
A、氧气应从c处通入,电极Y上发生的反应为O2+4e﹣+2H2O═4OH﹣ B、电池在放电过程中,电极X周围溶液的pH增大 C、二甲醚应从b处加入,电极X上发生的反应为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+ D、当该电池向外电路提供2mol电子时消耗O2约为22.4L7. 国家能源局发布2021年前三季度全国光伏发电建设运行情况,前三季度新增并网容量2555.6万千瓦,下列如图为光伏并网发电装置,甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],其工作原理如图所示,下列叙述中不正确的是( ) A、光伏并网发电装置是利用原电池原理,图中N型半导体为负极,P型半导体为正极 B、a极电极反应式:2(CH3)4N++2H2O+2e﹣=2(CH3)4NOH+H2↑ C、制备18.2g(CH3)4NOH,两极共产生4.48L气体(标准状况) D、c、e为阳离子交换膜,d均为阴离子交换膜8. 下列说法正确的是( )A、增大反应物浓度可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 C、升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 D、催化剂能增大单位体积内活化分子的百分数,使平衡转化率增大9. 化学与社会、生活密切相关,下列说法正确的是( )A、氢氧化铝、碳酸钠常用作胃酸中和剂 B、水泥和沙子都属于建筑材料中的硅酸盐产品 C、胆矾可用于杀菌消毒,也可作食品防腐剂 D、治理雾霾的有效方法是从源头上控制形成雾霾的污染物10. 某小组为研究电化学原理,设计如图装置.下列叙述正确的是( )
A、光伏并网发电装置是利用原电池原理,图中N型半导体为负极,P型半导体为正极 B、a极电极反应式:2(CH3)4N++2H2O+2e﹣=2(CH3)4NOH+H2↑ C、制备18.2g(CH3)4NOH,两极共产生4.48L气体(标准状况) D、c、e为阳离子交换膜,d均为阴离子交换膜8. 下列说法正确的是( )A、增大反应物浓度可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 C、升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 D、催化剂能增大单位体积内活化分子的百分数,使平衡转化率增大9. 化学与社会、生活密切相关,下列说法正确的是( )A、氢氧化铝、碳酸钠常用作胃酸中和剂 B、水泥和沙子都属于建筑材料中的硅酸盐产品 C、胆矾可用于杀菌消毒,也可作食品防腐剂 D、治理雾霾的有效方法是从源头上控制形成雾霾的污染物10. 某小组为研究电化学原理,设计如图装置.下列叙述正确的是( ) A、a和b用导线连接时,铁片上会有金属铜析出 B、a和b用导线连接时,铜片上发生的反应为:Cu2+﹣2e﹣=Cu C、无论a和b是否连接,铁片均会溶解 D、无论a和b是否连接,铁片上发生的反应都是:Fe﹣3e﹣=Fe3+11. 苯的亲电取代反应分两步进行,可表示
A、a和b用导线连接时,铁片上会有金属铜析出 B、a和b用导线连接时,铜片上发生的反应为:Cu2+﹣2e﹣=Cu C、无论a和b是否连接,铁片均会溶解 D、无论a和b是否连接,铁片上发生的反应都是:Fe﹣3e﹣=Fe3+11. 苯的亲电取代反应分两步进行,可表示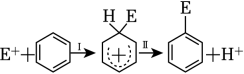 , 苯的亲电取代反应进程和能量的关系如图,下列说法错误的是( )
, 苯的亲电取代反应进程和能量的关系如图,下列说法错误的是( )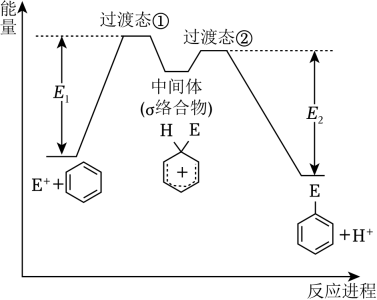 A、反应过程中,环上碳原子的杂化类型发生了变化 B、反应速率:Ⅰ<Ⅱ C、平均能量:中间体>反应物 D、E1与E2的差值为总反应的焓变12. 若要在铁片上镀银,下列叙述中错误的是( )
A、反应过程中,环上碳原子的杂化类型发生了变化 B、反应速率:Ⅰ<Ⅱ C、平均能量:中间体>反应物 D、E1与E2的差值为总反应的焓变12. 若要在铁片上镀银,下列叙述中错误的是( )①将铁片接在电源的正极上
②将银片接在电源的正极上
③在铁片上发生的反应是:Ag++e﹣═Ag
④在银片上发生的反应是:4OH﹣﹣4e﹣═O2↑+2H2O
⑤需用硫酸铁溶液为电镀液
⑥需用硝酸银溶液为电镀液
A、①③⑥ B、②③⑥ C、①④⑤ D、②③④⑥13. 下列说法错误的是( )A、需要加热才能发生的反应一定是吸热反应 B、在热化学方程式中无论反应物还是生成物均必须标明聚集状态 C、焓变小于0而熵变大于0的反应肯定是自发的 D、轮船水线以下的船体上嵌入一定量的锌块可减缓海水对轮船的腐蚀14. 如图,甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。下列说法正确的是( ) A、甲池通入CH3OH的电极反应式为CH3OH+6e﹣+2H2O=CO32﹣+8H+ B、甲池中消耗224mL(标准状况)O2 , 此时丙池中理论上产生1.16g固体 C、反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 D、若将乙池电解质溶液换成AgNO3溶液,则可以实现在石墨棒上镀银15. 在下图烧杯中均盛有0.1mol/LNaCl溶液,其中铁片最易被腐蚀的是( )A、
A、甲池通入CH3OH的电极反应式为CH3OH+6e﹣+2H2O=CO32﹣+8H+ B、甲池中消耗224mL(标准状况)O2 , 此时丙池中理论上产生1.16g固体 C、反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 D、若将乙池电解质溶液换成AgNO3溶液,则可以实现在石墨棒上镀银15. 在下图烧杯中均盛有0.1mol/LNaCl溶液,其中铁片最易被腐蚀的是( )A、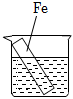 B、
B、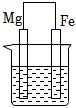 C、
C、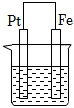 D、
D、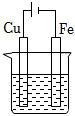 16. 铅酸电池是一种可充电电池,其放电时的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O。如图所示,利用铅酸电池电解Na2SO4溶液(a、b均为石墨电极),可以制得H2、O2、较浓的H2SO4和NaOH溶液。下列说法正确的是( )
16. 铅酸电池是一种可充电电池,其放电时的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O。如图所示,利用铅酸电池电解Na2SO4溶液(a、b均为石墨电极),可以制得H2、O2、较浓的H2SO4和NaOH溶液。下列说法正确的是( ) A、铝酸电池放电一段时间后,正、负极的质量均增加 B、N和M溶液分别为稀H2SO4和稀NaOH溶液 C、a电极的电极反应式为2H2O﹣4e﹣═O2↑+4H+ D、当电路中有1mol电子通过时,b电极收集到的O2体积为5.6L17. 可逆反应N2+3H2⇌2NH3(各物质均为气体)的正、逆反应速率可用单位时间内各反应物或生成物浓度的变化来表示.下列各关系中能说明该反应已达到平衡状态的是( )A、3v正(N2)=v正(H2) B、v正(N2)=v逆(NH3) C、2 v正(H2)=3 v逆(NH3) D、2v逆(NH3)=3 v正(H2)18. 下列说法中正确的是( )A、钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为BaCO3而排出 B、珊瑚虫从周围海水中获取Ca2+和HCO3﹣ , 经反应形成石灰石(CaCO3)外壳,逐渐形成珊瑚 C、水中的Mg(HCO3)2、Ca(HCO3)2 , 受热易分解生成难溶性的MgCO3、CaCO3 , 故水垢的主要成分是MgCO3、CaCO3 D、使用含氟牙膏预防龋齿利用了盐类水解的原理19. 乙醛酸(OHCCOOH)是合成名贵高档香料乙基香兰素的原料之一,可用草酸(HOOCCOOH)电解制备,装置如图所示.下列说法不正确的是( )
A、铝酸电池放电一段时间后,正、负极的质量均增加 B、N和M溶液分别为稀H2SO4和稀NaOH溶液 C、a电极的电极反应式为2H2O﹣4e﹣═O2↑+4H+ D、当电路中有1mol电子通过时,b电极收集到的O2体积为5.6L17. 可逆反应N2+3H2⇌2NH3(各物质均为气体)的正、逆反应速率可用单位时间内各反应物或生成物浓度的变化来表示.下列各关系中能说明该反应已达到平衡状态的是( )A、3v正(N2)=v正(H2) B、v正(N2)=v逆(NH3) C、2 v正(H2)=3 v逆(NH3) D、2v逆(NH3)=3 v正(H2)18. 下列说法中正确的是( )A、钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为BaCO3而排出 B、珊瑚虫从周围海水中获取Ca2+和HCO3﹣ , 经反应形成石灰石(CaCO3)外壳,逐渐形成珊瑚 C、水中的Mg(HCO3)2、Ca(HCO3)2 , 受热易分解生成难溶性的MgCO3、CaCO3 , 故水垢的主要成分是MgCO3、CaCO3 D、使用含氟牙膏预防龋齿利用了盐类水解的原理19. 乙醛酸(OHCCOOH)是合成名贵高档香料乙基香兰素的原料之一,可用草酸(HOOCCOOH)电解制备,装置如图所示.下列说法不正确的是( )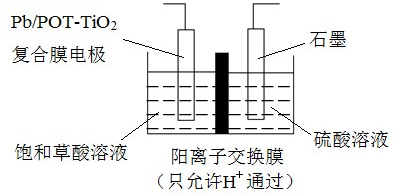 A、电解时石墨电极应与直流电源的正极相连 B、阴极反应式为:HOOCCOOH+2H++2e﹣═OHCCOOH+H2O C、电解时石墨电极上有O2放出 D、电解一段时间后,硫酸溶液的pH不变化20. 熔融状态下,Na和FeCl2能组成可充电电池(装置如图所示),反应原理为:2Na+FeCl2Fe+2NaCl下列关于该电池的说法正确的是( )
A、电解时石墨电极应与直流电源的正极相连 B、阴极反应式为:HOOCCOOH+2H++2e﹣═OHCCOOH+H2O C、电解时石墨电极上有O2放出 D、电解一段时间后,硫酸溶液的pH不变化20. 熔融状态下,Na和FeCl2能组成可充电电池(装置如图所示),反应原理为:2Na+FeCl2Fe+2NaCl下列关于该电池的说法正确的是( )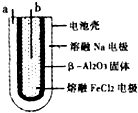 A、放电时,a为正极,b为负极 B、放电时,负极反应为:Fe2++2e﹣=Fe C、充电时,a接外电源正极 D、充电时,b极处发生氧化反应
A、放电时,a为正极,b为负极 B、放电时,负极反应为:Fe2++2e﹣=Fe C、充电时,a接外电源正极 D、充电时,b极处发生氧化反应二、解答题(共1小题,满分3分,每小题3分)
-
21. 电池种类丰富,发展飞速,应用广泛,为我们的生产和生活带来了非常大的便利。(1)、某兴趣小组设计了如图所示的原电池装置,该电池的负极为 , 正极的电极反应式为 , 盐桥中装有含氯化钾的琼脂,其中K+移向溶液 [填“Fe2(SO4)3”或“CuSO4”]。
 (2)、装置中所用到的硫酸铜是一种常用试剂,该小组尝试用以下两种方案制备硫酸铜。
(2)、装置中所用到的硫酸铜是一种常用试剂,该小组尝试用以下两种方案制备硫酸铜。方案一:直接用铜和浓硫酸制备硫酸铜;
方案二:将铜和银同时浸泡在稀硫酸中,不断通入氧气,一段时间后可以获得硫酸铜。
①写出方案一的化学方程式;与方案二相比,该方案的不足之处是 、(至少写出2种)。
②写出方案二的电极反应式:正极:、负极:。
(3)、甲醇是重要的化工原料,又可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的电极反应式为 ;若线路中转移3mol电子,则上述CH3OH燃料电池,消耗的CH3OH的质量为 g。
(4)、某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法正确的是 ____(单项选择)。 A、放电时,正极的电极反应式为Fe2O3+6Li++6e﹣═2Fe+3Li2O B、该电池可以用水溶液做电解质溶液 C、放电时,Fe作电池的负极,Fe2O3作电池的正极 D、充电完成后,电池被磁铁吸引
A、放电时,正极的电极反应式为Fe2O3+6Li++6e﹣═2Fe+3Li2O B、该电池可以用水溶液做电解质溶液 C、放电时,Fe作电池的负极,Fe2O3作电池的正极 D、充电完成后,电池被磁铁吸引三、解答题(共2小题,满分6分,每小题3分)
-
22. 环己酮(
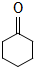 )是重要的化工原料。实验室氧化环己醇制备环己酮的流程如图:
)是重要的化工原料。实验室氧化环己醇制备环己酮的流程如图: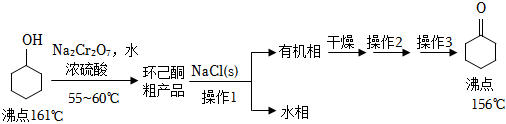
回答下列问题:
(1)、Ⅰ.环己酮粗品的制备
对环己醇氧化前的正确操作顺序是 (填写序号)。①加入药品
②检验装置气密性
③连接仪器
(2)、有机实验一般不使用酒精灯加热,而是使用电热套进行加热,原因是 。硫酸浓度较大或温度过高时都会产生的烃类副产物是 。为了防止水分和产物的大量挥发,需采取的措施除控制加热温度外,还可以加装的仪器名称是 。(3)、薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别将反应不同时间后的溶在反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。
该实验条件下较合适的反应时间是 min。反应结束后,溶液中仍有过量的重铬酸盐,可加入适量草酸除去,该反应的氧化产物为 。
(4)、Ⅱ.环己酮粗品的精制操作1用到的最佳玻璃仪器有 (选填下列仪器序号)。水相用乙醚分两次萃取,萃取液与有机相合并,这样做的目的是 。
 (5)、无水硫酸钠粉末干燥有机相后,形成Na2SO4•xH2O晶块,操作2、操作3依次是 、。(6)、本次实验恢复室温,0.050mol环己醇原料最终得到4.0mL纯品(密度为0.95g•cm﹣3),则环己酮的产率为 (保留3位有效数字)。23. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
(5)、无水硫酸钠粉末干燥有机相后,形成Na2SO4•xH2O晶块,操作2、操作3依次是 、。(6)、本次实验恢复室温,0.050mol环己醇原料最终得到4.0mL纯品(密度为0.95g•cm﹣3),则环己酮的产率为 (保留3位有效数字)。23. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。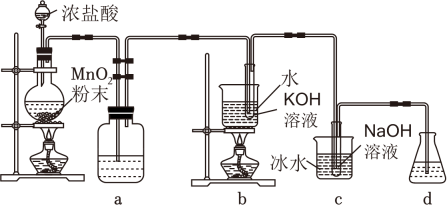
请回答下列问题:
(1)、盛放浓盐酸的仪器名称是 , a的作用为 。若一共有4.48L(标准状况)Cl2生成,反应中转移电子的数目为 。(2)、b中采用的加热方式的优点为 , b中反应的化学方程式为 。(3)、c中采用冰水浴冷却的目的是 。(4)、反应结束后,取出b中试管,经冷却结晶, , 洗涤,干燥,得到KClO3晶体。(5)、取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管KClO3溶液颜色不变;2号试管NaClO溶液变为棕色,加入CCl4振荡,静置后CCl4层显 色。可知该条件下NaClO的氧化能力 KClO3(填“大于”或“小于”)。四、推断题(共1小题,满分3分,每小题3分)
-
24. 某兴趣小组对无机盐X (仅含三种短周期元素)开展探究实验。
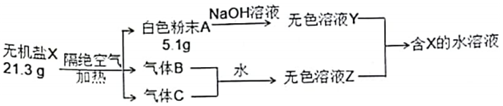
其中:A、B、C均为纯净物,白色粉末A难溶于水,B为红棕色气体。生成的B和C气体恰好与水完全反应(无气体剩余)生成溶液Z。请回答:
(1)、组成X的3种元素是 (填元素符号),X的化学式是 。(2)、写出X隔绝空气加热分解的化学方程式是 。(3)、写出溶液Y和溶液Z反应生成X的离子方程式是 。(4)、某同学探究B与Na2O2的反应,提出2种假设:①B氧化Na2O2 , 反应生成一种盐和一种气体单质
②Na2O2氧化B,反应只生成一种盐。
请设计实验证明 。
-