吉林省通化市梅河口市2023-2024学年高三上学期1月期末考试化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、单选题(共45分)
-
1. 历史文物或古文学的描述中均蕴含着化学知识,下列说法正确的是( )A、商代的后母戊鼎属于青铜制品,青铜是一种合金 B、“浮梁巧烧瓷”描述的是我国驰名于世的陶瓷,陶瓷的主要成分是二氧化硅 C、“绚丽丝绸云涌动,霓裳歌舞美仙姿”中“丝绸”的主要成分是纤维素 D、敦煌莫高窟壁画中绿色颜料的主要成分是氧化铁2. 下列除杂试剂或操作不正确的是(括号内的物质为杂质)( )A、NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加盐酸调pH至中性 B、KNO3溶液(AgNO3):加过量盐酸,再加NaOH溶液调pH至中性 C、BaSO4(BaCO3):加足量稀盐酸后过滤、洗涤、干燥 D、NaHCO3溶液(Na2CO3):通入足量CO2气体充分反应3. 在体积为V L的密闭容器中通入a mol CO和b mol O2 , 点燃充分反应后容器内碳原子数和氧原子数之比为( )A、a:b B、a:2b C、a:(a+2b) D、a:2(a+b)4. 下列透明溶液中,能大量共存的离子组是( )A、、、、 B、、、、 C、、、、 D、、、、5. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、4.6 g Na与含0.1 mol HCl的稀盐酸充分反应,转移电子数目为0.1NA B、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA C、常温下,14克C2H4和C3H6混合气体所含的原子数为3NA D、等质量的1H218O与D216O,所含中子数前者大6. 下列说法中错误的是( )A、根据水的沸点高于氟化氢,推断分子间氢键数目: B、根据推电子基团种类不同,推断酸性: C、根据核外电子数不同,推断核外电子空间运动状态种类: D、根据中心原子电负性不同,推断键角:7. 某立方晶系的锑钾合金可作为钾离子电池的电极材料,下图表示晶胞.下列说法中错误的是( )
 A、该晶胞的体积为 B、和原子数之比为 C、与最邻近的原子数为4 D、该晶胞的俯视图为
A、该晶胞的体积为 B、和原子数之比为 C、与最邻近的原子数为4 D、该晶胞的俯视图为 8. 近日,清华大学等重点高校为解决中国“芯”——半导体芯片,成立了“芯片学院”.某小组拟在实验室制造硅,其流程如下图.
8. 近日,清华大学等重点高校为解决中国“芯”——半导体芯片,成立了“芯片学院”.某小组拟在实验室制造硅,其流程如下图.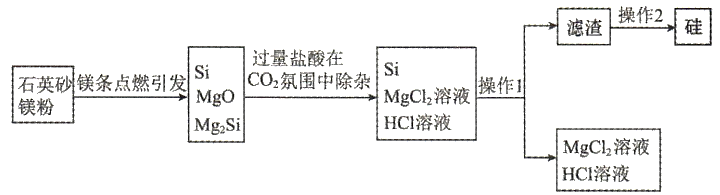
已知:
下列说法中错误的是( )
A、点燃镁条引发反应的过程中,涉及两种晶体类型的变化 B、氛围是为了阻止被二次氧化和自燃 C、操作2为用去离子水洗涤并烘干 D、镁粉生成和的混合物,转移电子9. 下列实验装置能够达到实验目的的是( ) A、图a测定醋酸的浓度 B、图b由溶液制取无水 C、探究压强对平衡的影响 D、图d验证保护了10. 2023年星恒电源发布“超钠F1”开启钠电在电动车上产业化元年.该二次电池的电极材料为(普鲁士白)和(嵌钠硬碳).下列说法中错误的是( )
A、图a测定醋酸的浓度 B、图b由溶液制取无水 C、探究压强对平衡的影响 D、图d验证保护了10. 2023年星恒电源发布“超钠F1”开启钠电在电动车上产业化元年.该二次电池的电极材料为(普鲁士白)和(嵌钠硬碳).下列说法中错误的是( ) A、放电时,左边电极电势高 B、放电时,负极的电极反应式可表示为: C、充电时,电路中每转移电子,阳极质量增加 D、比能量:锂离子电池高于钠离子电池11. 下列实验设计、现象和结论都正确的是( )
A、放电时,左边电极电势高 B、放电时,负极的电极反应式可表示为: C、充电时,电路中每转移电子,阳极质量增加 D、比能量:锂离子电池高于钠离子电池11. 下列实验设计、现象和结论都正确的是( )选项
实验操作及现象
实验结论
A
取少量样品溶于水,加入溶液,再加入足量盐酸,产生白色沉淀
原样品已变质
B
向某溶液中滴加浓盐酸,将产生气体通入石蕊试液,溶液先变红后褪色
溶液中含有或
C
向溶有的溶液中通入气体X,出现白色沉淀
气体X不一定是氧化性气体
D
在某固体试样加水后的溶液中,滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体
该固体试样中不可能存在
A、A B、B C、C D、D12. 以含钴废渣(主要成分为CoO和Co2O3 , 含少量 Al2O3和 ZnO)为原料制备锂电池的电极材料CoCO3的工艺流程如图:
下列说法不正确的是( )
A、通入SO2发生反应的离子方程式: B、除铝时加入Na2CO3溶液可以促进 Al3+ 的水解 C、若萃取剂的总量一定,则一次加入萃取比分多次加入萃取效果更好 D、将含Na2CO3的溶液缓慢滴加到Co2+溶液中沉钴,目的是防止产生 Co(OH)213. 通过理论计算发现,CH2=CH-C≡CH与HBr发生加成反应时,通过不同的路径都可以生成有机物④,其反应过程及相对能量变化如下图所示。下列说法不正确的是( )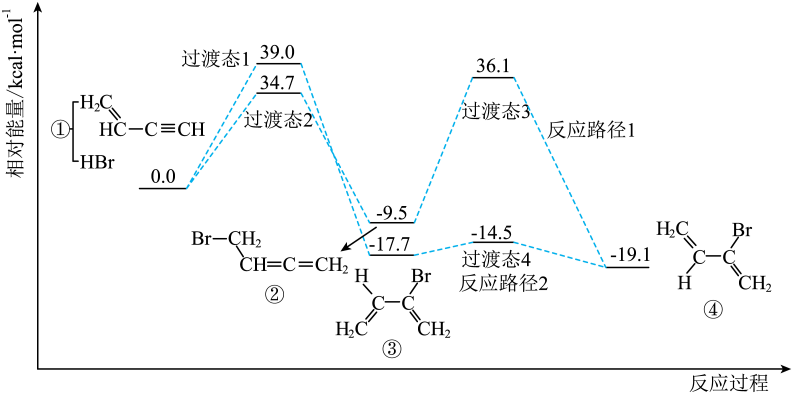 A、反应物经过渡态2生成中间体发生的是1,4-加成 B、推测物质的稳定性顺序为:④>③>② C、反应路径1中最大能垒为 D、催化剂不会改变总反应的14. 硒(Se)是一种有抗癌、抗氧化作用的元素,可形成多种化合物。某化合物是潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
A、反应物经过渡态2生成中间体发生的是1,4-加成 B、推测物质的稳定性顺序为:④>③>② C、反应路径1中最大能垒为 D、催化剂不会改变总反应的14. 硒(Se)是一种有抗癌、抗氧化作用的元素,可形成多种化合物。某化合物是潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
下列说法不正确的是( )
A、Se的基态原子价电子排布式为 B、该化合物的晶体类型是离子晶体 C、该化合物的化学式为 D、距离K最近的八面体有4个15. 利用微生物燃料电池(MFC)可以将废水中的降解为。某课题组设计出如图所示的微生物燃料电池进行同步硝化和反硝化脱氮研究,下列说法不正确的是( )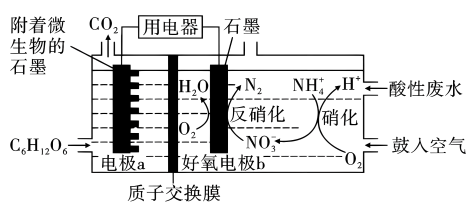 A、电极a的电势比电极b低 B、好氧电极上发生的反硝化反应为 C、鼓入的空气过多,会降低反硝化反应的电流效率 D、每消耗 , 则理论上可以处理的物质的量为4.8 mol
A、电极a的电势比电极b低 B、好氧电极上发生的反硝化反应为 C、鼓入的空气过多,会降低反硝化反应的电流效率 D、每消耗 , 则理论上可以处理的物质的量为4.8 mol二、非选择题(本题共4小题,共55分。)
-
16. 蛇纹石矿的主要成分为、、、、、等,现有一种利用该矿石制备高纯度工艺流程如图:

已知: , 氢硫酸的两步电离常数分别为 , 。
(1)、滤渣1的主要成分有S、、 , 根据滤渣成分,分析使用浓硫酸酸浸而不用盐酸的理由是。(2)、“氧化”时作氧化剂发生反应的离子方程式为 , 鼓入空气,除可作氧化剂外,还有的作用。(3)、滤渣2的主要成分是。(4)、沉镍时,当镍离子恰好沉淀完全(离子浓度小于 , 可认为沉淀完全),要保证此时不会从溶液逸出,应控制溶液中浓度不高于(已知饱和浓度约为)。(5)、晶体具有型结构(如图),实验测得的晶胞参数为 , 则与距离最近的有个,该晶体密度为(阿伏加德罗常数用表示)。 17. 硼氢化钠是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析纯度的步骤如下,请结合信息回答问题。
17. 硼氢化钠是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析纯度的步骤如下,请结合信息回答问题。性质
固体,可溶于异丙胺或水,常温下与水缓慢反应,与酸剧烈反应,强碱环境下能稳定存在
固体,强还原性,与水剧烈反应产生
固体,难溶于异丙胺,常温下与水剧烈反应
(1)、Ⅰ.的制备
先打开 , 向装置中鼓入 , 然后升温到110℃左右,打开搅拌器快速搅拌,将融化的Na快速分散到石蜡油中,然后升温到200℃,关闭 , 打开通入 , 充分反应后制得。然后升温到240℃,持续搅拌下通入 , 打开 , 向三颈瓶中滴入硼酸三甲酯[分子式为 , 沸点为68℃],充分反应后,降温后离心分离得到和的固体混合物。
仪器A的名称是。 (2)、写出与的化学反应方程式。(3)、将Na分散到石蜡油中的目的是。(4)、Ⅱ.的提纯
(2)、写出与的化学反应方程式。(3)、将Na分散到石蜡油中的目的是。(4)、Ⅱ.的提纯可采用索氏提取法提纯,其装置如图所示。实验时将和的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(熔点:℃,沸点:33℃)受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管3返回烧瓶,从而实现连续萃取。当萃取完全后,在(填“圆底烧瓶”或“索氏提取器”)中。
 (5)、分离异丙胺和并回收溶剂的方法是。(6)、Ⅲ.的纯度分析[已知]
(5)、分离异丙胺和并回收溶剂的方法是。(6)、Ⅲ.的纯度分析[已知]步骤1:取产品(杂质不参与反应),将产品溶于X溶液后配成溶液,取置于碘量瓶中,加入溶液充分反应。(反应为)
步骤2:向步骤1所得溶液中加入过量的KI溶液,用稀硫酸溶液调节pH,使过量转化为 , 冷却后暗处放置数分钟。(反应为)
步骤3:向步骤2所得溶液中加和缓冲溶液调pH约为5.0,加入几滴淀粉指示剂,用标准溶液滴定至终点,消耗标准溶液的体积为。(反应为)
X溶液为(写化学式)。
(7)、产品中的纯度为%。18. 甲烷是最简单的烃,可用来作为燃料,也是一种重要的化工原料。(1)、A.
B.
C.
上述热化学方程式中的反应热能正确表示甲烷燃烧热的是。(2)、以甲烷为原料通过以下反应可以合成甲醇:现将和充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:

①时升高温度,(填“增大”、“减小”或“不变”);(填“>”、“<”或“=”);
②E、F、N点对应的化学反应速率由大到小的顺序为(用表示);
③下列能提高平衡转化率的措施是(填序号);
a.选择高效催化剂 b.增大投料比 c.及时分离产物
④若点, , 总压强为 , 则时点用分压强代替浓度表示的平衡常数。
19. 请根据要求回答问题:(1)、钌及其化合物在合成工业上有广泛用途,如图所示是用钌(Ru)基催化剂催化合成甲酸的过程示意图。每生成92g液态HCOOH放出62.4kJ的热量。根据下图写出生成1mol HCOOH(l)的反应的热化学方程式:。 (2)、几种物质的摩尔燃烧焓见下表(298K,101kPa):
(2)、几种物质的摩尔燃烧焓见下表(298K,101kPa):化学式
-393.5
-285.8
-283.0
-890.3
已知:298K、101kPa时, ;煤的燃烧焓可用石墨的燃烧焓粗略估算。煤的气化反应为 。
(3)、 混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理如下图所示,其总反应式为H2+2NiOOH2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH(填“增大”“减小”或“不变”),该电极的电极反应式为。 (4)、如图所示装置可回收利用工业废气中的和。装置工作时,溶液中质子的移动方向是(填“甲→乙”或“乙→甲”),乙室中电极反应式为。
(4)、如图所示装置可回收利用工业废气中的和。装置工作时,溶液中质子的移动方向是(填“甲→乙”或“乙→甲”),乙室中电极反应式为。