吉林省通化市梅河口市2023-2024学年高一上学期1月期末考试化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项符合题目要求。
-
1. 下列说法正确的是( )A、为了使铝制品适应于不同的用途,常用铬酸做氧化剂使铝的氧化膜产生美丽的颜色 B、不锈钢中添加镍(Ni)和铬(Cr)等元素,不含非金属元素 C、制造“蛟龙”号载人潜水器耐压球的钛合金是一种耐热合金 D、储氢合金的储氢过程是物理变化2. 同位素与辐射技术简称同辐技术,广泛应用于农业、医学等领域。Co有多种同位素,一种Co同位素放射源辐射时的衰变方程为→+。下列叙述中正确的是( )A、、、属于两种元素 B、和互为同素异形体 C、和具有完全相同的性质 D、上述衰变过程有多种产物生成,属于分解反应3. 用NA代表阿伏加德罗常数的数值,下列说法不正确的是( )A、2g氘化锂(6LiD)中含中子数为NA B、等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2NA C、常温常压下,11.2LCO和CO2混合气体中含有的碳原子数目小于0.5NA D、22.4LCO2与O2(标准状况)的混合气体通过足量的Na2O2固体后,体积变为16.8L,则该过程中转移电子数为0.5NA4. 氯化铁溶液中加入少量Fe粉,溶液颜色变浅,要证明该过程发生了氧化还原反应,加入下列试剂一定可行的是( )A、酸性高锰酸钾溶液 B、NaOH溶液 C、铁氰化钾(K3[Fe(CN)6])溶液 D、先加入KSCN溶液,再加入H2O2溶液5. 下列离子方程式书写不正确的是( )A、溴与冷的NaOH溶液反应:Br2+2OH-=Br-+BrO-+H2O B、明矾溶液与过量氨水混合:Al3++4NH3+4H2O=[Al(OH)4]-+4 C、Ca(HCO3)2溶液中滴入少量澄清石灰水:Ca2++OH-+=CaCO3↓+H2O D、将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1:2混合:Ba2++2OH-+2H++=BaSO4↓+2H2O6. 在酸性条件下,可发生如下反应: +2M3++4H2O= +Cl-+8H+ , 中M的化合价是 ( )A、+4 B、+5 C、+6 D、+77. 下列关于钠及其化合物的相关性质和应用的说法正确的是( )A、纯碱溶液可以用于洗去油污,也可以用于治疗胃酸过多 B、金属钠着火时,不能用水扑灭,可用灭火 C、钠长期暴露在空气中的最终产物是 D、向溶液和溶液中分别加入钠块,均可以产生气体和沉淀8. 某课外小组为了鉴别和两种白色固体,设计了如下几种实验方法。

下列说法不正确的是( )
A、装置I中的和均能与盐酸反应,产生气体快的是 B、当稀盐酸足量时,装置I中气球鼓起体积较大的是 C、加热装置Ⅱ,澄清石灰水变浑浊一侧的白色固体是 D、装置皿Ⅱ也可以鉴别和9. 列关于氯气的实验装置能达到实验目的的是( )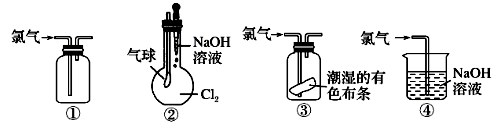
①可用于氯气的收集 ②若气球干瘪,证明Cl2可与NaOH反应 ③可证明氯气具有漂白性 ④可用于实验室中氯气的尾气吸收
A、①② B、①③ C、②③ D、①④10. 下列说法中错误的是( )A、的质量为1g B、56g铁与足量稀硫酸反应,转移电子的物质的量为3mol C、常温、常压下,中含有的分子数小于 D、和的混合气体所含氧原子数目约为11. 下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是( )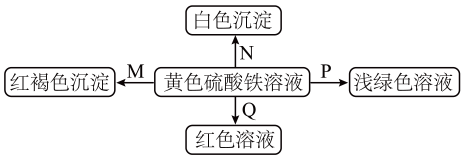
选项
M
N
P
Q
A
NH3·H2O
Ba(OH)2
Zn
KSCN
B
Na
BaCl2
FeO
KSCN
C
NaOH
Ba(NO3)2
Fe
KSCN
D
Na2O2
MgCl2
Fe
KSCN
A、A B、B C、C D、D12. 某同学设计实验确定的结晶水数目。将加热发生反应 , 测得生成和(标准状况)。则x等于( )A、4.5 B、4 C、6 D、913. 铁黄是一种优质颜料。制备铁黄晶种时,向精制溶液中滴加氨水(弱碱),先出现白色沉淀,后变为灰绿色。加氨水至时,开始通入空气,溶液随时间的变化曲线如图。下列分析不正确的是( )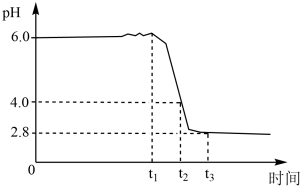 A、产生白色沉淀的离子方程式为 B、发生的主要反应为 C、发生的主要反应为 D、后仅发生反应4Fe2++O2+4H+=4Fe3++2H2O14. 下列对碱金属性质的叙述中,正确的是( )
A、产生白色沉淀的离子方程式为 B、发生的主要反应为 C、发生的主要反应为 D、后仅发生反应4Fe2++O2+4H+=4Fe3++2H2O14. 下列对碱金属性质的叙述中,正确的是( )
①都是银白色的柔软金属(除铯外),密度都比较小
②单质在空气中燃烧生成的都是过氧化物
③碱金属单质都与水剧烈反应
④单质的熔、沸点随着原子序数的增加而升高A、①③ B、②④ C、①④ D、②③15. 下列有关实验装置进行的实验,能达到实验目的的是( )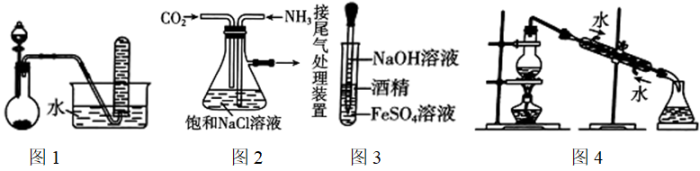 A、图1MnO2与浓盐酸反应制备Cl2 B、图2根据“侯氏制碱法”原理制备NaHCO3 C、图3制备Fe(OH)2白色沉淀 D、图4用海水制取蒸馏水
A、图1MnO2与浓盐酸反应制备Cl2 B、图2根据“侯氏制碱法”原理制备NaHCO3 C、图3制备Fe(OH)2白色沉淀 D、图4用海水制取蒸馏水二、非选择题:本题共4小题,共55分。
-
16. 水体的化学需氧量(COD)能反映水体受还原性物质污染的程度。某小组用高锰酸钾法测定学校周边河水的COD值,其中需要配制的溶液。请根据所学知识回答下列问题。(1)、计算、称量:需用分析天平称量固体(保留四位小数)(2)、选择仪器:需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、。(3)、称量后,以下操作步骤的顺序为(填字母)。
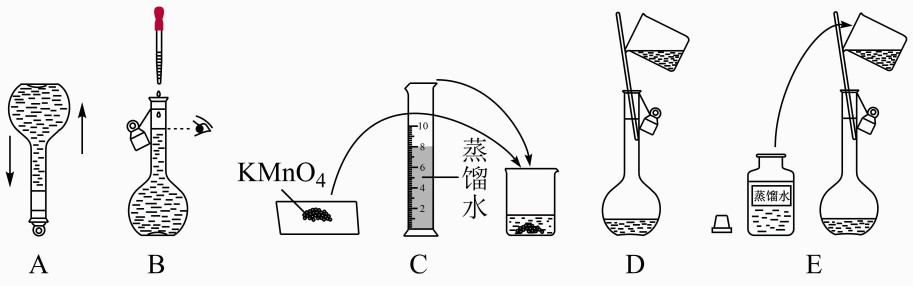
定容的操作是将蒸馏水注入容量瓶,当 , 改用胶头滴管加水至溶液凹液面与刻度线相切。
(4)、下列操作会使溶液浓度偏低的是(填序号)。①转移溶液前,容量瓶底部有水
②转移溶液时,溶液不慎洒到容量瓶外
③定容时,俯视刻度线
④摇匀后,液面低于刻度线,再加水至凹液面与刻度线相切
(5)、配制溶液后要用稀硫酸酸化,说明不用盐酸酸化的原因:。17. 如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3 , D为固定蚊香的硬纸片。试回答下列问题: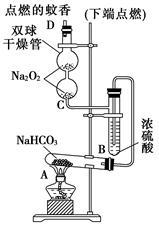 (1)、在A试管内发生反应的化学方程式是。(2)、B装置的作用是。(3)、在双球干燥管内发生反应的化学方程式为。(4)、双球干燥管内观察到的实验现象是;上述实验现象说明:。(5)、若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是:。18. 铁是生产、生活及生命中的重要元素。回答下列问题:(1)、铁在元素周期表中的位置为。(2)、碳酸亚铁可用于治疗缺铁性贫血。某研究性学习小组同学欲通过硫酸亚铁与碳酸氢钠反应在实验室中制备碳酸亚铁(装置如下图所示)。
(1)、在A试管内发生反应的化学方程式是。(2)、B装置的作用是。(3)、在双球干燥管内发生反应的化学方程式为。(4)、双球干燥管内观察到的实验现象是;上述实验现象说明:。(5)、若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是:。18. 铁是生产、生活及生命中的重要元素。回答下列问题:(1)、铁在元素周期表中的位置为。(2)、碳酸亚铁可用于治疗缺铁性贫血。某研究性学习小组同学欲通过硫酸亚铁与碳酸氢钠反应在实验室中制备碳酸亚铁(装置如下图所示)。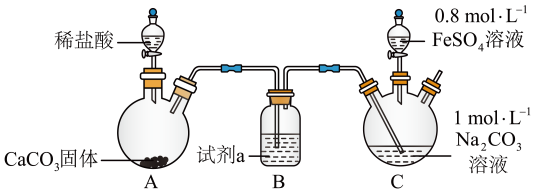
向装置C的碳酸钠溶液中通入一段时间CO2至pH约为7,再滴加一定量FeSO4溶液,产生白色沉淀,经过滤、洗涤、干燥,得到FeCO3固体。
①图1中装有稀盐酸的仪器名称为。
②向碳酸钠溶液中通入CO2的目的有、。
③试剂a是 , 装置C中制取FeCO3的离子方程式为。
(3)、化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验: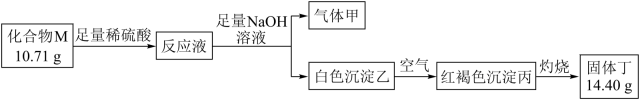
气体甲可使湿润红色石蕊试纸变蓝。请回答:M的化学式。
19. 高锰酸钾生产过程中产生的废锰渣(主要成分为、KOH和)可用于制备晶体,工艺流程如下: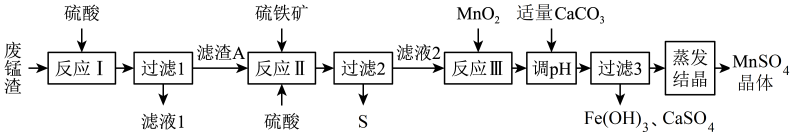
已知:硫铁矿的主要成分为二硫化亚铁( , 杂质不参与反应)。
回答下列问题:
(1)、二硫化亚铁中S元素的化合价为。(2)、滤渣A的主要成分是(填化学式);“反应Ⅱ”生成、等物质的离子方程式为。(3)、“反应Ⅲ”中还原剂和氧化剂物质的量之比为;加入作为氧化剂的优点是。(4)、“调pH”时,验证已经沉淀完全的实验操作和现象为。(5)、“蒸发结晶”时,应在时停止加热。