湖南省长沙市宁乡市2023-2024学年高二上学期期末化学模拟试卷
试卷更新日期:2024-02-01 类型:期末考试
一、选择题(共10小题,满分30分,每小题3分)
-
1. 杭州第19届亚运会化学秉持“绿色、智能、节俭、文明”的办会理念。下列做法不符合该理念的是( )
 A、采用“零碳”甲醇点燃亚运主火炬 B、使用锂电池供电驱动的机器狗 C、使用可循环快递箱运送包裹 D、使用不可降解的一次性餐盒2.
A、采用“零碳”甲醇点燃亚运主火炬 B、使用锂电池供电驱动的机器狗 C、使用可循环快递箱运送包裹 D、使用不可降解的一次性餐盒2.某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
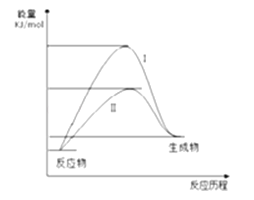 A、反应物的熔沸点 B、反应的完成程度 C、生产能耗 D、反应热效应3. 在下列溶液中,各组离子一定能够大量共存的是( )A、在pH=1的溶液中:NH4+、NO3﹣、Cl﹣ B、含Al3+的溶液中:Na+、SO42﹣、HCO3﹣ C、c(H+)=4mol⋅L﹣1溶液中:Fe2+、Ba2+、NO3﹣ D、由水电离的c(H+)=10﹣12mol⋅L﹣1的溶液中:Na+、Ca2+、ClO﹣4. 某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2mol电子时停止电解,析出Na2SO4•10H2O晶体m g,所有数据都在相同温度下测得,下列叙述正确的是( )A、电解后溶液质量减少(m+36)g B、原溶液中Na2SO4的质量分数为 C、若其它条件不变,将石墨电极替换为铜电极,则阴极析出2mol H2 D、若其它条件不变,将石墨电极替换为铜电极,则析出Na2SO4•10H2O晶体仍为m g5. 下列操作中能使电离平衡H2O⇌H++OH﹣ , 向右移动且溶液呈酸性的是( )A、将水加热到100℃,使pH=6 B、向水中加入Al2(SO4)3固体 C、向水中加入Na2CO3溶液 D、向水中加入NaHSO4溶液6. 可以证明可逆反应N2+3H2⇌2NH3已达到平衡状态的是( )
A、反应物的熔沸点 B、反应的完成程度 C、生产能耗 D、反应热效应3. 在下列溶液中,各组离子一定能够大量共存的是( )A、在pH=1的溶液中:NH4+、NO3﹣、Cl﹣ B、含Al3+的溶液中:Na+、SO42﹣、HCO3﹣ C、c(H+)=4mol⋅L﹣1溶液中:Fe2+、Ba2+、NO3﹣ D、由水电离的c(H+)=10﹣12mol⋅L﹣1的溶液中:Na+、Ca2+、ClO﹣4. 某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2mol电子时停止电解,析出Na2SO4•10H2O晶体m g,所有数据都在相同温度下测得,下列叙述正确的是( )A、电解后溶液质量减少(m+36)g B、原溶液中Na2SO4的质量分数为 C、若其它条件不变,将石墨电极替换为铜电极,则阴极析出2mol H2 D、若其它条件不变,将石墨电极替换为铜电极,则析出Na2SO4•10H2O晶体仍为m g5. 下列操作中能使电离平衡H2O⇌H++OH﹣ , 向右移动且溶液呈酸性的是( )A、将水加热到100℃,使pH=6 B、向水中加入Al2(SO4)3固体 C、向水中加入Na2CO3溶液 D、向水中加入NaHSO4溶液6. 可以证明可逆反应N2+3H2⇌2NH3已达到平衡状态的是( )①一个N≡N键断裂的同时,有6个N﹣H键断裂
②v(N2)=0.2mol•L﹣1•min﹣1 , v(NH3)=0.4mol•L﹣1•min﹣1
③保持其他条件不变时,体系压强不再改变;
④恒温恒容时,混合气体的密度保持不变;
⑤NH3、N2、H2的体积分数都不再改变.
A、①②④ B、①③⑤ C、②③④ D、③④⑤7. 海洋生物参与氮循环的过程如图所示,下列说法正确的是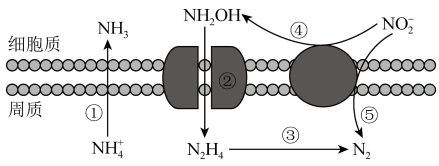 A、图中微粒间的转化均属于氧化还原反应 B、酸性环境有利于反应① C、反应③可能有氧气参与反应 D、反应③、⑤属于氮的固定8. 某同学设计了用氯气制取无水氯化铁(易升华)的相关装置,其中涉及正确且能达到相应目的是( )
A、图中微粒间的转化均属于氧化还原反应 B、酸性环境有利于反应① C、反应③可能有氧气参与反应 D、反应③、⑤属于氮的固定8. 某同学设计了用氯气制取无水氯化铁(易升华)的相关装置,其中涉及正确且能达到相应目的是( )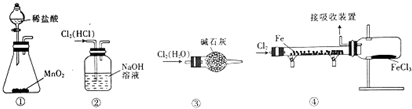 A、用装置①制取氯气 B、用装置②除去Cl2中的HCl C、用装置③干燥氯气 D、用装置④制取并收集FeCl39. 下列物质的水溶液不能使酚酞变红的是( )A、NaOH B、Na2CO3 C、NaCl D、NH310. 向某密闭容器中加入0.3mol A、0.1mol C和一定量B的混合气体,在一定条件下发生反应,各物质的浓度随时间变化如图甲所示(t0~t1阶段的c(B)变化未画出),图乙为t2时刻改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段各改变一种不同的反应条件。下列说法中正确的是( )
A、用装置①制取氯气 B、用装置②除去Cl2中的HCl C、用装置③干燥氯气 D、用装置④制取并收集FeCl39. 下列物质的水溶液不能使酚酞变红的是( )A、NaOH B、Na2CO3 C、NaCl D、NH310. 向某密闭容器中加入0.3mol A、0.1mol C和一定量B的混合气体,在一定条件下发生反应,各物质的浓度随时间变化如图甲所示(t0~t1阶段的c(B)变化未画出),图乙为t2时刻改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段各改变一种不同的反应条件。下列说法中正确的是( )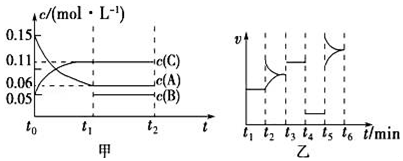 A、若t1=15 s,t0~t1阶段B的平均反应速率为0.004 mol•L﹣1•s﹣1 B、t4~t5阶段改变的条件可能是增大压强 C、该容器的容积为2 L,B的起始物质的量为0.02 mol D、t5~t6阶段,容器内A的物质的量减少了0.06 mol,容器与外界的热交换为a kJ,则该反应的热化学方程式为3A(g)⇌B(g)+2C(g)△H=﹣50a kJ•mol﹣1
A、若t1=15 s,t0~t1阶段B的平均反应速率为0.004 mol•L﹣1•s﹣1 B、t4~t5阶段改变的条件可能是增大压强 C、该容器的容积为2 L,B的起始物质的量为0.02 mol D、t5~t6阶段,容器内A的物质的量减少了0.06 mol,容器与外界的热交换为a kJ,则该反应的热化学方程式为3A(g)⇌B(g)+2C(g)△H=﹣50a kJ•mol﹣1二、选择题(共4小题,满分16分,每小题4分)
-
11. 石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
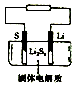 A、放电时,锂在负极上发生氧化反应 B、放电时,正极的电极反应式为nS+2e﹣+2Li+=Li2Sn C、充电时,锂电极为阴极,与电源负极相连 D、充电时,理论上阳极失去2mol电子生成32g硫12. 已知酸式盐NaHB在水溶液中存在下列情况:
A、放电时,锂在负极上发生氧化反应 B、放电时,正极的电极反应式为nS+2e﹣+2Li+=Li2Sn C、充电时,锂电极为阴极,与电源负极相连 D、充电时,理论上阳极失去2mol电子生成32g硫12. 已知酸式盐NaHB在水溶液中存在下列情况:①NaHB═Na++HB﹣
②HB﹣⇌H++B2﹣
③HB﹣+H2O⇌H2B+OH﹣且常温下溶液中c(H+)>10﹣7mol•L﹣1 .
下列说法一定正确的是( )
A、NaHB只能部分电离 B、H2B溶液中只存在两种阴离子 C、H2B为弱电解质 D、HB﹣的电离程度大于的水解程度13. 石墨、金刚石燃烧的热化学方程式分别为C(石墨)+O2(g)═CO2(g)△H=﹣393.51kJ•mol﹣1
C(金刚石)+O2(g)═CO2(g)△H=﹣395.41kJ•mol﹣1
关于金刚石和石墨的相互转化,下列说法正确的是( )
A、石墨转化成金刚石是自发进行的过程 B、金刚石转化成石墨是自发进行的过程 C、金刚石比石墨更稳定 D、石墨比金刚石更稳定14. 某温度下,向体积均为20.00mL、浓度均为0.1mol•L﹣1的NaCl、Na2CrO4溶液中分别滴加0.1mol•L﹣1的AgNO3溶液,滴定过程中的pX(pX=﹣lgX,X=Cl﹣、CrO42﹣)与滴加AgNO3溶液体积关系如图所示(lg3=0.47)。下列说法错误的是( )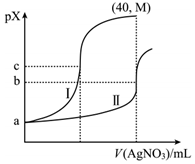 A、a=1 B、曲线I表示NaCl溶液 C、Ksp(Ag2CrO4)=1.0×10﹣2b D、M约为2c﹣1.47
A、a=1 B、曲线I表示NaCl溶液 C、Ksp(Ag2CrO4)=1.0×10﹣2b D、M约为2c﹣1.47三、解答题(共4小题,满分54分)
-
15. 化学能与热能、电能的相互转化是化学原理研究的重要内容。
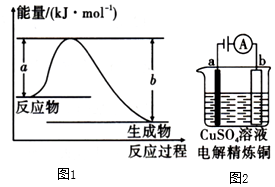 (1)、如图1表示某反应的能量变化关系,则此反应为(填“吸热”或“放热”)反应,其中△H=(用含a、b的关系式表示)。(2)、处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知
(1)、如图1表示某反应的能量变化关系,则此反应为(填“吸热”或“放热”)反应,其中△H=(用含a、b的关系式表示)。(2)、处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知①CO(g)O2(g)═CO2(g)△H=﹣283.0kJ•mol﹣1
②S(s)+O2(g)=SO2(g)△H=﹣296.0kJ/mol﹣1
则CO、SO2转化为单质S的热化学方程式是。
(3)、用CH4催化还原NOx , 也可以消除氮氧化物的污染。例如①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣547kJ/mol﹣1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H1=?
若1 mol CH4还原NO2至N2的过程中放出的热量为867kJ,则△H2=
(4)、普通铅蓄电池的总反应为Pb+PbO2+2H2SO42PbSO4+2H2O.氯碱工业中若用该铅蓄电池电解饱和食盐水,若两极共得到6.72L气体(标准状况下),则反应中转移电子的物质的量为此时电源中消耗的硫酸为mol。(5)、如图2是电解精炼铜的装置,其中a极是(填“纯铜”或“粗铜”),该装置工作一段时间后,CuSO4溶液的浓度将(填“变小”“变大”或“不变”)。16. 现有一包AlCl3和FeCl3的混合粉末,欲将其中的Al元素和Fe元素分开,可进行如下操作: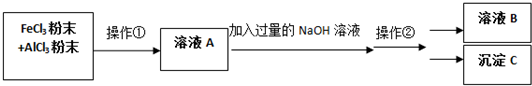 (1)、操作①名称是 , 操作②名称是(过滤/分液/蒸馏/溶解/结晶);(2)、溶液B是 , 沉淀C是(3)、若往溶液A中滴入KSCN溶液,预计会观察到溶液呈色;(4)、请写出在溶液中,FeCl3和NaOH反应的离子方程式: .17. 查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4﹣(绿色)、Cr2O72﹣(橙红色)、CrO42﹣(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(1)、铬(24Cr)属于(选填编号)。
(1)、操作①名称是 , 操作②名称是(过滤/分液/蒸馏/溶解/结晶);(2)、溶液B是 , 沉淀C是(3)、若往溶液A中滴入KSCN溶液,预计会观察到溶液呈色;(4)、请写出在溶液中,FeCl3和NaOH反应的离子方程式: .17. 查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4﹣(绿色)、Cr2O72﹣(橙红色)、CrO42﹣(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(1)、铬(24Cr)属于(选填编号)。a.主族元素 b.副族元素 c.Ⅷ族元素 d.过渡元素
(2)、铬单质是银白色有金属光泽的固体,有较高的熔点,是最硬的金属;与Ni等添加到Fe中可制成不锈钢。比较硬度:纯铁不锈钢;熔点:纯铁不锈钢(填“>”“<”或“=”)。(3)、Cr(OH)3与Al(OH)3的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是。(4)、CrO42﹣和Cr2O72﹣在溶液中可相互转化。室温下,初始浓度为1.0mol•L﹣1的Na2CrO4溶液中c(Cr2O72﹣)随c(H+)的变化如图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应。
②由图可知,溶液酸性增大,CrO42﹣的平衡转化率(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为。
③升高温度,溶液中CrO42﹣的平衡转化率减小,则该反应的△H0(填“>”“<”或“=”)。
(5)、+6价铬的化合物毒性较大,但其化合物用途广泛。如:“酒精检测仪”可检查司机是否酒驾,其反应原理为:m C2H5OH+n X+p H2SO4═g Cr2(SO4)3+w CO2↑+9H2O,其中X的化学式最有可能为。常用NaHSO3将酸性废液中的Cr2O72﹣还原成Cr3+ , 该反应的离子方程式为。18. (1)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙做指示剂。请填写下列空白:①用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直至当 ____时,即确定达到滴定终点。
②若滴定开始和结束时,酸式滴定管中的液面如图1所示所用盐酸溶液的体积为 ____mL。
 (1)、某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙做指示剂。请填写下列空白:
(1)、某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙做指示剂。请填写下列空白:①用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直至当时,即确定达到滴定终点。
②若滴定开始和结束时,酸式滴定管中的液面如图1所示所用盐酸溶液的体积为 mL。
 (2)、T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图2所示,请回答下列问题:
(2)、T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图2所示,请回答下列问题:①T1T2(填“>”“<”“=”),T2时Ksp(BaSO4)=。
②根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是 (填字母)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线下方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)、已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:化学式
CH3COOH
H2CO3
HClO
电离平衡常数
Ka=1.8×10﹣5
Ka1=4.3×10﹣7
Ka2=5.6×10﹣11
Ka=3.0×10﹣8
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是 (用编号填写)。
a.CH3COONa
b.Na2CO3
c.NaClO
d.NaHCO3
②常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填字母)。
A.c(H+)
B.
C.c(H+)•c(OH﹣)
D.
(4)、已知CH3COONa水溶液呈碱性。①用离子方程式表示该水溶液呈碱性的原因 。
②在该水溶液中各离子浓度的大小关系是 。
(5)、下列4种混合溶液,分别由等体积0.1mol⋅L﹣1的两种溶液混合而成:①NH4Cl与CH3COONa(混合溶液呈中性)②NH4Cl与HCl③NH4Cl与NaCl④NH4Cl与NH3⋅H2O(混合溶液呈碱性)。浓度由小到大排序(用序号填写) 。