云南省昆明市五华区2023-2024学年高一上学期1月期末教学测评化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题(本大题共20小题,每小题2.5分,共50分。在每小题给出的四个选项中,只有一项是符合题目要求的)
-
1. 化学与生活、社会发展息息相关,下列说法正确的是( )。A、“食物腐败,胶体净水,金属的冶炼”都涉及氧化还原反应 B、铁粉常作脱氧剂,生石灰、浓硫酸常作干燥剂 C、苏打可用于治疗胃酸过多 D、从石墨中剥离出的石墨烯薄片能导电,是一种电解质2. 下列逻辑关系图示中正确的是( )A、
B、
C、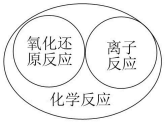
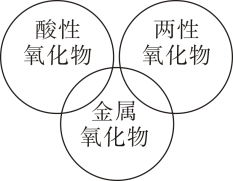 D、
D、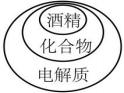 3. 下列实验操作描述正确的是( )。A、制备氢氧化铁胶体实验时,用玻璃棒搅拌可加快反应速率 B、进行焰色试验时如无铂丝,可以用洁净的铁丝代替 C、实验剩余的药品都不可以放回原瓶 D、坩埚不可以用明火直接加热4. 下列化学用语不正确的是( )。A、中子数为18的氯离子: B、的结构式: C、Rb的原子结构示意图:
3. 下列实验操作描述正确的是( )。A、制备氢氧化铁胶体实验时,用玻璃棒搅拌可加快反应速率 B、进行焰色试验时如无铂丝,可以用洁净的铁丝代替 C、实验剩余的药品都不可以放回原瓶 D、坩埚不可以用明火直接加热4. 下列化学用语不正确的是( )。A、中子数为18的氯离子: B、的结构式: C、Rb的原子结构示意图: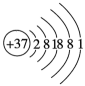 D、的电子式:
5. 下列关于化学键的说法正确的是( )。A、有化学键断裂的变化一定是化学变化 B、中含有极性键和非极性键 C、受热分解既破坏了离子键,又破坏了极性共价键 D、共价化合物中不可能含有金属元素6. 下列叙述正确的有( )。
D、的电子式:
5. 下列关于化学键的说法正确的是( )。A、有化学键断裂的变化一定是化学变化 B、中含有极性键和非极性键 C、受热分解既破坏了离子键,又破坏了极性共价键 D、共价化合物中不可能含有金属元素6. 下列叙述正确的有( )。①酸性氧化物一定是非金属氧化物
②、都能溶于水生成碱,它们都属于碱性氧化物
③和互为同素异形体
④、、、均可通过化合反应制得
⑤已知: , 则不是电解质
⑥冰中水分子间以氢键结合成排列规整的晶体,体积膨胀密度减小,所以冰浮在水面上
A、1项 B、2项 C、3项 D、4项7. 下列各组物质的转化中,不是通过一步反应实现的是( )。A、 B、 C、 D、8. 下列有关周期表、周期律的叙述,正确的是( )。A、第ⅠA族除H外均为碱金属元素,对应单质均需要保存于煤油中 B、第ⅦA族卤素单质与水反应均可以用:来表示 C、同周期简单离子半径随原子序数增大而递减 D、锑(Sb)元素位于第五周期第ⅤA族,原子序数为519. 下列各组离子在指定溶液中一定能大量共存的是( )。A、常温下,的透明溶液中:、、、 B、与铝反应放出氢气的溶液中:、、、 C、使酚酞变红的溶液中:、、、 D、新制氯水中:、、、10. 向两份相同体积、相同物质的量浓度的溶液中,分别滴入物质的量浓度相等的、溶液,其导电能力随滴入溶液体积(V)变化的曲线如图所示。下列说法正确的是( )。 A、a、d两点对应的溶液均显中性 B、b点时对应的离子方程式为 C、c点时两溶液中的物质的量浓度相同 D、曲线①代表滴加溶液的变化曲线11. 设为阿伏加德罗常数的值,下列说法正确的是( )。A、标准状况下,含的浓盐酸与足量的反应生成的体积为 B、的溶液中所含阳离子数目为 C、标准状况下,固体中含有的离子总数是 D、单质Fe与足量水蒸气在高温下完全反应,失去个电子12. 侯德榜(图乙)是我国近代著名的化学家,他提出的联合制碱法得到世界各国的认可。以粗盐(含、、等杂质)为主要原料,生产纯碱和化肥 , 实验室模拟工艺流程如图甲所示。下列说法不正确的是( )。
A、a、d两点对应的溶液均显中性 B、b点时对应的离子方程式为 C、c点时两溶液中的物质的量浓度相同 D、曲线①代表滴加溶液的变化曲线11. 设为阿伏加德罗常数的值,下列说法正确的是( )。A、标准状况下,含的浓盐酸与足量的反应生成的体积为 B、的溶液中所含阳离子数目为 C、标准状况下,固体中含有的离子总数是 D、单质Fe与足量水蒸气在高温下完全反应,失去个电子12. 侯德榜(图乙)是我国近代著名的化学家,他提出的联合制碱法得到世界各国的认可。以粗盐(含、、等杂质)为主要原料,生产纯碱和化肥 , 实验室模拟工艺流程如图甲所示。下列说法不正确的是( )。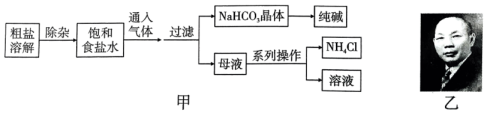 A、对粗盐提纯可依次加入过量、、溶液,过滤后再加入盐酸调pH B、向饱和食盐水中先通 , 再通 , 更有利于析出 C、图甲中析出晶体的总反应可表达为: D、向纯碱溶液中通入过量可以将纯碱溶液转化为溶液13. 实验室需用硫酸铜溶液,下列有关该溶液的配制说法正确的是( )。A、用托盘天平称取胆矾 B、实验中必须用到的玻璃仪器为:烧杯、量筒、容量瓶、玻璃棒 C、定容时仰视容量瓶的刻度线,会造成所配溶液物质的量浓度偏高 D、定容摇匀后发现液面低于刻度线,应再滴加蒸馏水至刻度线14. 下列离子方程式书写正确的是( )。A、向溶液中加入少量溶液: B、二氧化硫使酸性高锰酸钾溶液褪色: C、氢氧化镁与足量稀盐酸反应: D、已知酸性: , 向溶液中通入少量:15. 如图所示实验装置及实验结果合理的是( )。
A、对粗盐提纯可依次加入过量、、溶液,过滤后再加入盐酸调pH B、向饱和食盐水中先通 , 再通 , 更有利于析出 C、图甲中析出晶体的总反应可表达为: D、向纯碱溶液中通入过量可以将纯碱溶液转化为溶液13. 实验室需用硫酸铜溶液,下列有关该溶液的配制说法正确的是( )。A、用托盘天平称取胆矾 B、实验中必须用到的玻璃仪器为:烧杯、量筒、容量瓶、玻璃棒 C、定容时仰视容量瓶的刻度线,会造成所配溶液物质的量浓度偏高 D、定容摇匀后发现液面低于刻度线,应再滴加蒸馏水至刻度线14. 下列离子方程式书写正确的是( )。A、向溶液中加入少量溶液: B、二氧化硫使酸性高锰酸钾溶液褪色: C、氢氧化镁与足量稀盐酸反应: D、已知酸性: , 向溶液中通入少量:15. 如图所示实验装置及实验结果合理的是( )。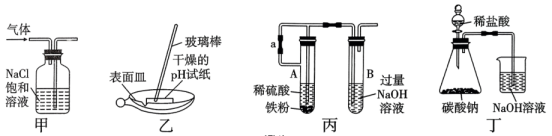 A、实验室用图甲所示装置除去中的少量 B、实验室用图乙所示装置测定氯水的pH C、实验室用图丙所示装置制备少量 , 先打开止水夹a,一段时间后再关闭a D、实验室用图丁所示装置证明非金属性强弱:Cl>C16. 铝元素是地壳中含量最多的金属元素(约占地壳总量的7.73%),主要以铝土矿形式存在(主要成分是)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝(熔点:2054℃),主要的工艺流程如图所示:
A、实验室用图甲所示装置除去中的少量 B、实验室用图乙所示装置测定氯水的pH C、实验室用图丙所示装置制备少量 , 先打开止水夹a,一段时间后再关闭a D、实验室用图丁所示装置证明非金属性强弱:Cl>C16. 铝元素是地壳中含量最多的金属元素(约占地壳总量的7.73%),主要以铝土矿形式存在(主要成分是)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝(熔点:2054℃),主要的工艺流程如图所示: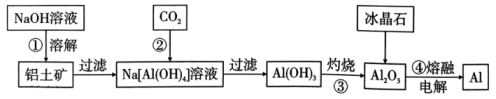
下列说法正确的是( )。
A、碱溶①后,溶液中主要含有的阳离子为和 B、步骤②通入足量反应的离子方程式为 C、灼烧③一般在蒸发皿中进行 D、电解④添加冰晶石的主要作用是降低的熔融温度17. 短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如图所示。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是( )。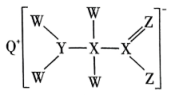 A、原子半径大小:Y>Z>Q B、W、Y、Z三种元素可形成离子化合物 C、该化合物中Y原子不满足8电子稳定结构 D、Z与W可形成 , 其空间结构是直线形18. 工业生产中除去电石渣浆(含)中的并制取硫酸盐的一种常用流程如图所示。下列说法正确的是( )。
A、原子半径大小:Y>Z>Q B、W、Y、Z三种元素可形成离子化合物 C、该化合物中Y原子不满足8电子稳定结构 D、Z与W可形成 , 其空间结构是直线形18. 工业生产中除去电石渣浆(含)中的并制取硫酸盐的一种常用流程如图所示。下列说法正确的是( )。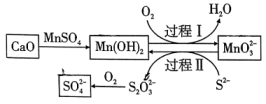 A、碱性条件下,氧化性: B、过程Ⅱ中,反应的离子方程式为 C、将转化为理论上需要的体积为(标准状况) D、该过程中涉及的化学反应均是氧化还原反应19. 如图所示,向密闭容器内可移动活塞的两边分别充入、和的混合气体(已知体积占整个容器体积的),将和的混合气体点燃引爆。活塞先左弹,恢复室温后,活塞右滑并停留于容器的中央。下列说法不正确的是( )。
A、碱性条件下,氧化性: B、过程Ⅱ中,反应的离子方程式为 C、将转化为理论上需要的体积为(标准状况) D、该过程中涉及的化学反应均是氧化还原反应19. 如图所示,向密闭容器内可移动活塞的两边分别充入、和的混合气体(已知体积占整个容器体积的),将和的混合气体点燃引爆。活塞先左弹,恢复室温后,活塞右滑并停留于容器的中央。下列说法不正确的是( )。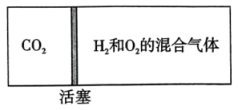 A、活塞移动情况说明、燃烧放热,且该反应气体分子数减少 B、反应前,活塞左右两边气体原子数之比为 C、原来和的体积之比一定是 D、反应后恢复到室温,活塞左右两边气体的物质的量相等20. 铜镁合金完全溶解于密度为、质量分数为63%的浓硝酸中,得到和的混合气体(换算为标准状况),向反应后的溶液中加入溶液,当金属离子全部沉淀时,得到沉淀,下列说法不正确的是( )。A、该合金中铜与镁的物质的量之比是 B、该浓硝酸中的物质的量浓度是 C、和的混合气体中,的体积分数是80% D、得到2.54沉淀时,加入溶液的体积是
A、活塞移动情况说明、燃烧放热,且该反应气体分子数减少 B、反应前,活塞左右两边气体原子数之比为 C、原来和的体积之比一定是 D、反应后恢复到室温,活塞左右两边气体的物质的量相等20. 铜镁合金完全溶解于密度为、质量分数为63%的浓硝酸中,得到和的混合气体(换算为标准状况),向反应后的溶液中加入溶液,当金属离子全部沉淀时,得到沉淀,下列说法不正确的是( )。A、该合金中铜与镁的物质的量之比是 B、该浓硝酸中的物质的量浓度是 C、和的混合气体中,的体积分数是80% D、得到2.54沉淀时,加入溶液的体积是二、填空题(本大题共4小题,共50分)
-
21. 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。(1)、W在元素周期表中的位置为。(2)、用电子式表示X与Y组成的化合物的形成过程:。(3)、M位于第四周期,与W同族。
①根据元素周期律,下列推断正确的是(填序号)。
A.M的最高正化合价为价 B.的还原性比强
C.最高价氧化物的水化物的酸性:M>W D.稳定性:
②在一定条件下可与溶液反应,生成一种正盐和水,该正盐化学式为。(用含M的化学式表示)
22. 新型冠状病毒肺炎爆发以来,各类杀菌消毒剂逐渐被人们所认识和使用。下列是我们常见的几种消毒剂:①“84”消毒液;②(二元弱酸);③;④;⑤碘酒;⑥75%酒精;⑦高铁酸钠。回答下列问题:(1)、上述杀菌消毒剂属于非电解质的是(填序号)。(2)、请写出的电离方程式:。(3)、各类杀菌消毒剂使用时,必须严格按照使用说明。巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是与反应产生促进藻类快速生长。当有生成时(标准状况下),反应中转移电子为mol。
(4)、工业上可在溶液中,用氧化的方法制备。制备反应的离子方程式为。23. 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点为670℃,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
 (1)、装置A中,用与浓盐酸反应制取氯气,写出反应的离子方程式:。(2)、装置A中导管a的作用是。C放置在盛冷水的水槽中,冷水浴的作用是。(3)、装置D的名称是 , 仪器D中装的药品可以是(填序号)。
(1)、装置A中,用与浓盐酸反应制取氯气,写出反应的离子方程式:。(2)、装置A中导管a的作用是。C放置在盛冷水的水槽中,冷水浴的作用是。(3)、装置D的名称是 , 仪器D中装的药品可以是(填序号)。
A. B.碱石灰 C. D.浓硫酸(4)、定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有 , 是否可用酸性溶液检验的存在?(填“是”或“否”);理由是。(5)、定量分析。取装置C中的产物,按以下步骤进行测定:①称取产品溶于过量的稀盐酸中;②加入足量溶液;③再加入足量溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为。写出加入足量溶液发生反应的离子方程式: , 计算该样品中铁元素的质量分数为%(结果精确到小数点后两位)。(6)、由(5)定量分析数据得出结论,并提出改进措施。①对比氯化铁中铁元素的质量分数为34.46%,说明含有杂质。
②若要得到较纯净的无水氯化铁,实验装置可进行的改进措施是。
24. 铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857℃。工业上以铬铁矿[主要成分是]为原料冶炼铬的流程如图所示: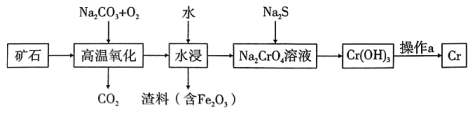
已知:是一种难溶于水的沉淀。
(1)、①中各元素化合价均为整数,则铬为价。②高温氧化时反应的化学方程式为。
③上述流程中的作用是。
④操作a由两种均发生了化学反应的过程构成,其内容分别是、铝与铬的氧化物反应。
(2)、和都是两性氢氧化物,请写出与反应的离子方程式:。(3)、水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体:先向含的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分)并加入 , 就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出在酸性条件下被还原为的离子方程式:。
②若处理含(不考虑其他含铬微粒)的污水时恰好消耗 , 则当铁铬氧体中时,铁铬氧体的化学式为。