(九省联考)2024年1月普通高等学校招生全国统一考试适应性测试化学试题(适用地区:河南)
试卷更新日期:2024-01-30 类型:高考模拟
一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 人类生活品质的提升离不开科技的进步。下列说法正确的是( )A、作为纳米苂光材料的碳量子点属于胶体 B、食品脱氧剂使用后,其中的铁粉转化成 C、人工转化二氧化碳合成的己糖属于高分子化合物 D、环型碳、环型碳和金刚石均是碳元素的同素异形体2. 一种在航空航天、国防军工等领域具有应用前景的液晶聚芳酯可由如下反应制备。下列说法错误的是( )
 A、 , 化合物为乙酸 B、化合物最多有24个原子共平面 C、反应说明化合物可发生缩聚反应 D、聚芳酯与稀和溶液均可反应3. 可用于印染、畜牧等领域,其晶体的部分结构如下图所示。下列说法正确的是( )
A、 , 化合物为乙酸 B、化合物最多有24个原子共平面 C、反应说明化合物可发生缩聚反应 D、聚芳酯与稀和溶液均可反应3. 可用于印染、畜牧等领域,其晶体的部分结构如下图所示。下列说法正确的是( ) A、电负性: B、基态的价层电子排布式为 C、晶体中和原子的轨道杂化类型均为 D、晶体中微粒间的相互作用只有离子键、共价键和配位键4. 一种基于固体电解质的可充电熔融钠电池,具有安全、电流密度高、使用条件宽泛等优点,其工作示意图如下所示,已知电池放电时不断有生成。下列说法错误的是( )
A、电负性: B、基态的价层电子排布式为 C、晶体中和原子的轨道杂化类型均为 D、晶体中微粒间的相互作用只有离子键、共价键和配位键4. 一种基于固体电解质的可充电熔融钠电池,具有安全、电流密度高、使用条件宽泛等优点,其工作示意图如下所示,已知电池放电时不断有生成。下列说法错误的是( )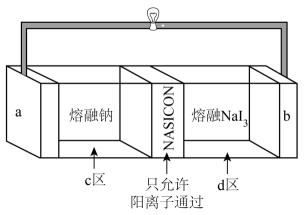 A、放电时电极为负极 B、固体电解质含钠离子 C、充电时阳极反应式: D、转移时,区和区的质量差改变5. 下列实验能达到目的的是( )
A、放电时电极为负极 B、固体电解质含钠离子 C、充电时阳极反应式: D、转移时,区和区的质量差改变5. 下列实验能达到目的的是( )选项
目的
实验
A
鉴别某材料是丝绸还是化纤
取样灼烧,闻灼烧时的气味并观察灼烧后灰烬的状态
B
探究浓度对反应速率的影响
一定温度下,用相同质量的同种锌粒分别与稀硫酸和浓硫酸反应,观察气体产生的快慢
C
测定某稀盐酸的物质的量浓度
移取稀盐酸于锥形瓶中,滴加2滴酚酞溶液,用标准溶液滴定至溶液呈红色,依据消耗标准溶液的体积计算
D
证明非金属性:
向装有固体的装置中滴加稀盐酸,有气体产生
A、A B、B C、C D、D6. 甲酸甲酯作为潜在的储氢材料受到关注,科学家发现使用配合物催化剂可以使甲酸甲酯温和释氢,其可能的反应过程如下图所示。下列说法错误的是( ) A、为极性分子,为非极性分子 B、每消耗生成 C、总反应为 D、反应涉及键断裂和键形成7. 向一定浓度的溶液中通入 , 存在化学平衡、和。平衡时分布系数与的关系如下图所示(其中代表或比如的分布系数 , c(总)。下列说法错误的是( )
A、为极性分子,为非极性分子 B、每消耗生成 C、总反应为 D、反应涉及键断裂和键形成7. 向一定浓度的溶液中通入 , 存在化学平衡、和。平衡时分布系数与的关系如下图所示(其中代表或比如的分布系数 , c(总)。下列说法错误的是( ) A、曲线I代表 , 曲线代表 B、反应的平衡常数的值为 C、时, D、时,
A、曲线I代表 , 曲线代表 B、反应的平衡常数的值为 C、时, D、时,二、非选择题:共174分。
-
8. 某实验小组对一种染料废水进行处理,获得Na2SO4并测定废水的总有机碳(总有机碳是指单位体积水样中溶解或悬浮的有机物碳元素质量总和,是水体评价的综合指标之一)。
实验步骤为:
①取100mL废水(假定有机成分只有萘磺酸钠),在35℃下加入等体积甲醇,充分混合后,冷却、过滤,得到固体A和滤液B。
②经检测,固体A主要成分为Na2SO4 , 并含有少量Na2SO3和萘磺酸钠;滤液B含2.3g萘磺酸钠。
③一定温度下,从滤液B中回收甲醇;再蒸发浓缩析出萘磺酸钠,过滤,得滤液C,向滤液C中加入适量的NaClO溶液去除少量的和NH3。
④按下图实验装置(部分装置略)对固体A进行处理,完全反应后Pt坩埚中固体为Na2SO4。

简化的操作过程:先检查装置气密性,再打开或关闭活塞1和活塞2,通入N2一段时间。再次打开或关闭活塞1和活塞2,改为通入O2 , 点燃煤气灯,一定时间后,停止加热,继续通O2一段时间。
回答下列问题:
(1)、实验步骤①中加入甲醇的目的为。(2)、实验步骤③中回收甲醇的操作名称是 , 去除NH3生成N2反应的离子方程式为。(3)、通入N2的目的是。(4)、酸性KMnO4溶液的作用是 , 试剂是。(5)、改为通入O2前,需____(填标号)。A、打开活塞1 B、打开活塞2 C、关闭活塞1 D、关闭活塞2(6)、反应后U形管(含试剂)增重0.44g,该废水总有机碳=(用科学记数法表示)。9. 钢渣是钢铁行业的固体废弃物,含有和等物质。一种以钢渣粉为原料固定并制备的工艺流程如图所示。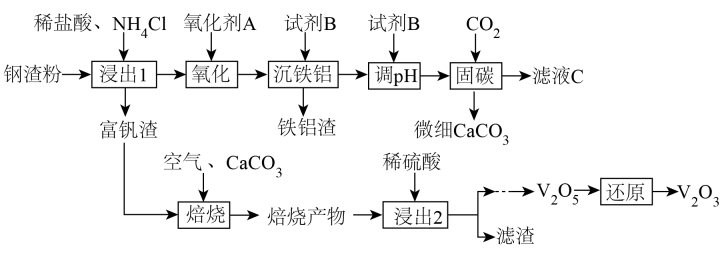
已知钢渣中元素质量分数为在稀盐酸和混合溶液中不易被浸出。该工艺条件下,有关金属离子开始沉淀和沉淀完全的如下表所示:
金属离子
开始沉淀的
1.9
7.2
3.5
12.4
沉淀完全的
2.9
8.2
5.1
13.8
回答下列问题:
(1)、浸出1过程生成的“包裹”在钢渣表面形成固体膜,阻碍反应物向钢渣扩散。提高浸出率的措施有(除粉碎外,举1例)。该浸出过程不使用稀硫酸代替稀盐酸的原因是。(2)、为避免引入杂质离子,氧化剂应为(举1例)。(3)、滤液的溶质可循环利用,试剂应为。(4)、若的浸出率为 , 理论上1吨钢渣在“固碳”中可固定。(5)、富钒渣焙烧可生成钒钙盐,不同钒钙盐的溶解率随变化如图所示。已知浸出2的pH约为2.5,则应控制焙烧条件使该钒钙盐为。该培烧反应的化学方程式是。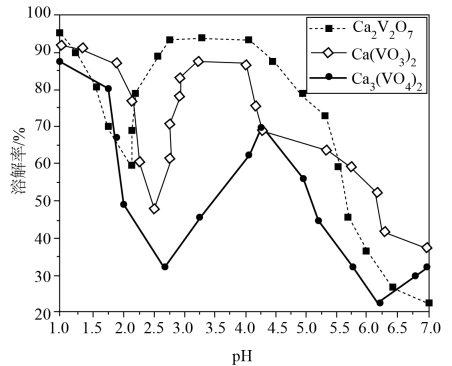 (6)、微细碳酸钙广泛应用于医药、食品等领域,某种碳酸钙晶胞如图所示。已知 , 该晶体密度为(列出计算式,阿伏加德罗常数的值为)。
(6)、微细碳酸钙广泛应用于医药、食品等领域,某种碳酸钙晶胞如图所示。已知 , 该晶体密度为(列出计算式,阿伏加德罗常数的值为)。 10. 二氧化碳一甲烷重整反应制备合成气(H2+CO)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
10. 二氧化碳一甲烷重整反应制备合成气(H2+CO)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:①
②
③
④
回答下列问题:
(1)、 , 反应①正向自发进行(填标号)。A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)、反应体系总压强分别为和时,平衡转化率随反应温度变化如图所示,则代表反应体系总压强为的曲线是(填“Ⅰ”“Ⅱ”或“Ⅲ”),判断依据是。 (3)、当反应体系总压强为时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,的物质的量先增加后减少,主要原因是。
(3)、当反应体系总压强为时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,的物质的量先增加后减少,主要原因是。 (4)、恒温恒压条件下,向容器中通入和 , 达到平衡时的转化率为的转化率为 , 碳单质的物质的量为的物质的量为 , 反应①用摩尔分数表示的平衡常数(结果保留两位小数)。
(4)、恒温恒压条件下,向容器中通入和 , 达到平衡时的转化率为的转化率为 , 碳单质的物质的量为的物质的量为 , 反应①用摩尔分数表示的平衡常数(结果保留两位小数)。上述平衡时 , 向体系通入气,重新达到平衡时, , 则ab(填“>”“<”或“=”)。(已知反应的 , 物质的摩尔分数)
11. 多丁纳德(化合物K)是一种治疗痛风的药物,以下为其合成路线之一(部分反应条件已简化)。
已知:

回答下列问题:
(1)、B的化学名称是。(2)、D中官能团的名称为、。(3)、由F和H反应生成I的化学方程式为 , 反应类型为。(4)、由I转变为J可选用的试剂是____(填标号)。A、 B、
B、 C、稀
D、溶液
(5)、设计反应1和反应2的目的是。(6)、在D的同分异构体中,同时满足下列条件的共有种;
C、稀
D、溶液
(5)、设计反应1和反应2的目的是。(6)、在D的同分异构体中,同时满足下列条件的共有种;①含有苯环;②遇溶液显紫色;③与溶液反应放出。
其中,核磁共振氢谱显示为五组峰,且峰面积比为的同分异构体的结构简式为。