(九省联考)2024年1月普通高等学校招生全国统一考试适应性测试化学试题(适用地区:江西)
试卷更新日期:2024-01-30 类型:高考模拟
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 杭州亚运会首次实现亚运会“碳中和”,下列属于有机高分子材料的是( )A、“大莲花”场馆的主体结构材料——钢 B、场馆顶部的覆盖膜——聚四氟乙烯 C、场地的防滑涂层——石墨烯 D、主火炬使用的可再生燃料——甲醇2. 关于反应 , 下列说法正确的是( )A、分子中没有极性键 B、的模型和空间结构一致 C、的电子式为
 D、分子之间的范德华力强于氢键
3. 下图是一种改进的制备乙炔气体的装置。装置为自制仪器,下列仪器中与作用相同的是( )
D、分子之间的范德华力强于氢键
3. 下图是一种改进的制备乙炔气体的装置。装置为自制仪器,下列仪器中与作用相同的是( )
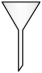

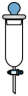
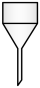
A.漏斗
B.分液漏斗
C.滴液漏斗
D.布氏漏斗
A、A B、B C、C D、D4. 火箭表面耐高温涂层的制备反应为。阿伏加德罗常数的值为 , 下列说法正确的是( )A、中共价键的数目为 B、中含有的中子数为 C、固体含有的数目为 D、消耗时,该反应中转移的电子数为5. 以下探究目的对应的实验方案最合适的是( )实验方案
探究目的
A
向溶液中加入金属
比较和的还原能力
B
分别向稀硝酸和稀醋酸中加入铜粉
比较稀硝酸和稀醋酸的酸性强弱
C
将浓硫酸滴入乙醇中,加热至 , 生成的气体通入酸性重铬酸钾溶液
验证乙烯具有还原性
D
向溶液中同时通入和
比较和的氧化能力
A、A B、B C、C D、D6. 水系电池在碳循环方面具有广阔的应用前景。该电池的示意图如下,其中双极膜在工作时催化解离为和 , 并在直流电场的作用下分别向两极迁移。下列说法正确的是( )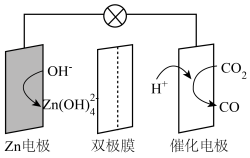 A、放电时,电极为负极,发生还原反应 B、充电时,从电极通过双极膜到达催化电极发生反应 C、放电时,催化电极上的反应为 D、充电时,电极上的反应为7. 化合物是一种无机盐药物。已知为原子序数依次递增的短周期元素,同主族,同周期,基态原子轨道总电子数是轨道电子数的4倍,基态原子的未成对电子数相等。下列说法正确的是( )A、离子半径: B、电负性: C、简单氢化物沸点: D、难溶于水8. 荜茇酰胺是从中药荜茇中提取的一种有抗癌活性的天然生物碱,结构如下图所示。下列说法正确的是( )
A、放电时,电极为负极,发生还原反应 B、充电时,从电极通过双极膜到达催化电极发生反应 C、放电时,催化电极上的反应为 D、充电时,电极上的反应为7. 化合物是一种无机盐药物。已知为原子序数依次递增的短周期元素,同主族,同周期,基态原子轨道总电子数是轨道电子数的4倍,基态原子的未成对电子数相等。下列说法正确的是( )A、离子半径: B、电负性: C、简单氢化物沸点: D、难溶于水8. 荜茇酰胺是从中药荜茇中提取的一种有抗癌活性的天然生物碱,结构如下图所示。下列说法正确的是( )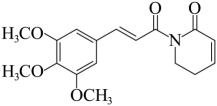 A、分子中有3种官能团 B、双键均为顺式结构 C、分子式为 D、不能使酸性高锰酸钾溶液褪色9. 配合物的制备步骤如下:
A、分子中有3种官能团 B、双键均为顺式结构 C、分子式为 D、不能使酸性高锰酸钾溶液褪色9. 配合物的制备步骤如下:Ⅰ.称取 , 溶解于水中。
Ⅱ.称取 , 溶解于水中,80℃加热,得到砖红色溶液。
III.将步骤II配置的溶液加入到溶液中,加热搅拌约
IV.当溶液析出少量固体时,冷却,过滤,洗涤,烘干,称重。
下列说法错误的是( )
A、步骤II中可使用水浴加热 B、步骤III中为控制反应速率,应逐滴加入 C、步骤II中发生了水解 D、步骤IV中为提高纯度,可用热水洗涤10. 光刻胶是芯片制造的关键材料。以下是一种光刻胶的酸解过程,下列说法正确的是( ) A、X的单体属于碳酸酯 B、X在水中的溶解度大于Y C、Z中所有原子共平面 D、该酸解过程不含消去反应11. 我国科学家成功利用CO还原NO,从源头上减少煤粉燃烧产生的大气污染。一定温度下,在1L的恒容密闭容器中,充入1molCO和1molNO,反应平衡时,测得c(N2)=0.2mol/L,下列说法正确的是( )A、升高温度,正、逆反应速率以相同倍数增大 B、加入催化剂使正反应速率加快,逆反应活化能增大 C、若往容器中再通入1molNO和1molCO2 , 则此时 D、若往容器中再通入2molCO和1molN2 , 则此时12. 马来酸依那普利(记为X,摩尔质量为M,)是一种心血管疾病防治药物,结构式为:
A、X的单体属于碳酸酯 B、X在水中的溶解度大于Y C、Z中所有原子共平面 D、该酸解过程不含消去反应11. 我国科学家成功利用CO还原NO,从源头上减少煤粉燃烧产生的大气污染。一定温度下,在1L的恒容密闭容器中,充入1molCO和1molNO,反应平衡时,测得c(N2)=0.2mol/L,下列说法正确的是( )A、升高温度,正、逆反应速率以相同倍数增大 B、加入催化剂使正反应速率加快,逆反应活化能增大 C、若往容器中再通入1molNO和1molCO2 , 则此时 D、若往容器中再通入2molCO和1molN2 , 则此时12. 马来酸依那普利(记为X,摩尔质量为M,)是一种心血管疾病防治药物,结构式为:
通常使用以下两种方法滴定分析样品中X的质量分数:
方法一:将mg样品溶于有机溶剂中,以的溶液滴定,终点消耗 , 计量关系为;
方法二:将mg样品溶于水中,以的溶液滴定,终点消耗 , 计量关系为。
下列说法正确的是( )
A、方法一滴定终点时, B、方法一 C、方法二滴定终点时, D、方法二13. 朱砂(硫化汞)在众多先秦考古遗址中均有发现,其立方晶系型晶胞如下图所示,晶胞参数为anm,A原子的分数坐标为 , 阿伏加德罗常数的值为 , 下列说法正确的是( ) A、S的配位数是6 B、晶胞中B原子分数坐标为 C、该晶体的密度是 D、相邻两个Hg的最短距离为14. 一定温度下,水溶液中、、的分布分数与的关系如下图。例如。向浓度为的氨水中通入气体。已知该温度下 , 下列说法正确的是( )
A、S的配位数是6 B、晶胞中B原子分数坐标为 C、该晶体的密度是 D、相邻两个Hg的最短距离为14. 一定温度下,水溶液中、、的分布分数与的关系如下图。例如。向浓度为的氨水中通入气体。已知该温度下 , 下列说法正确的是( ) A、通入时, B、当时, C、当时, D、P点时溶液的值为8.3
A、通入时, B、当时, C、当时, D、P点时溶液的值为8.3二、非选择题:本题共4小题,共58分。
-
15. 锡在材料、医药、化工等方面有广泛的应用,锡精矿中主要有、S、、、等杂质元素。下图为锡的冶炼工艺流程。

已知:性质稳定,难溶于酸。
回答下列问题:
(1)、锡的原子序数为50,其价层电子排布式为 , 在元素周期表中位于区。(2)、烟尘中的主要杂质元素是(填元素符号)。(3)、酸浸时,生成 , 该反应的离子方程式为 , 为了提高铅的浸出率,最宜添加 (填标号)。A. B. C. D.
(4)、还原时需加入过量的焦炭,写出该反应的化学方程式。(5)、电解精炼时,以和少量作为电解液,电源的负极与(填“粗锡”或“精锡”)相连;的作用是、。(6)、酸浸滤液中的可用沉淀,并通过与强碱反应获得 , 写出与熔融反应的化学方程式。16. 江西稀土资源丰富。硫酸铵作为一种重要的化工原料,可用于稀土的提取。初始投料比的混合物,其热分解过程如图所示:
已知该过程主要分为三个阶段,其中:
阶段Ⅱ反应:
阶段Ⅲ反应:
回答下列问题:
(1)、中,的空间结构为 , 中心原子的杂化类型为。(2)、阶段Ⅰ不发生氧化还原反应,对应的化学方程式为;图中阶段Ⅰ多次重复实验的实际失重均比理论值偏大,此误差属于(填“偶然误差”或“系统误差”)。(3)、阶段Ⅱ和Ⅲ都是吸热过程,且Ⅱ反应速率更快,下列示意图中能体现上述两反应能量变化的是(填标号),判断的理由是。A.
 B.
B.  C.
C.  D.
D. (4)、该热分解过程中,的作用为。(5)、一定温度下,在真空刚性容器中,的分解过程会发生下列反应:
(4)、该热分解过程中,的作用为。(5)、一定温度下,在真空刚性容器中,的分解过程会发生下列反应:主反应
副反应
两个反应的平衡常数比值随反应温度升高而(填“增大”,“减小”或“不变”);若平衡时总压为的体积分数为0.4,主反应的平衡常数。
(6)、在高温下可以自发分解,原因是。17. 乙酸乙酯在工业上有非常重要的作用。采用乙醇氧化脱氢法制备乙酸乙酯的反应原理及步骤如下:I.将溶液加入至的三颈烧瓶中,冰盐浴条件下,加入乙醇。
Ⅱ. 将溶于中,搅拌下逐滴加入三颈烧瓶中,反应温度控制在。
当混合物的粘度变大时,将温度升高到 , 继续反应。
Ⅲ.将反应得到的绿色乳浊液用等量水稀释,分液,收集上层清液,纯化,干燥。
Ⅳ.分馏,收集馏分。
回到下列问题:
(1)、步骤I中,使用冰盐浴(−25~−10℃)的原因是____(填标号)。A、增强乙醇还原性 B、有利于降温 C、减少乙醇挥发 D、减少硫酸挥发(2)、步骤Ⅱ中,升温到的目的是。(3)、步骤Ⅲ中,上层清液中含有的主要杂质为、。(4)、步骤Ⅲ中,纯化操作步骤为:先用、再用水洗涤。(5)、分馏装置如下图所示,玻璃仪器X的名称为;指出装置(不含夹持、加热等装置)中错误之处。 (6)、相比于用浓硫酸催化乙酸和乙醇制备乙酸乙酯的方法,从反应条件角度评价该方法的优点是。(7)、为实现含铬废液的再生利用,可在含酸性废液中加入 , 写出该反应的离子方程式。18. 盐酸芬戈莫德(H)是一种治疗多发性硬化症的新型免疫抑制剂,以下是其中一种合成路线(部分反应条件已简化)。
(6)、相比于用浓硫酸催化乙酸和乙醇制备乙酸乙酯的方法,从反应条件角度评价该方法的优点是。(7)、为实现含铬废液的再生利用,可在含酸性废液中加入 , 写出该反应的离子方程式。18. 盐酸芬戈莫德(H)是一种治疗多发性硬化症的新型免疫抑制剂,以下是其中一种合成路线(部分反应条件已简化)。
已知:i)
 +R′CH2NO2
+R′CH2NO2
ii)
 +R′OH
+R′OH 
回答下列问题:
(1)、化合物A中碳的2p轨道形成中心电子的大π键。(2)、由B生成C的反应类型为。(3)、试剂X的化学名称为。(4)、由D生成E的反应目的是。(5)、写出由E生成F的化学反应方程式。(6)、在C的同分异构体中,同时满足下列条件的可能结构共有种(不含立体异构)a)含有苯环和硝基;
b)核磁共振氢谱显示有四组峰,峰面积之比为6:2:2:1。
上述同分异构体中,硝基和苯环直接相连的结构简式为。
(7)、参照上:述反应路线,以 和为原料,设计合成
和为原料,设计合成 的路线(无机试剂任选)。
的路线(无机试剂任选)。