(九省联考)2024年1月普通高等学校招生全国统一考试适应性测试化学试题(适用地区:广西)
试卷更新日期:2024-01-30 类型:高考模拟
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 下列广西优秀传统工艺品中,主要由合金材料制成的是( )




A.壮乡铜鼓
B.绣球
C.坭兴陶
D.壮锦
A、A B、B C、C D、D2. 黑火药的爆炸反应为。与该反应有关的下列化学用语表述正确的是( )A、基态S的原子结构示意图为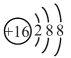 B、的电子式为
B、的电子式为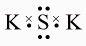 C、的结构式为N≡N
D、的空间构型为
C、的结构式为N≡N
D、的空间构型为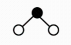 3. 下列有关物质结构与性质的说法错误的是( )A、易溶于 , 可从和都是非极性分子的角度解释 B、对羟基苯甲酸存在分子内氢键,是其沸点比邻羟基苯甲酸的高的主要原因 C、溶于氨水,是由于与反应生成了可溶性配合物 D、熔融能导电,是由于熔融状态下产生了自由移动的和4. 实验室从药用植物里提取“生物碱浸膏”的下列操作中,工具或仪器选用错误的是( )
3. 下列有关物质结构与性质的说法错误的是( )A、易溶于 , 可从和都是非极性分子的角度解释 B、对羟基苯甲酸存在分子内氢键,是其沸点比邻羟基苯甲酸的高的主要原因 C、溶于氨水,是由于与反应生成了可溶性配合物 D、熔融能导电,是由于熔融状态下产生了自由移动的和4. 实验室从药用植物里提取“生物碱浸膏”的下列操作中,工具或仪器选用错误的是( )I.切碎植物
Ⅱ.用乙醇浸出生物碱等
Ⅲ.去除植物残渣
Ⅳ.蒸馏浸出液得浸膏

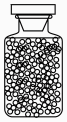
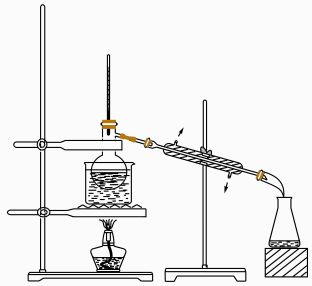
A.铡刀
B.广口瓶
C.分液漏斗
D.蒸馏装置
A、A B、B C、C D、D5. 短周期元素的原子序数依次增大。X的原子核外有1个电子,Y是地壳中含量最多的元素,Z位于元素周期表第IIIA族,W单质可广泛用于生产芯片。下列说法正确的是( )A、原子半径: B、元素电负性: C、W的简单氢化物比Y的稳定 D、Z单质制成的容器可盛放冷浓硫酸6. 10-羟基喜树碱具有抗癌作用,其结构简式如图。下列有关该化合物的说法正确的是( )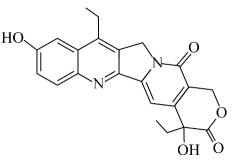 A、有2种含氧官能团 B、可与溶液发生显色反应 C、可与溶液反应产生 D、有2个手性碳原子7. 反应常被用于除去水中残余氯。为阿伏加德罗常数的值,下列说法正确的是( )A、溶液中含有的键数目为 B、25℃、101kPa时,中氯原子的数目为 C、含有质子的数目为 D、通过上述反应除去 , 电子转移的数目为8. 实验小组用过量溶液处理覆铜板得到浸出液,并对其中的物质进行回收,流程如下。下列有关说法正确的是( )
A、有2种含氧官能团 B、可与溶液发生显色反应 C、可与溶液反应产生 D、有2个手性碳原子7. 反应常被用于除去水中残余氯。为阿伏加德罗常数的值,下列说法正确的是( )A、溶液中含有的键数目为 B、25℃、101kPa时,中氯原子的数目为 C、含有质子的数目为 D、通过上述反应除去 , 电子转移的数目为8. 实验小组用过量溶液处理覆铜板得到浸出液,并对其中的物质进行回收,流程如下。下列有关说法正确的是( )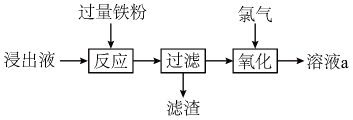 A、浸出液呈中性 B、滤渣只有铜粉 C、用KSCN溶液检验是否“氧化”完全 D、溶液a回收后可用于处理覆铜板9. 为达到实验目的,下列对应的实验方法正确或操作规范的是( )
A、浸出液呈中性 B、滤渣只有铜粉 C、用KSCN溶液检验是否“氧化”完全 D、溶液a回收后可用于处理覆铜板9. 为达到实验目的,下列对应的实验方法正确或操作规范的是( )选项
实验目的
实验方法或操作
A
配制溶液
称取置于容量瓶中,加水至刻度线
B
除去粗盐溶液中的和
向溶液中加入稍过量的溶液,静置、过滤,向滤液中加盐酸至弱酸性
C
探究Cl和I的非金属性强弱
向溶液中滴加新制的氯水,振荡,若溶液变成棕黄色,则Cl的非金属性强于I
D
探究和的大小
向溶液中依次加入5滴溶液、5滴溶液,若先观察到白色沉淀再观察到黑色沉淀,则
A、A B、B C、C D、D10. 利用下图的电化学装置,可实现 对的固定。下列说法错误的是( )
对的固定。下列说法错误的是( )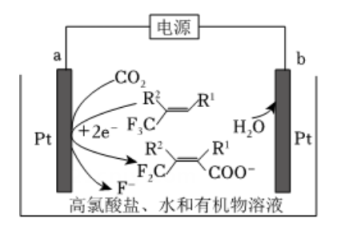 A、向b电极移动 B、a电极的电极反应式为
A、向b电极移动 B、a电极的电极反应式为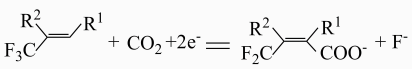 C、电解过程中有生成
D、b电极的Pt用Cu代替后总反应不变
11. 下列表述对应的离子方程式书写正确的是( )A、与酸性溶液反应制备: B、碱性溶液中与反应制备: C、在强酸溶液中生成和: D、弱酸在水中分解生成:12. 某镁镍合金储氢后所得晶体的立方晶胞如图1(为便于观察,省略了2个图2的结构),晶胞边长为apm。下列说法正确的是( )
C、电解过程中有生成
D、b电极的Pt用Cu代替后总反应不变
11. 下列表述对应的离子方程式书写正确的是( )A、与酸性溶液反应制备: B、碱性溶液中与反应制备: C、在强酸溶液中生成和: D、弱酸在水中分解生成:12. 某镁镍合金储氢后所得晶体的立方晶胞如图1(为便于观察,省略了2个图2的结构),晶胞边长为apm。下列说法正确的是( )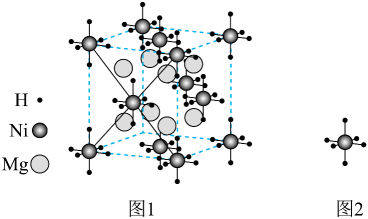 A、晶体的化学式为 B、晶胞中与1个Mg配位的Ni有6个 C、晶胞中2个Ni之间的最近距离为apm D、镁镍合金中Mg、Ni通过离子键结合13. 肼()是一种含氢量高的燃料。向恒容密闭容器内加入 , 一定条件下体系中存在以下平衡:I.Ⅱ.不同温度下达到平衡时,均几乎完全分解,分解产物的物质的量如图。下列说法正确的是( )
A、晶体的化学式为 B、晶胞中与1个Mg配位的Ni有6个 C、晶胞中2个Ni之间的最近距离为apm D、镁镍合金中Mg、Ni通过离子键结合13. 肼()是一种含氢量高的燃料。向恒容密闭容器内加入 , 一定条件下体系中存在以下平衡:I.Ⅱ.不同温度下达到平衡时,均几乎完全分解,分解产物的物质的量如图。下列说法正确的是( )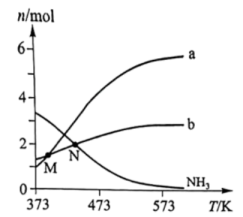 A、曲线a对应的物质是 B、低于M点对应温度时,以反应Ⅰ为主 C、体系中还存在 D、N点时,体系内为3:414. 溶液滴定溶液时,、各含磷元素微粒的和的关系如图。下列说法中正确的是( )
A、曲线a对应的物质是 B、低于M点对应温度时,以反应Ⅰ为主 C、体系中还存在 D、N点时,体系内为3:414. 溶液滴定溶液时,、各含磷元素微粒的和的关系如图。下列说法中正确的是( ) A、①为的与的关系 B、b点时,溶液中 C、的 D、d点时,溶液中存在着
A、①为的与的关系 B、b点时,溶液中 C、的 D、d点时,溶液中存在着二、非选择题:本题共4小题,共58分。
-
15. 层状结构薄膜能用于制作电极材料。薄膜由辉钼矿(主要含及少量FeO、)制得后再与S经气相反应并沉积得到,其流程如下。
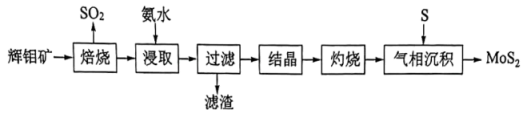
回答下列问题:
(1)、“焙烧”产生的用溶液吸收生成的离子方程式为。(2)、“焙烧”后的固体用氨水“浸取”得到重钼酸铵溶液,为提高“浸取”速率,可采用的措施是(举一例)。(3)、“灼烧”过程中需回收利用的气体是(填化学式)。(4)、在650℃下“气相沉积”生成的反应需在特定气流中进行,选用Ar而不选用形成该气流的原因是。(5)、层状晶体与石墨晶体结构类似,层状的晶体类型为。将嵌入层状充电后得到的可作电池负极,该负极放电时的电极反应式为。结合原子结构分析,能嵌入层间可能的原因是。16. 工业尾气脱硝是减少空气污染的重要举措。回答下列问题:(1)、已知相关反应的热力学数据如下。反应
①脱硝反应的。时,为了提高该反应中NO的平衡转化率,理论上可采取的措施是。
A.恒容时增大的压强 B.减小反应容器的容积
C.移去部分 D.选择合适的催化剂
②另一脱硝反应的。
(2)、模拟工业尾气脱硝:一定条件下,将的气体与Ar混合,匀速通过催化脱硝反应器,测得NO去除率和转化率随反应温度的变化如图。
当温度低于时,NO的去除率随温度升高而升高,可能原因是;高于时,NO的去除率随温度升高而降低,结合(1)的信息分析其可能原因是。
(3)、中国科学家利用Cu催化剂实现电化学脱硝。通过理论计算推测电解池阴极上NO可能的转化机理及转化步骤的活化能分别如下(*表示催化剂表面吸附位,如表示吸附于催化剂表面的NOH)。I.
Ⅱ.
Ⅲ.
Ⅳ.
V.
上述反应机理中,Ⅱ~V中速率最慢的步骤是。若电路中有电子流过,其中生成的选择性为95%,电解池阴极生成的的物质的量为mmol。
17. 铜(Ⅰ)配合物的制备及纯度分析步骤如下。Ⅰ.制备
将乙腈、、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
Ⅱ.纯度分析
取mg产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成溶液。取溶液,加入指示剂后,再用标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。

已知:①沸点为81℃,酸性条件下遇水生成;
②较易被空气氧化;
③EDTA与形成1:1配合物;
④滴定需在弱碱性条件下进行。
回答下列问题:
(1)、图中仪器a的作用是;b中应加入作为最佳传热介质。(2)、加入过量铜粉能提高产物的纯度,可能的原因是。(3)、“一系列操作”依次为、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。(4)、与足量浓硝酸发生反应的离子方程式为。(5)、加入醋酸钠溶液的主要目的是。(6)、测得产品的纯度为(用含m、c、V的代数式表示)。(7)、下列情况会导致产品纯度测定结果偏高的有____。A、产品中含有 B、滴定终点时俯视读数 C、盛装EDTA溶液的滴定管未润洗 D、产品干燥不充分18. 英菲替尼(化合物L)是治疗胆管癌的新型药物,其合成路线如下。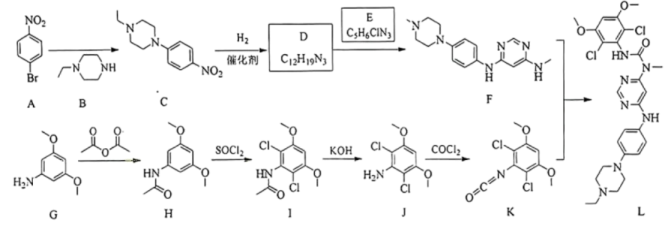
回答下列问题:
(1)、A的化学名称是。(2)、由A生成C的反应类型是。(3)、E的结构简式为。(4)、由G→J的转化过程可知,G转化为H的目的是(5)、符合下列条件的B的同分异构体共有种,其中一种的结构简式为。①分子中含环状结构 ②核磁共振氢谱显示2组峰
(6)、L中氮原子的杂化方式为。(7)、1,3-二苯基脲( )是某些药物分子的重要结构单元。参照上述合成路线,写出以苯为原料制备1,3-二苯基脲的合成路线(无机试剂任选)。
)是某些药物分子的重要结构单元。参照上述合成路线,写出以苯为原料制备1,3-二苯基脲的合成路线(无机试剂任选)。