(九省联考)2024年1月普通高等学校招生全国统一考试适应性测试化学试题(适用地区:贵州)
试卷更新日期:2024-01-30 类型:高考模拟
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
-
1. 奋进中的贵州取得了举世瞩目的成就,对下列成就涉及的化学知识说法错误的是( )A、“中国天眼”所使用的钢铁结构圈梁属于金属合金材料 B、“大数据中心”的电子设备芯片使用的材料是二氧化硅 C、“中国桥梁看贵州”,建造桥梁的水泥属于硅酸盐材料 D、“县县通高速”,高速路面使用的改性沥青是有机材料2. 可用作白色颜料和阻燃剂,在实验室中可利用的水解反应制取,总反应可表示为。下列化学用语表示正确的是( )A、的电子式:
 B、基态原子价层电子排布图:
B、基态原子价层电子排布图: C、和互为同位素
D、的VSEPR模型:
C、和互为同位素
D、的VSEPR模型: 3. 为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,含有的中子数为 B、常温下,中含有的孤电子对数为 C、溶液中含有的数为 D、和足量充分反应转移的电子数为4. 根据实验目的,下列实验所采用的实验方法和主要仪器错误的是( )
3. 为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,含有的中子数为 B、常温下,中含有的孤电子对数为 C、溶液中含有的数为 D、和足量充分反应转移的电子数为4. 根据实验目的,下列实验所采用的实验方法和主要仪器错误的是( )实验目的
柑橘中有机酸含量的测定
菠菜中叶绿素的色谱分离
茶叶中钙离子的沉淀分离
海带提碘过程中碘单质的萃取分离
实验方法
酸碱滴定法
离子交换法
沉淀法
萃取法
主要仪器




选项
A
B
C
D
A、A B、B C、C D、D5. 下列生产活动中对应的离子方程式正确的是( )A、用溶液蚀刻覆铜板制作印刷电路板: B、向冷的石灰乳中通入制漂白粉: C、用溶液除去锅炉水垢中的: D、用丙烯腈电合成己二腈,在阳极发生的电极反应:6. 苯甲酰胺是常见的酰胺类物质,可用于合成农药和医药,其结构简式如图所示。下列说法正确的是( )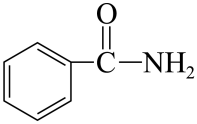 A、分子式为 B、分子中含有1个手性碳原子 C、分子中碳原子的杂化轨道类型是 D、在碱性条件下加热水解,可生成苯甲酸盐和氨7. 劳动创造美好生活。下列劳动者的工作内容所涉及化学知识错误的是( )
A、分子式为 B、分子中含有1个手性碳原子 C、分子中碳原子的杂化轨道类型是 D、在碱性条件下加热水解,可生成苯甲酸盐和氨7. 劳动创造美好生活。下列劳动者的工作内容所涉及化学知识错误的是( )选项
工作内容
化学知识
A
工程师在船舶外壳安装锌块保护船体
此电化学保护中锌块作正极
B
医生为糖尿病患者开处方并叮嘱患者控制米饭类食物的摄入量
淀粉能水解生成葡萄糖
C
污水处理员利用硫酸铝、聚合氯化铝等混凝剂除去水体中的细小悬浮物
混凝剂遇水可形成胶体吸附悬浮物而聚沉
D
园艺师给花卉施肥时,草木灰和铵态氮肥不混合施用
碳酸钾和铵盐相互促进水解降低氮肥的肥效
A、A B、B C、C D、D8. 某种快速充电器所使用的半导体材料是氮化镓(GaN),半导体材料还有GaY、GaZ、XW等。W、X、Y、Z在周期表中相对位置如下所示,其中W的一种同位素可用于文物年代测定。下列说法正确的是( )W
X
Y
Ga
Z
A、原子半径:Z>Ga B、XW属于共价晶体 C、简单氢化物的稳定性:X>Y D、最高价氧化物对应水化物的酸性:Z>Y9. 磷酸聚合可以生成链状多磷酸和环状多磷酸,三分子磷酸聚合形成的链状三磷酸结构如图所示。下列说法正确的是( ) A、键能: B、元素的电负性: C、的空间构型:平面四边形 D、六元环状三磷酸的分子式:10. 下列实验操作、现象和结论均正确的是( )
A、键能: B、元素的电负性: C、的空间构型:平面四边形 D、六元环状三磷酸的分子式:10. 下列实验操作、现象和结论均正确的是( )选项
实验操作及现象
结论
A
分别向等量乙醇和水中加入绿豆大的钠,钠与水反应更剧烈
水分子中的氢原子比乙醇羟基中的氢原子活泼
B
向某稀溶液中加入NaOH溶液,能产生使湿润的蓝色石蕊试纸变红的气体
溶液中含有
C
向葡萄糖溶液中加入少量NaOH溶液和CuSO4溶液,产生砖红色沉淀
新制Cu(OH)2可检验葡萄糖
D
向少量酸性KMnO4溶液中滴加少量FeCl2溶液,再滴加2滴KSCN溶液,溶液先褪色后变红
Fe2+具有氧化性
A、A B、B C、C D、D11. 高铁酸钠是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为 , 杂质有及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是( ) A、“碱浸”可以除去废铁屑中的油脂 B、“滤渣”的主要成分是和 C、“操作Ⅰ”通入的空气可以用溶液代替 D、若流程改为先“氧化”后“调”,可能会生成12. 在时,对浓度均为盐酸和醋酸的混合溶液进行如下操作。下列说法正确的是( )A、加入少量固体,溶液中将减小 B、加入相同浓度的溶液,所得溶液 C、加入溶液,若所得溶液 , 则水电离
A、“碱浸”可以除去废铁屑中的油脂 B、“滤渣”的主要成分是和 C、“操作Ⅰ”通入的空气可以用溶液代替 D、若流程改为先“氧化”后“调”,可能会生成12. 在时,对浓度均为盐酸和醋酸的混合溶液进行如下操作。下列说法正确的是( )A、加入少量固体,溶液中将减小 B、加入相同浓度的溶液,所得溶液 C、加入溶液,若所得溶液 , 则水电离 D、加入相同浓度的溶液,若忽略混合时的体积变化,此时溶液中:
13. 钠基海水电池是一种能量密度高、环境友好的储能电池(示意图如下),电极材料为钠基材料和选择性催化材料(能抑制海水中的吸附和氧化),固体电解质只允许透过。下列说法正确的是( )
D、加入相同浓度的溶液,若忽略混合时的体积变化,此时溶液中:
13. 钠基海水电池是一种能量密度高、环境友好的储能电池(示意图如下),电极材料为钠基材料和选择性催化材料(能抑制海水中的吸附和氧化),固体电解质只允许透过。下列说法正确的是( ) A、放电时,a电极发生还原反应 B、放电时,电极的电势低于电极 C、充电时,电极的电极反应式为: D、充电时,每转移电子,理论上有由电极迁移到电极14. 叔丁基溴可与硝酸银在醇溶液中反应:
A、放电时,a电极发生还原反应 B、放电时,电极的电势低于电极 C、充电时,电极的电极反应式为: D、充电时,每转移电子,理论上有由电极迁移到电极14. 叔丁基溴可与硝酸银在醇溶液中反应:反应分步进行:
①
②
下图是该反应能量变化图。下列说法正确的是( )
 A、选用催化剂可改变反应的大小 B、图中对应的物质是 C、其他条件不变时,的浓度越高,总反应速率越快 D、其他条件不变时,的浓度是总反应速率的决定因素
A、选用催化剂可改变反应的大小 B、图中对应的物质是 C、其他条件不变时,的浓度越高,总反应速率越快 D、其他条件不变时,的浓度是总反应速率的决定因素二、非选择题:本题共4小题,共58分。
-
15. 地球上没有垃圾,只有放错地方的资源。某化学兴趣小组对厨余垃圾中的鸡蛋壳进行再利用。主要实验步骤如下:
Ⅰ.鸡蛋壳预处理
将鸡蛋壳洗净干燥后研磨成粉,高温煅烧后加水得到石灰乳。
Ⅱ.制备葡萄糖酸钙
在石灰乳中边搅拌边缓缓加入葡萄糖酸溶液至pH为6~7,充分反应后过滤,将滤液蒸发浓缩、冷却结晶得到葡萄糖酸钙晶体。
Ⅲ.制备营养强化剂G
取葡菌糖酸钙晶体,用蒸馏水溶解,边搅拌边逐滴加入适量溶液,待反应完成后减压过滤;滤液转入烧杯中,加入适量乙醇,充分搅拌至晶体析出,减压过滤得到的粗产物;将粗产物提纯后,得到的晶体。
已知:①葡萄糖酸分子式为 , 结构简式为:

②提纯回收率指提纯后产物的质量占粗产物质量的百分比。
回答下列问题:
(1)、步骤Ⅰ中研磨鸡蛋壳所需的仪器是(选填“蒸发皿”“研钵”或“坩埚”)。(2)、步骤Ⅱ中用pH试纸测定溶液pH的操作方法是。(3)、步骤Ⅱ中涉及的化学反应方程式是。(4)、步骤Ⅲ中溶液需逐滴加入的目的是;提纯粗产物采用的方法是。(5)、下图中减压过滤装置是(填标号);与常压过滤相比,减压过滤的优点是。 (6)、营养强化剂G的名称是;G的提纯回收率是%。16. 钴属于稀缺性金属。利用“微波辅助低共熔溶剂”浸取某废旧锂离子电池中钴酸锂粗品制备产品,实现资源的循环利用。主要工艺流程如下:
(6)、营养强化剂G的名称是;G的提纯回收率是%。16. 钴属于稀缺性金属。利用“微波辅助低共熔溶剂”浸取某废旧锂离子电池中钴酸锂粗品制备产品,实现资源的循环利用。主要工艺流程如下:
已知:①氯化胆碱是一种铵盐;
②在溶液中常以(蓝色)和(粉红色)形式存在;
③时,。
回答下列问题:
(1)、中的化合价为。(2)、下图为“微波共熔”中氯化胆碱-草酸和粗品以不同的液固比在下微波处理后锂和钴的浸取率图,则最佳液固比为。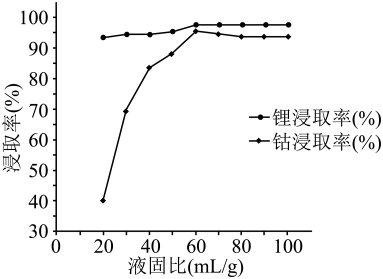 (3)、“水浸”过程中溶液由蓝色变为粉红色,该变化的离子方程式为。(4)、时,“沉钴”反应完成后,溶液 , 此时。(5)、“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是。(6)、“高温烧结”中需要通入空气,其作用是。(7)、锂离子电池正极材料在多次充放电后由于可循环锂的损失,结构发生改变生成 , 导致电化学性能下降。
(3)、“水浸”过程中溶液由蓝色变为粉红色,该变化的离子方程式为。(4)、时,“沉钴”反应完成后,溶液 , 此时。(5)、“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是。(6)、“高温烧结”中需要通入空气,其作用是。(7)、锂离子电池正极材料在多次充放电后由于可循环锂的损失,结构发生改变生成 , 导致电化学性能下降。①晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为(用离子符号表示)。
②使用和溶液可以实现的修复,则修复过程中的化学反应方程式为。
 17. 苯乙烯是重要的有机化工原料,可用乙苯为原料制备苯乙烯。制备方法有直接脱氢法和氧化脱氢法。在时反应的热化学方程式及其平衡常数如下:
17. 苯乙烯是重要的有机化工原料,可用乙苯为原料制备苯乙烯。制备方法有直接脱氢法和氧化脱氢法。在时反应的热化学方程式及其平衡常数如下:(ⅰ)直接脱氢:
(ⅱ)氧化脱氢:
回答下列问题:
(1)、①反应的 , 平衡常数(用表示)。②氧化脱氢的反应趋势远大于直接脱氢,其原因是。
③提高氧化脱氢反应平衡转化率的措施有、。
(2)、已知 , 忽略随温度的变化。当时,反应能自发进行。在下,直接脱氢反应的和随温度变化的理论计算结果如图所示。
①直接脱氢反应在常温下(选填“能”或“不能”)自发。
②随温度的变化曲线为(选填“a”或“b”),判断的理由是。
③在某温度、下,向密闭容器中通入气态乙苯发生直接脱氢反应,达到平衡时,混合气体中乙苯和氢气的分压相等,该反应的平衡常数(保留小数点后一位;分压总压物质的量分数)。
(3)、乙苯脱氢制苯乙烯往往伴随副反应,生成苯和甲苯等芳香烃副产物。一定温度和压强条件下,为了提高反应速率和苯乙烯选择性,应当。18. 化合物J具有多种生物药理活性。某研究小组以植物中提取的对-茴香醛A和香草醛F为原料合成J,一种合成路线如下(部分反应条件和过程已简化):
已知:
 (为或烷基)
(为或烷基)回答下列问题:
(1)、A中的官能团名称是。(2)、的结构简式是。(3)、由生成经过①②两步反应,写出第①步反应的化学方程式。(4)、根据Ⅰ的结构,发生加成反应时,Ⅰ的碳碳双键断裂的是键(选填“”或“”)。(5)、根据合成路线,指出这步反应在合成中的作用是。(6)、根据化合物的结构,不能发生的反应是(选填“酯化反应”“水解反应”或“消去反应”)。(7)、化合物有多种同分异构体,满足下列条件的有种(不考虑立体异构)。①加入溶液发生显色反应;②与溶液反应有气体放出。
其中,核磁共振氢谱理论上有5组峰,且峰面积之比为的同分异构体结构简式是。