2023-2024学年沪教版初中化学九年级下册 7.2 常见的酸和碱 同步分层训练基础题(第1课时)
试卷更新日期:2024-01-29 类型:同步测试
一、选择题
-
1. “酸”对于我们来说一定不陌生。下列说法正确的是A、稀盐酸不能用于除铁锈 B、浓硫酸具有腐蚀性 C、浓盐酸没有挥发性 D、稀盐酸能使无色酚酞溶液变红2. 下列实验操作正确的是( )A、稀释浓硫酸
 B、测定溶液酸碱性
B、测定溶液酸碱性 C、测定溶液
C、测定溶液 D、称量一定量的氢氧化钠
D、称量一定量的氢氧化钠 3. 下列物质的用途主要利用其物理性质的是( )A、焦炭用于冶炼金属 B、干冰用于人工降雨 C、白醋除去水壶水垢 D、镁粉是照明弹原料4. 化学学科核心素养展现了化学课程对学生发展的重要价值。下列说法错误的是( )A、化学观念:酸溶液中都含有 , 所以酸溶液具有相似的化学性质 B、科学思维:能使燃着的小木条熄灭,所以能使燃着的小木条熄灭的气体一定是 C、科学探究与实践:对着干冷的玻璃片呼气,证明呼出的气体中含有水蒸气 D、科学态度与责任:可燃性气体遇明火易发生爆炸,因此加油站要严禁烟火5. 下列相关事实用微观粒子的知识解释错误的是( )
3. 下列物质的用途主要利用其物理性质的是( )A、焦炭用于冶炼金属 B、干冰用于人工降雨 C、白醋除去水壶水垢 D、镁粉是照明弹原料4. 化学学科核心素养展现了化学课程对学生发展的重要价值。下列说法错误的是( )A、化学观念:酸溶液中都含有 , 所以酸溶液具有相似的化学性质 B、科学思维:能使燃着的小木条熄灭,所以能使燃着的小木条熄灭的气体一定是 C、科学探究与实践:对着干冷的玻璃片呼气,证明呼出的气体中含有水蒸气 D、科学态度与责任:可燃性气体遇明火易发生爆炸,因此加油站要严禁烟火5. 下列相关事实用微观粒子的知识解释错误的是( )选项
事实
解释
A
固体配成溶液后进行化学反应,可以提高反应速率
反应时分子或离子直接接触
B
氯化钠溶液能导电
溶液中有自由移动的离子
C
夏季的时候铁轨间空隙变小
温度升高,原子的间隔变大
D
稀硫酸和稀盐酸有相似的化学性质
酸中都含有氢元素
A、A B、B C、C D、D6. 硫酸是实验室常用的化学试剂.下列有关硫酸的说法,错误的是( )A、用浓硫酸作为某些气体的干燥剂 B、蘸取浓硫酸的木棍会变黑 C、将溶质质量分数的浓硫酸稀释成的硫酸溶液需要加入的水 D、用适量的稀硫酸除去铁表面的铁锈7. 金属活动性顺序表在化学学习中有重要作用,下列说法正确的是( )A、在Al、Mg、Fe中金属活动性最强的是Al B、“真金不怕火炼”说明金在高温时也不与氧气反应 C、Zn不能置换稀硫酸中的氢 D、Ag能将硝酸铜溶液中的铜置换出来8. 下列物质实验现象描述错误的是( )A、打开浓盐酸的试剂瓶,瓶口冒“白雾” B、铁丝放入硫酸铜溶液中表面会析出白色固体,溶液由蓝色变为无色 C、木炭在氧气中燃烧,发白光,放出热量,产生能使澄清石灰水变浑浊的气体 D、硫在空气中燃烧,发出淡蓝色火焰,放出热量,产生刺激性气味的气体9. 下列实验现象正确的是( )A、往铁锈中加入足量的稀盐酸,溶液变浅绿色,产生无色气泡 B、将CO通往灼热氧化铜,红色固体变黑色 C、打开浓盐酸瓶盖,瓶口冒白雾 D、电解水时,正极气体是负极气体体积的2倍10. 在一次劳动实践课前,同学们就家务劳动中的做法展开了讨论,下列讨论合理的是( )A、用食醋去除水壶水垢 B、用水扑灭炒菜时着火的油锅 C、用钢丝球擦洗铝制炊具 D、用食盐水浸泡铁制刀具11. 下列说法正确的是( )A、酸雨的 , 是因为其中溶解了、、等空气污染物 B、生铁和钢都是铁的合金,与纯铁比它们的硬度大、熔点高 C、燃烧属于剧烈的氧化反应,放热,食物腐败属于缓慢的氧化反应,吸热 D、打开盛放浓盐酸的试剂瓶,瓶口出现白雾12. HCl的水溶液俗称盐酸,下列关于HCl的说法正确的( )A、组成:HCl气体由H+、Cl-构成 B、性质:将HCl气体通入紫色石蕊试液,石蕊试液变蓝 C、用途:浓盐酸常用来做干燥剂 D、生产:工业上可用氯化钠来生产盐酸二、填空题
-
13. 如图表示化学反应中溶液的颜色变化,请回答下列问题。
 (1)、酸溶液有相似化学性质的原因是溶液中都含有(填离子符号)(2)、若X是稀硫酸,则b可能是(填化学式)(3)、若X是稀盐酸,则d(选填“可能”或“不可能”)是单质。(4)、写出符合反应③的一个化学方程式:14. 《本草纲目》中记载:“绿矾,酸涌涩收,燥湿解毒,化涎之功”。以含铁污泥(主要成分为Fe2O3、FeO、Fe,还含有SiO2等杂质,SiO2等杂质与酸不反应,且难溶于水)为原料生产绿矾(FeSO4·7H2O)的工艺流程如图:
(1)、酸溶液有相似化学性质的原因是溶液中都含有(填离子符号)(2)、若X是稀硫酸,则b可能是(填化学式)(3)、若X是稀盐酸,则d(选填“可能”或“不可能”)是单质。(4)、写出符合反应③的一个化学方程式:14. 《本草纲目》中记载:“绿矾,酸涌涩收,燥湿解毒,化涎之功”。以含铁污泥(主要成分为Fe2O3、FeO、Fe,还含有SiO2等杂质,SiO2等杂质与酸不反应,且难溶于水)为原料生产绿矾(FeSO4·7H2O)的工艺流程如图: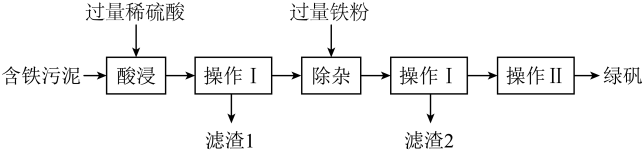 (1)、实验室进行操作I时,玻璃棒的作用是。(2)、“酸浸”时,为加快反应速率,可采取的措施是。(3)、“酸浸”中发生的反应的化学方程式为。(4)、“除杂”中铁粉能把Fe3+转化为Fe2+ , 该反应的基本反应类型是(写一个)。(5)、“滤渣2”的主要成分是。15. 某同学在实验室用浓硫酸配制100g质量分数为9.8%的稀硫酸溶液。他查阅资料得知:常用浓硫酸的质量分数为98.3%,其密度为1.84g·cm-3.浓硫酸是一种高沸点、难挥发的强酸,具有强烈的腐蚀性,能以任意比与水混溶,加水稀释后可以得到稀硫酸。请回答:
(1)、实验室进行操作I时,玻璃棒的作用是。(2)、“酸浸”时,为加快反应速率,可采取的措施是。(3)、“酸浸”中发生的反应的化学方程式为。(4)、“除杂”中铁粉能把Fe3+转化为Fe2+ , 该反应的基本反应类型是(写一个)。(5)、“滤渣2”的主要成分是。15. 某同学在实验室用浓硫酸配制100g质量分数为9.8%的稀硫酸溶液。他查阅资料得知:常用浓硫酸的质量分数为98.3%,其密度为1.84g·cm-3.浓硫酸是一种高沸点、难挥发的强酸,具有强烈的腐蚀性,能以任意比与水混溶,加水稀释后可以得到稀硫酸。请回答: (1)、通过计算,需量取5.4mL浓硫酸,选择量筒(填“A”或“B”)量取;(2)、若完成溶液的配制,除如图所提供的仪器外,还需用到的玻璃仪器是 , 浓硫酸稀释时应将中(填“a”或“b”);
(1)、通过计算,需量取5.4mL浓硫酸,选择量筒(填“A”或“B”)量取;(2)、若完成溶液的配制,除如图所提供的仪器外,还需用到的玻璃仪器是 , 浓硫酸稀释时应将中(填“a”或“b”);a.水注入浓硫酸 b.浓硫酸注入水
(3)、若用量筒量取浓硫酸时俯视读数,所配溶液溶质质量分数9.8%(填“大于”“小于”或“等于”)。16. 实验室中盛装还未使用的浓硫酸试剂瓶上的标签如图所示,根据有关信息计算:硫酸 化学纯(CP)
(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84g/cm3
质量分数:98%
(1)、硫酸中氢、硫、氧三种元素的原子个数比是。(2)、该试剂瓶中含硫酸的质量是g;(精确到0.1)(3)、要把50g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的体积是mL。三、计算题
-
17. 用镊子将一未经砂纸打磨的铝片放于一洁净的烧杯中,然后向烧杯中滴加足量的稀盐酸。使其充分反应,生成氢气。回答下列问题。(1)、刚开始滴加稀盐酸时,没有氢气放出的原因是;(2)、计算该铝片中单质铝的质量。