2023-2024学年沪教版初中化学九年级下册 6.3 物质的溶解性 同步分层训练培优题(第2课时)
试卷更新日期:2024-01-26 类型:同步测试
一、选择题
-
1. 下列表示的实验操作中,可以将食盐结晶出来的是( )A、
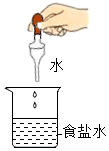 B、
B、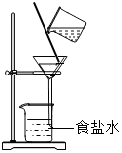 C、
C、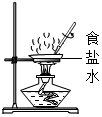 D、
D、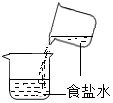 2. 下表是1个标准气压下,氧气在淡水和海水中不同温度时的溶解度。下列叙述错误的是( )
2. 下表是1个标准气压下,氧气在淡水和海水中不同温度时的溶解度。下列叙述错误的是( )淡水中mL/L
海水中mL/L
5℃
9.0
7.2
25℃
6.04
4.95
A、淡水鱼不易在海水中生存 B、25℃时,氧气在海水中的溶解度比在淡水中的小 C、氧气在水中的溶解度随温度升高而减小 D、温度对气体在水中的溶解度没有影响3. 试管内盛有20℃的饱和硝酸钾溶液,其上漂浮一小木块。如图所示,将试管插入烧杯内的冰水混合物中, 一段时间后, 下列有关说法不正确的是( ) A、试管内溶液的质量变小 B、试管内有固体析出 C、试管内溶液的溶质质量分数变大 D、小木块浸入溶液内的体积变大4. 不同温度下,KNO3的溶解度如下表所示。如图进行实验。所得溶液中属于不饱和溶液的是( )
A、试管内溶液的质量变小 B、试管内有固体析出 C、试管内溶液的溶质质量分数变大 D、小木块浸入溶液内的体积变大4. 不同温度下,KNO3的溶解度如下表所示。如图进行实验。所得溶液中属于不饱和溶液的是( )温度/℃
20
30
40
溶解度/g
31.6
45.8
63.9
 A、②③ B、②④ C、②③④ D、①③④5. 木块在硝酸钾溶液中排开液体的情况如图所示,下列说法正确的是 ( )
A、②③ B、②④ C、②③④ D、①③④5. 木块在硝酸钾溶液中排开液体的情况如图所示,下列说法正确的是 ( )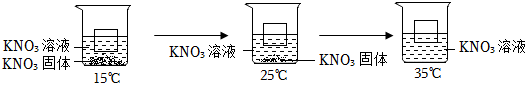 A、实验过程中溶液的密度保持不变 B、实验过程中溶液均为饱和溶液 C、的溶解度随温度的升高而增大 D、时所得溶液溶质质量分数最大6. 根据下图判断。下列说法中正确的是( )
A、实验过程中溶液的密度保持不变 B、实验过程中溶液均为饱和溶液 C、的溶解度随温度的升高而增大 D、时所得溶液溶质质量分数最大6. 根据下图判断。下列说法中正确的是( ) A、除去甲物质中含有少量的乙,可通过蒸发结晶的方法 B、一定温度下,曲线a的压强大于曲线b的压强 C、20℃时,100g丁的饱和溶液中含有丁物质31.6g D、丙物质的溶解度随温度升高而增大7. 一种物质(溶质)溶解在另一种物质(溶剂)中的能力称为溶解性,溶解性的强弱常用在一定条件下溶解度的大小来表示。下列有关物质溶解性的说法正确的是( )A、用搅拌或加热的方法能增大氯化钠在水中的溶解度 B、20℃时,NaOH 的溶解度为 109g,则 20℃时,50g 水中最多可溶解 NaOH 固体 54.5g C、气体在水中的溶解度随着温度的升高而增大,随着压强的增大而减小 D、将某物质的饱和溶液降低温度一定有溶质析出8. 如图所示,M、N两种固体物质的溶解度曲线分别用m、n表示。下列说法中,正确的是( )。
A、除去甲物质中含有少量的乙,可通过蒸发结晶的方法 B、一定温度下,曲线a的压强大于曲线b的压强 C、20℃时,100g丁的饱和溶液中含有丁物质31.6g D、丙物质的溶解度随温度升高而增大7. 一种物质(溶质)溶解在另一种物质(溶剂)中的能力称为溶解性,溶解性的强弱常用在一定条件下溶解度的大小来表示。下列有关物质溶解性的说法正确的是( )A、用搅拌或加热的方法能增大氯化钠在水中的溶解度 B、20℃时,NaOH 的溶解度为 109g,则 20℃时,50g 水中最多可溶解 NaOH 固体 54.5g C、气体在水中的溶解度随着温度的升高而增大,随着压强的增大而减小 D、将某物质的饱和溶液降低温度一定有溶质析出8. 如图所示,M、N两种固体物质的溶解度曲线分别用m、n表示。下列说法中,正确的是( )。 A、30℃时,M的溶解度小于N的溶解度 B、点P表示1C时M、N的溶解度相等 C、M、N都是难溶物质 D、阴影处各点对应的溶液(不包含曲线上的点)是M的不饱和溶液,N的饱和溶液9. 将30g固体物质X (不含结晶水)加入盛有20g水的烧杯中,搅拌,测得0℃、T1℃、T2℃、T3℃时烧杯中溶液的质量分别如图中甲、乙、丙、丁点所示。下列说法错误的是( )
A、30℃时,M的溶解度小于N的溶解度 B、点P表示1C时M、N的溶解度相等 C、M、N都是难溶物质 D、阴影处各点对应的溶液(不包含曲线上的点)是M的不饱和溶液,N的饱和溶液9. 将30g固体物质X (不含结晶水)加入盛有20g水的烧杯中,搅拌,测得0℃、T1℃、T2℃、T3℃时烧杯中溶液的质量分别如图中甲、乙、丙、丁点所示。下列说法错误的是( ) A、0~T2℃时,物质X的溶解度随着温度的升高而增大 B、若要从丁点对应的溶液中得到全部固体X,应采取降温结晶的方法 C、T2℃时,丙溶液不一定是饱和溶液 D、T1℃时,物质X的溶解度为60g10. 关于结晶和晶体,说法正确的是( )A、晶体是指含有结晶水的化合物 B、降温结晶适合提纯溶解度随温度降低而减小显著的物质 C、粗盐提纯过程中,蒸发滤液至析出晶体时,滤液变不饱和 D、不管采取何种结晶方式,溶液必须达到饱和状态后才能结晶
A、0~T2℃时,物质X的溶解度随着温度的升高而增大 B、若要从丁点对应的溶液中得到全部固体X,应采取降温结晶的方法 C、T2℃时,丙溶液不一定是饱和溶液 D、T1℃时,物质X的溶解度为60g10. 关于结晶和晶体,说法正确的是( )A、晶体是指含有结晶水的化合物 B、降温结晶适合提纯溶解度随温度降低而减小显著的物质 C、粗盐提纯过程中,蒸发滤液至析出晶体时,滤液变不饱和 D、不管采取何种结晶方式,溶液必须达到饱和状态后才能结晶二、填空题
-
11. 下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答:
温度/℃
20
30
40
50
60
溶解度/g
NaCl
36.0
36.3
36.6
37.0
37.3
KNO3
31.6
45.8
63.9
85.6
110
(1)、30℃时,氯化钠的溶解度为。(2)、60℃时,100gKNO3饱和溶液恒温蒸发10g水,会有g硝酸钾晶体析出。(3)、由表中数据分析可知,硝酸钾和氯化钠在某一温度时具有相同的溶解度x,则x的取值范围是。(4)、下图是粗盐的提纯及溶液的配制实验,若要除去粗盐中难溶性的杂质,其正确操作步骤为(填序号)。若按照②③①的步骤配制50g16%的氯化钠溶液(②中游码移至“3”),所配制溶液的溶质质量分数(填“偏小”或“偏大”或“无影响”)。 12. 将甲物质不含结晶水加入水中,溶液质量与温度的关系如表。乙物质的溶解度曲线如图。
12. 将甲物质不含结晶水加入水中,溶液质量与温度的关系如表。乙物质的溶解度曲线如图。
温度
溶液质量
(1)、时甲物质的溶解度是 。(2)、时所对应的甲溶液 填“一定”或“不一定”是饱和溶液,时甲溶液的溶质质量分数 。(3)、时,关于等质量的甲、乙饱和溶液叙述正确的是 ____ 填序号。A、甲、乙溶液的溶质质量分数:甲乙 B、甲、乙溶液溶剂的质量:甲乙 C、乙溶液由饱和溶液变不饱和溶液可用加热的方法13. 硝酸钾在不同温度时的溶解度见下表,并按照图示进行实验:温度
溶解度
 (1)、A属于 填“饱和”或“不饱和”溶液。(2)、B中溶质与溶剂的质量比为 填最简整数比。(3)、时,硝酸钾的溶解度 。(4)、下列说法正确的是 填序号。
(1)、A属于 填“饱和”或“不饱和”溶液。(2)、B中溶质与溶剂的质量比为 填最简整数比。(3)、时,硝酸钾的溶解度 。(4)、下列说法正确的是 填序号。溶质质量分数是
提纯硝酸钾适合用降温结晶法
将中继续降温,溶质质量分数变大
(5)、的溶解度温度变化的趋势与相反,则室温时,向饱和石灰水加入少量生石灰,并恢复到室温,此时溶液中溶质的质量 填“”、“”或“”原溶液中溶质的质量。14. 下表是和在不同温度时的溶解度,据表回答问题。温度
溶解度
(1)、和的溶解度随温度升高而 填“增大”或“减小”。(2)、时,各取、固体分别加入水中,充分溶解后达到饱和状态的是 溶液。(3)、下列说法正确的是 ____ 填序号。A、从表中数据可以判断和的溶解度相等的温度在之间 B、的饱和溶液一定不能再溶解固体 C、时,溶液的溶质质量分数一定比溶液的溶质质量分数大 D、若要从的饱和溶液中获得晶体,可采用冷却热饱和溶液的方法15. 如图为甲、乙两种固体物质的溶解度曲线。 (1)、 t1℃时,甲的溶解度是g;(2)、 P点的意义:;(3)、 t3℃时,向50g水中加入35g甲,充分溶解后,溶液的质量为g,溶质质量分数为;(4)、t3℃时,等质量的甲、乙饱和溶液降温到t2℃,下列说法正确的是____(填序号)。A、t2℃时,甲溶液中溶质质量=乙溶液中溶质质量 B、t3℃时,甲溶液中溶质质量>乙溶液中溶质质量 C、t2℃时,甲溶液中溶剂质量=乙溶液中溶剂质量 D、t3℃时,甲溶液中溶剂质量<乙溶液中溶剂质量16. 如图①所示,室温下将120gNaOH固体加入100g水中搅拌后固体全部溶解,放置一段时间恢复至室温后,析出11g固体(忽略实验过程中水的损失)。
(1)、 t1℃时,甲的溶解度是g;(2)、 P点的意义:;(3)、 t3℃时,向50g水中加入35g甲,充分溶解后,溶液的质量为g,溶质质量分数为;(4)、t3℃时,等质量的甲、乙饱和溶液降温到t2℃,下列说法正确的是____(填序号)。A、t2℃时,甲溶液中溶质质量=乙溶液中溶质质量 B、t3℃时,甲溶液中溶质质量>乙溶液中溶质质量 C、t2℃时,甲溶液中溶剂质量=乙溶液中溶剂质量 D、t3℃时,甲溶液中溶剂质量<乙溶液中溶剂质量16. 如图①所示,室温下将120gNaOH固体加入100g水中搅拌后固体全部溶解,放置一段时间恢复至室温后,析出11g固体(忽略实验过程中水的损失)。 (1)、丙中溶液为(选填“饱和”或“不饱和”)溶液;(2)、室温时NaOH的溶解度是。(3)、上述实验说明NaOH的溶解度曲线与图②中的(选填“a”或“b”)相似。17. 在t℃时,分别取甲、乙两种固体的溶液,恒温蒸发水分,得到蒸发水的质量(X)与析出晶体质量(Y)的关系如图所示(析出的晶体不含结晶水)。
(1)、丙中溶液为(选填“饱和”或“不饱和”)溶液;(2)、室温时NaOH的溶解度是。(3)、上述实验说明NaOH的溶解度曲线与图②中的(选填“a”或“b”)相似。17. 在t℃时,分别取甲、乙两种固体的溶液,恒温蒸发水分,得到蒸发水的质量(X)与析出晶体质量(Y)的关系如图所示(析出的晶体不含结晶水)。 (1)、t℃时,在0点乙的溶液是(填“饱和”或“不饱和”)溶液。(2)、t℃时,甲、乙的溶解度大小关系为甲(填“<”“>”或 “=”)乙。(3)、用析出的甲配制一定溶质质量分数的溶液时,若所配制溶液溶质的质量分数偏大,则可能是量取水时(填“俯视”或“仰视”)量筒读数所致。
(1)、t℃时,在0点乙的溶液是(填“饱和”或“不饱和”)溶液。(2)、t℃时,甲、乙的溶解度大小关系为甲(填“<”“>”或 “=”)乙。(3)、用析出的甲配制一定溶质质量分数的溶液时,若所配制溶液溶质的质量分数偏大,则可能是量取水时(填“俯视”或“仰视”)量筒读数所致。三、综合题
-
18. 下表是KNO3、NaCl在不同温度下的溶解度(单位:g)
温度(℃)
0
10
20
40
50
60
70
80
90
100
KNO3
13.3
20.9
32
64
85.5
110
138
169
202
246
NaCl
35.7
35.8
36
36.6
37
37.3
37.8
38.4
39
39.8
(1)、60℃时,50g水中溶解32g硝酸钾形成不饱和溶液,欲使该溶液恰好达到饱和,可以恒温蒸发水的质量g(精确到1g);当其它条件不变时,也可以降温到℃恰好饱和。(2)、KNO3溶液中含有少量NaCl时,可通过方法提纯。析出的晶体和剩余溶液描述正确的是(填写编号)。A.剩余溶液一定是当时KNO3的饱和溶液
B.剩余溶液一定是当时NaCl的不饱和溶液
C.上述方法无法将两者完全分离
D.析出的晶体中一定不含有NaCl
(3)、t℃时,将一定量KNO3的不饱和溶液平均分为三份,分别恒温蒸发出水的质量为5g、10g、15g,析出KNO3晶体的质量依次为ag、bg、cg,则a、b、c三者的关系为____。A、c=a+b B、c=2b-a C、c=a+2b D、c=2a-b