河北省秦皇岛市青龙满族自治县2023-2024学年九年级上学期化学期末复习试题
试卷更新日期:2024-01-25 类型:期末考试
一、选择题(本题共20个小题,每小题2分,共 40分。下列各题,每小题只有一个选项符合题意。)
-
1. 下列变化中,属于物理变化的是( )A、粮食酿酒 B、纸张燃烧 C、酒精挥发 D、铁生锈2. 下列关于水的叙述,错误的是( )A、锅炉中使用硬水容易产生水垢,严重时会引起爆炸 B、硬水中含有较多可溶性钙、镁化合物 C、用直流电电解水,发现负极与正极上得到的气体体积比约为2:1 D、饮用水越纯越好,长期饮用有益健康3. 如图是实验室制取并收集二氧化碳的主要操作,其中不正确的是( )A、检查气密性
 B、加入石灰石
B、加入石灰石 C、产生二氧化碳
C、产生二氧化碳 D、收集二氧化碳
D、收集二氧化碳 4. 在Cu(NO3)2、Al(NO3)3和AgNO3混合溶液中加入一定量的锌粉,充分反应后过滤,向滤渣中滴加稀硫酸时有气泡产生。滤渣中没有( )A、Cu B、Al C、Ag D、Zn5. 共享单车是我国的“新四大发明”之一,下列关于共享单车的说法不正确的是( )A、外部喷漆既美观又防锈 B、共享单车各金属部件是用纯铁制成的 C、共享单车促进了绿色出行及低碳生活 D、加工单车各金属部件时,用到了金属的延展性6. 下列物质属于氧化物的是( )A、MgO B、O2 C、H2SO4 D、KMnO47. 有机玻璃是由甲基丙烯酸甲酯聚合而成的,结合如图甲基丙烯酸甲酯分子结构模型分析下列的说法不正确的是( )
4. 在Cu(NO3)2、Al(NO3)3和AgNO3混合溶液中加入一定量的锌粉,充分反应后过滤,向滤渣中滴加稀硫酸时有气泡产生。滤渣中没有( )A、Cu B、Al C、Ag D、Zn5. 共享单车是我国的“新四大发明”之一,下列关于共享单车的说法不正确的是( )A、外部喷漆既美观又防锈 B、共享单车各金属部件是用纯铁制成的 C、共享单车促进了绿色出行及低碳生活 D、加工单车各金属部件时,用到了金属的延展性6. 下列物质属于氧化物的是( )A、MgO B、O2 C、H2SO4 D、KMnO47. 有机玻璃是由甲基丙烯酸甲酯聚合而成的,结合如图甲基丙烯酸甲酯分子结构模型分析下列的说法不正确的是( ) A、甲基丙烯酸甲酯是由碳、氢、氧三种元素组成的 B、甲基丙烯酸甲酯分子中碳、氧原子个数3:2 C、甲基丙烯酸甲酯是氧化物 D、甲基丙烯酸甲酯中氢元素的质量分数最小8. “宏观辨识与微观探析”是化学学科核心素养之一、某化学反应的微观示意图如图所示。下列有关说法错误的是( )
A、甲基丙烯酸甲酯是由碳、氢、氧三种元素组成的 B、甲基丙烯酸甲酯分子中碳、氧原子个数3:2 C、甲基丙烯酸甲酯是氧化物 D、甲基丙烯酸甲酯中氢元素的质量分数最小8. “宏观辨识与微观探析”是化学学科核心素养之一、某化学反应的微观示意图如图所示。下列有关说法错误的是( )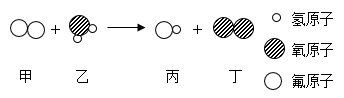 A、反应前后原子的种类和数目都不变 B、乙属于氧化物 C、在化学反应中,分子可以分为原子,而原子不可再分 D、该反应中生成物丙和丁的质量比为5:89. 下列叙述错误的是( )。A、用排气法收集二氧化碳时,应将燃着的木条放在集气瓶口验满 B、用一氧化碳还原氧化铁,应先通一会儿一氧化碳,再加热 C、加热高锰酸钾并用排水法收集氧气,只要导管口有气泡产生就立即收集 D、做铁丝在氧气中燃烧实验时,应预先在集气瓶中留少量水或铺少量的细沙10. 水与我们的生活息息相关,下列关于水的叙述正确的是( )A、硬水通过活性炭吸附后可变为软水 B、过滤可除去水中的色素、悬浮的杂质等 C、如果将无色透明的水样蒸干后有固体析出则这种水样中一定含有杂质 D、明矾净水是因溶于水生成的胶状物能吸附细菌、病毒等而起到杀菌作用11. 芒果中含有芒果苷(化学式为C19H18O11),芒果苷具有使中枢神经系统兴奋的作用,并具有抗糖尿病、抗病毒等活性。下列关于芒果苷的说法错误的是( )A、由三种元素组成 B、相对分子质量为422g C、质量分数最大的是碳元素 D、该分子中氢、氧原子个数比为18:1112. 下图一是电解水实验装置图,图二是过滤实验装置图,下列有关说法错误的是( )
A、反应前后原子的种类和数目都不变 B、乙属于氧化物 C、在化学反应中,分子可以分为原子,而原子不可再分 D、该反应中生成物丙和丁的质量比为5:89. 下列叙述错误的是( )。A、用排气法收集二氧化碳时,应将燃着的木条放在集气瓶口验满 B、用一氧化碳还原氧化铁,应先通一会儿一氧化碳,再加热 C、加热高锰酸钾并用排水法收集氧气,只要导管口有气泡产生就立即收集 D、做铁丝在氧气中燃烧实验时,应预先在集气瓶中留少量水或铺少量的细沙10. 水与我们的生活息息相关,下列关于水的叙述正确的是( )A、硬水通过活性炭吸附后可变为软水 B、过滤可除去水中的色素、悬浮的杂质等 C、如果将无色透明的水样蒸干后有固体析出则这种水样中一定含有杂质 D、明矾净水是因溶于水生成的胶状物能吸附细菌、病毒等而起到杀菌作用11. 芒果中含有芒果苷(化学式为C19H18O11),芒果苷具有使中枢神经系统兴奋的作用,并具有抗糖尿病、抗病毒等活性。下列关于芒果苷的说法错误的是( )A、由三种元素组成 B、相对分子质量为422g C、质量分数最大的是碳元素 D、该分子中氢、氧原子个数比为18:1112. 下图一是电解水实验装置图,图二是过滤实验装置图,下列有关说法错误的是( )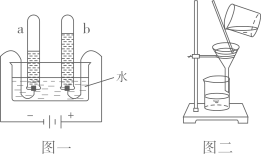 A、图一中a试管内收集的气体是氢气,可以燃烧 B、通过电解水的实验,说明水由氢气和氧气组成 C、图二过滤操作中,玻璃棒的作用是引流 D、图二中漏斗内的液面高于滤纸的边缘会导致滤液浑浊13. 甲、乙、丙丁四种物质在一定条件下混合反应,一段时间后,测得各物质的质量分数变化如图所示。则下列有关说法正确的是( )
A、图一中a试管内收集的气体是氢气,可以燃烧 B、通过电解水的实验,说明水由氢气和氧气组成 C、图二过滤操作中,玻璃棒的作用是引流 D、图二中漏斗内的液面高于滤纸的边缘会导致滤液浑浊13. 甲、乙、丙丁四种物质在一定条件下混合反应,一段时间后,测得各物质的质量分数变化如图所示。则下列有关说法正确的是( ) A、丁是单质 B、乙一定是该反应的催化剂 C、该反应属于分解反应 D、该反应生成甲和丙的质量比为19:4114. 在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。
A、丁是单质 B、乙一定是该反应的催化剂 C、该反应属于分解反应 D、该反应生成甲和丙的质量比为19:4114. 在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。物质
a
b
c
d
反应前的质量/g
40
40
10
32
反应后的质量/g
12
x
10
0
下列说法正确的是( )
A、x等于90 B、b可能是单质 C、c一定是催化剂 D、参加反应的a与d的质量比为7:815. 物质的性质决定物质的用途。下列物质的性质与其用途相匹配的是( )A、氧气具有助燃性,用作火箭发射的燃料 B、焊锡熔点低,用于焊接金属 C、石墨是黑色质软的固体,用于制作电池电极 D、二氧化碳能与水反应,用于灭火16. 将燃着的蜡烛放在图1所示的密闭容器中,同时用氧气传感器测出密闭容器中氧气含量的变化如图2所示。下列说法不正确的是( ) A、蜡烛燃烧前,密闭容器中氧气的体积分数为21% B、蜡烛燃烧需要氧气 C、蜡烛熄灭后,密闭容器中还有氧气 D、蜡烛熄灭后,密闭容器中二氧化碳的体积分数为84%17. 下列说法正确的是( )A、氧气能支持燃烧,所以可用作火箭的燃料 B、合金的熔点一般比组成它们的纯金属更高 C、用墨绘制的古画经久不变色,说明碳不与任何物质反应 D、净化水的方法有吸附、沉淀、过滤和蒸馏18. 如图是电解水的实验装置。下列说法中,正确的是( )
A、蜡烛燃烧前,密闭容器中氧气的体积分数为21% B、蜡烛燃烧需要氧气 C、蜡烛熄灭后,密闭容器中还有氧气 D、蜡烛熄灭后,密闭容器中二氧化碳的体积分数为84%17. 下列说法正确的是( )A、氧气能支持燃烧,所以可用作火箭的燃料 B、合金的熔点一般比组成它们的纯金属更高 C、用墨绘制的古画经久不变色,说明碳不与任何物质反应 D、净化水的方法有吸附、沉淀、过滤和蒸馏18. 如图是电解水的实验装置。下列说法中,正确的是( ) A、电解水的方程式为 B、实验说明水是由氢气和氧气组成的 C、试管2管内产生的气体能使带火星木条复燃 D、试管1、2中产生气体的质量比为2:119. 等质量的甲、乙两种金属,分别与足量等浓度的盐酸反应(已知甲、乙在生成物中化合价均为+2),生成氢气的质量和反应时间的关系如图所示,下列叙述正确的是( )
A、电解水的方程式为 B、实验说明水是由氢气和氧气组成的 C、试管2管内产生的气体能使带火星木条复燃 D、试管1、2中产生气体的质量比为2:119. 等质量的甲、乙两种金属,分别与足量等浓度的盐酸反应(已知甲、乙在生成物中化合价均为+2),生成氢气的质量和反应时间的关系如图所示,下列叙述正确的是( ) A、甲、乙两种金属中较活泼的是乙 B、产生氢气的速率:甲<乙 C、生成氢气的质量:甲<乙 D、相对原子质量较大的是乙20. 某碳酸钙和氧化钙组成的混合物中钙元素的质量分数为60%,将50g该混合物高煅烧至固体质量不再改变,则生成二氧化碳的质量是( )A、6g B、8 C、13.2g D、2g
A、甲、乙两种金属中较活泼的是乙 B、产生氢气的速率:甲<乙 C、生成氢气的质量:甲<乙 D、相对原子质量较大的是乙20. 某碳酸钙和氧化钙组成的混合物中钙元素的质量分数为60%,将50g该混合物高煅烧至固体质量不再改变,则生成二氧化碳的质量是( )A、6g B、8 C、13.2g D、2g二、填空题(共6题,总计 35分)
-
21. 在分子、原子、质子、中子、电子中,找出符合下列条件的粒子名称,填在相应的横线上.(1)、能直接构成纯净物的粒子是 .
(2)、能保持物质化学性质的粒子是 .
(3)、化学变化中的最小粒子是 .
(4)、带正电荷的粒子是 .
(5)、带负电荷的粒子是 .
(6)、不显电性的粒子是 .
(7)、决定原子质量大小的粒子是 .
(8)、在同一原子中数目相等的粒子是 .22. 为预防新型冠状病毒肺炎,可以用“84”消毒液对房间的家具、地板等进行消毒,其有效成分次氯酸钠(化学式为NaClO)中,氯元素的化合价为;生活中洗涤剂能除去油污,是因为它具有功能。23. 碱式碳酸铜[化学式:Cu2(OH)2CO3]受热分解生成氧化铜、水和二氧化碳,反应的化学方程式为;充分加热36g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3:4,则该反应生成水和二氧化碳的质量之和为g。24. 三大化石燃料包括煤、、天然气,用天然气做饭后关闭燃气阀门,使火焰熄灭的原理是 , 乙醇完全燃烧的化学方程式为。25. 如图是元素周期表的一部分 (1)、17号元素的原子结构示意图为;(2)、写6、8、20号元素形成的化合物化学式(并标出6号元素化合价);(3)、写出将上面化合物加到1号与17号元素形成化合物的溶液中发生反应的化学方程式;(4)、上图椭圆圈出的7种属于元素,它们在物理性质上的通性有(写出4点);椭圆所圈的后5种元素活动性由弱到强的顺序是。26. A~E是初中化学常见的物质,它们之间的转化关系如图(部分物质已略去)。已知A、B组成元素相同且常温下均为液体;D是相对分子质量为16的含碳化合物。则A转化为B的化学方程式为;C转化为B的化学方程式为;C的一种用途是。
(1)、17号元素的原子结构示意图为;(2)、写6、8、20号元素形成的化合物化学式(并标出6号元素化合价);(3)、写出将上面化合物加到1号与17号元素形成化合物的溶液中发生反应的化学方程式;(4)、上图椭圆圈出的7种属于元素,它们在物理性质上的通性有(写出4点);椭圆所圈的后5种元素活动性由弱到强的顺序是。26. A~E是初中化学常见的物质,它们之间的转化关系如图(部分物质已略去)。已知A、B组成元素相同且常温下均为液体;D是相对分子质量为16的含碳化合物。则A转化为B的化学方程式为;C转化为B的化学方程式为;C的一种用途是。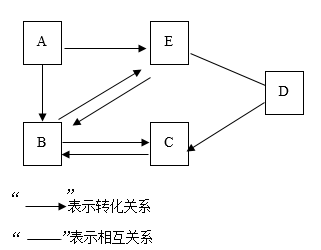
三、实验探究题(共3题,总计20分)
-
27. 化学是一门以实验为基础的科学,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:
 (1)、写出指定仪器的名称:①。(2)、实验室制取二氧化碳可选用的发生装置是(填字母代号)。反应的化学方程式为。(3)、若用如图装置收集CO2 , 通过实验证明CO2已经收集满的操作方法及现象是。
(1)、写出指定仪器的名称:①。(2)、实验室制取二氧化碳可选用的发生装置是(填字母代号)。反应的化学方程式为。(3)、若用如图装置收集CO2 , 通过实验证明CO2已经收集满的操作方法及现象是。 (4)、常温下,氨气是一种有刺激性气味的气体,实验室可用加热固体氯化铵与熟石灰的混合物来制取氨气,则应选择上图中(填字母代号)来作氨气制取的发生装置。28. 同学们设计实验探究二氧化碳的性质,请你参与探究并回答下列问题:
(4)、常温下,氨气是一种有刺激性气味的气体,实验室可用加热固体氯化铵与熟石灰的混合物来制取氨气,则应选择上图中(填字母代号)来作氨气制取的发生装置。28. 同学们设计实验探究二氧化碳的性质,请你参与探究并回答下列问题: (1)、实验1:两个大量筒中,一个充满CO2 , 一个充满空气。充满CO2的量筒是。(选填“A”或“B”),说明二氧化碳具有的性质是。(2)、实验2:向一个收集满二氧化碳气体的质地较软的塑料瓶中加入约三分之一体积的水,立即旋紧瓶盖振荡,可观察到的实验现象是 , 发生该变化的原因是。(3)、实验3:其设计的目的是。一段时间后,观察到Y型管右侧湿润的紫色石蕊试纸变红,写出发生反应的化学方程式。29. 某化学兴趣小组对燃烧的条件进行了以下探究。
(1)、实验1:两个大量筒中,一个充满CO2 , 一个充满空气。充满CO2的量筒是。(选填“A”或“B”),说明二氧化碳具有的性质是。(2)、实验2:向一个收集满二氧化碳气体的质地较软的塑料瓶中加入约三分之一体积的水,立即旋紧瓶盖振荡,可观察到的实验现象是 , 发生该变化的原因是。(3)、实验3:其设计的目的是。一段时间后,观察到Y型管右侧湿润的紫色石蕊试纸变红,写出发生反应的化学方程式。29. 某化学兴趣小组对燃烧的条件进行了以下探究。
【查阅资料】红磷着火点为240℃,白磷着火点为40℃,红磷和白磷燃烧的产物相同。
(1)、【探究一】如图甲所示,A、C为白磷,B为红磷,用酒精灯对准A加热一段时间,C先燃烧,B后燃烧,A不燃烧。
写出红磷燃烧的化学方程式。(2)、对比B、C的现象可知,其他条件相同时,着火点(选填“高”或“低”)的物质先燃烧。(3)、【探究二】如图乙所示,同学们利用Y型管的装置对燃烧条件进行了验证。【实验步骤】向Y型管中挤入过氧化氢溶液后,观察到导管口有气泡产生,烧杯中的白磷先不燃烧,一段时间后燃烧。
【分析与讨论】此现象说明可燃物燃烧的条件之一是。
(4)、烧杯中80℃热水的作用有。(5)、若装置不变,欲证明可燃物燃烧的另一个条件,只需将Y型管中的某一药品更换,你的思路为。(6)、对比图甲可知,图乙装置的优点是(写一条即可)。四、计算题(共5分)
-
30. 黄铜(铜、锌合金)是重要的金属材料,有优良的导热性和耐腐蚀性,可用作各种仪器零件。为了测定黄铜样品中铜的质量分数,某研究小组进行了如图实验,请计算:
 (1)、生成氢气的质量为g。(2)、黄铜样品中铜的质量分数。
(1)、生成氢气的质量为g。(2)、黄铜样品中铜的质量分数。