2023-2024学年沪教版初中化学九年级下册 6.3 物质的溶解性 同步分层训练基础题(第2课时)
试卷更新日期:2024-01-25 类型:同步测试
一、选择题
-
1. 20℃时,氯化钠的溶解度为36g。对这句话理解错误的是( )A、20℃时,100g水中最多能溶解氯化钠36g B、20℃时,氯化钠饱和溶液中水与氯化钠的质量比为25:9 C、20℃时,100g氯化钠饱和溶液中含氯化钠36g D、20℃时,将36g氯化钠溶解于100g水中,此溶液为该温度下氯化钠的饱和溶液2. 下列对实验现象的描述正确的是( )A、冷却热的硝酸钾饱和溶液,有晶体从溶液中析出 B、黄铜片与铜片互相刻画,黄铜片上有明显的划痕 C、铁丝在空气中剧烈燃烧,火星四射,生成黑色固体 D、将锌粒放入稀硫酸中,生成的气体有刺激性气味3. 煮沸的水不宜养鱼,是因为煮沸的水中几乎不含有( )A、氧元素 B、氧原子 C、氧分子 D、氢元素4. 下列措施能改变物质溶解度的是( )。A、搅拌 B、增加溶剂 C、加热 D、把溶质研细5. 如图所示,给饱和澄清石灰水加热。下列叙述错误的是( )。
 A、溶液由澄清变浑浊 B、氢氧化钙的溶解度随温度的升高而增大 C、溶液仍为饱和溶液 D、溶液中溶质的质量分数减小6. 生活中的下列现象,不能说明气体溶解度随温度升高而减小的是( ) 。A、烧开水时,沸腾前有气泡逸出 B、阳光充足时,盛满水的鱼缸壁上有小气泡 C、起开啤酒瓶盖,有大量泡沫溢出 D、夏季黄昏时,池塘里的鱼浮出水面7. 据《说文解字》记载,我们的祖先在神农氏时代就开始利用海水晒盐。海水晒盐的原理是( )A、利用日晒,使海水分解 B、利用日晒,使氯化钠的溶解能力变小 C、利用阳光和风力,使海水中的水分蒸发 D、利用阳光和风力,使海水中的氯化钠蒸发8. 如图为两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )
A、溶液由澄清变浑浊 B、氢氧化钙的溶解度随温度的升高而增大 C、溶液仍为饱和溶液 D、溶液中溶质的质量分数减小6. 生活中的下列现象,不能说明气体溶解度随温度升高而减小的是( ) 。A、烧开水时,沸腾前有气泡逸出 B、阳光充足时,盛满水的鱼缸壁上有小气泡 C、起开啤酒瓶盖,有大量泡沫溢出 D、夏季黄昏时,池塘里的鱼浮出水面7. 据《说文解字》记载,我们的祖先在神农氏时代就开始利用海水晒盐。海水晒盐的原理是( )A、利用日晒,使海水分解 B、利用日晒,使氯化钠的溶解能力变小 C、利用阳光和风力,使海水中的水分蒸发 D、利用阳光和风力,使海水中的氯化钠蒸发8. 如图为两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )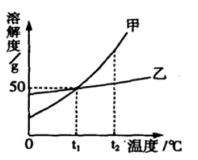 A、乙的饱和溶液由t2℃降温至t1℃,变为不饱和溶液 B、t2℃等质量的甲、乙两种物质的饱和溶液中,溶质的质量一定是甲大于乙 C、t1℃甲、乙两种物质的饱和溶液中溶质的质量分数都是50% D、甲溶液中含有少量乙,可用蒸发溶剂的方法提纯甲9. 气体的溶解度是指在一定温度和压强下,某气体在1体积水里达到饱和状态时所溶解的体积。101kPa时,甲、乙两种气体在不同温度下的溶解度数值如下表所示:
A、乙的饱和溶液由t2℃降温至t1℃,变为不饱和溶液 B、t2℃等质量的甲、乙两种物质的饱和溶液中,溶质的质量一定是甲大于乙 C、t1℃甲、乙两种物质的饱和溶液中溶质的质量分数都是50% D、甲溶液中含有少量乙,可用蒸发溶剂的方法提纯甲9. 气体的溶解度是指在一定温度和压强下,某气体在1体积水里达到饱和状态时所溶解的体积。101kPa时,甲、乙两种气体在不同温度下的溶解度数值如下表所示:101kPa、40℃,气体甲
0.023
101kPa、20℃,气体乙
0.023
则在101kPa、30℃时,甲、乙两种气体溶解度大小关系正确的是( )
A、S(甲)<S(乙) B、S(甲)=S(乙) C、S(甲)>S(乙) D、无法比较10. 甲、乙两种物质的溶解度曲线如图所示。下列说法中正确的是( )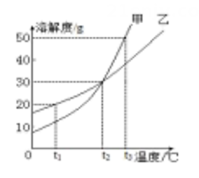 A、t1℃时,甲溶解度大于乙的溶解度 B、t2℃时,甲、乙饱和溶液的溶质质量分数都为30% C、t2℃时,甲、乙的饱和溶液分别降至t1℃,甲溶液饱和,乙溶液不饱和 D、t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙11. 如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述正确的是( )
A、t1℃时,甲溶解度大于乙的溶解度 B、t2℃时,甲、乙饱和溶液的溶质质量分数都为30% C、t2℃时,甲、乙的饱和溶液分别降至t1℃,甲溶液饱和,乙溶液不饱和 D、t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙11. 如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述正确的是( )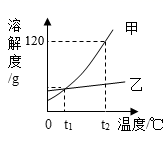 A、tl℃时,甲、乙的两种溶液溶质的质量分数相等 B、t2℃时,甲的饱和溶液中溶质的质量大于乙的饱和溶液中溶质的质量 C、甲中含有少量乙,可以用冷却热饱和溶液的方法提纯甲 D、t2℃时,向 70g 甲固体中加入 50g 水,充分搅拌后能得到120g 溶液12. 如图是a、b、c三种不同物质(不含结晶水)的溶解度曲线图。下列有关叙述正确的是( )
A、tl℃时,甲、乙的两种溶液溶质的质量分数相等 B、t2℃时,甲的饱和溶液中溶质的质量大于乙的饱和溶液中溶质的质量 C、甲中含有少量乙,可以用冷却热饱和溶液的方法提纯甲 D、t2℃时,向 70g 甲固体中加入 50g 水,充分搅拌后能得到120g 溶液12. 如图是a、b、c三种不同物质(不含结晶水)的溶解度曲线图。下列有关叙述正确的是( )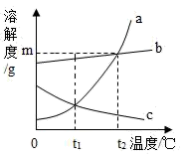 A、t1℃时,分别取出相同质量的a、c两种物质的饱和溶液升温到t2℃时,溶质的质量分数a>c B、t2℃时,将a、b两种饱和溶液分别降温到t1℃时,析出晶体的质量a>b C、t2℃时,a、b的溶解度为m D、从b物质的饱和溶液提取b晶体时,最好采取冷却b物质的热饱和溶液的办法13. 50℃时,氯化铵的溶解度是50g,50℃时氯化铵的饱和溶液中溶质、溶剂、溶液之间的质量比为( )A、1:2:3 B、2:3:1 C、3:2:1 D、1:3:214. 下面是同学们在实验室探究有关溶液知识的实验。对实验的相关分析正确的是( )
A、t1℃时,分别取出相同质量的a、c两种物质的饱和溶液升温到t2℃时,溶质的质量分数a>c B、t2℃时,将a、b两种饱和溶液分别降温到t1℃时,析出晶体的质量a>b C、t2℃时,a、b的溶解度为m D、从b物质的饱和溶液提取b晶体时,最好采取冷却b物质的热饱和溶液的办法13. 50℃时,氯化铵的溶解度是50g,50℃时氯化铵的饱和溶液中溶质、溶剂、溶液之间的质量比为( )A、1:2:3 B、2:3:1 C、3:2:1 D、1:3:214. 下面是同学们在实验室探究有关溶液知识的实验。对实验的相关分析正确的是( ) A、②中有氯化钠晶体析出 B、②中的硝酸钾不能被溶解 C、实验过程中的溶液均为无色 D、③中的硝酸钾溶液加热片刻后变为不饱和溶液15. 生活在盐碱湖附近的人们习惯“夏天晒盐,冬天捞碱”,结合下表数据,下列说法正确的是
A、②中有氯化钠晶体析出 B、②中的硝酸钾不能被溶解 C、实验过程中的溶液均为无色 D、③中的硝酸钾溶液加热片刻后变为不饱和溶液15. 生活在盐碱湖附近的人们习惯“夏天晒盐,冬天捞碱”,结合下表数据,下列说法正确的是温度
溶解度
物质
0℃
10℃
20℃
30℃
40℃
50℃
60℃
70℃
氯化钠
35.7g
35.8g
36.0g
36.3g
36.6g
37.0g
37.3g
37.8g
碳酸钠
7.0g
12.2g
21.8g
39.7g
49.0g
48.7g
46.5g
45.8g
A、碳酸钠的溶解度比氯化钠大 B、“夏天晒盐,冬天捞碱”分别利用了蒸发结晶和降温结晶的原理 C、20℃时,将20g氯化钠加入50g水中,形成的溶液质量为70g D、碳酸钠的溶解度随温度升高而增大16. 在时,某固体物质不含结晶水的水溶液,经历如图变化,下列说法正确( )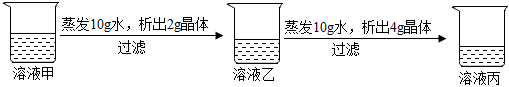 A、溶液甲一定是饱和溶液 B、时,该固体的溶解度是 C、时,溶液丙若再蒸发水不考虑蒸干 , 析出晶体总质量为 D、溶液质量分数:乙丙17. 时,在装有氯化钠饱和溶液的甲烧杯中加入水,后变为乙烧杯,有关描述正确的是 ( )
A、溶液甲一定是饱和溶液 B、时,该固体的溶解度是 C、时,溶液丙若再蒸发水不考虑蒸干 , 析出晶体总质量为 D、溶液质量分数:乙丙17. 时,在装有氯化钠饱和溶液的甲烧杯中加入水,后变为乙烧杯,有关描述正确的是 ( )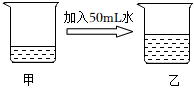
已知时,氯化钠饱和溶液的密度是
A、甲、乙溶液中存在的微粒只有和 B、甲、乙溶液中氯化钠的溶解度:甲乙 C、甲、乙溶液中溶质的质量相等 D、甲、乙溶液中溶质的质量分数:18. t2℃时,向盛有 10g 水的烧杯中加入 13g 固体甲,搅拌后固体完全溶解,放置一段时间后,溶液中固体析出,甲的溶解度曲线如图所示。若不考虑水分蒸发,下列说法正确的是( )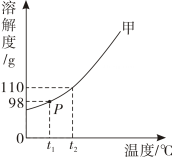 A、甲溶于水的过程放热 B、搅拌可以増大甲物质的溶解度 C、甲的溶解度为 98g D、通过升温可以将甲的不饱和溶液变为饱和溶液19. 已知在、时的溶解度分别为、 , 某同学按如图所示步骤进行实验。下列说法正确的是( )
A、甲溶于水的过程放热 B、搅拌可以増大甲物质的溶解度 C、甲的溶解度为 98g D、通过升温可以将甲的不饱和溶液变为饱和溶液19. 已知在、时的溶解度分别为、 , 某同学按如图所示步骤进行实验。下列说法正确的是( ) A、Ⅰ中的质量分数为 B、Ⅱ中溶液是时的不饱和溶液 C、Ⅱ中的质量分数是Ⅰ中的2倍 D、Ⅲ中有晶体析出20. 20 ℃时,将10 g氯化钠完全溶解于40 g水中配制成溶液。以下说法正确的是( )A、所得溶液中溶质质量分数为20% B、若再加入5 g氯化钠,部分溶解,则原溶液为饱和溶液 C、溶液中存在的微观粒子只有Na+、Cl- D、该温度下,氯化钠的溶解度为25 g
A、Ⅰ中的质量分数为 B、Ⅱ中溶液是时的不饱和溶液 C、Ⅱ中的质量分数是Ⅰ中的2倍 D、Ⅲ中有晶体析出20. 20 ℃时,将10 g氯化钠完全溶解于40 g水中配制成溶液。以下说法正确的是( )A、所得溶液中溶质质量分数为20% B、若再加入5 g氯化钠,部分溶解,则原溶液为饱和溶液 C、溶液中存在的微观粒子只有Na+、Cl- D、该温度下,氯化钠的溶解度为25 g二、填空题
-
21. 通常把从溶液中析出晶体的过程叫 . 对于溶解度随温度变化不大的物质,可用的方法使溶液中的溶质结晶出来;对于溶解度随温度变化较大的物质,可用的方法使溶质从溶液中析出.22. 自来水厂净水过程主要有沉淀、过滤、、加氯消毒等。进入居民家中的自来水含有余氯会影响鱼类健康,若要除去水中溶解的氯气,可将自来水放置在阳光下晾晒一段时间再养鱼。这是因为气体在水中的溶解度与有关。23. A.B.C三种固体物质在水中的溶解度曲线如图所示,请回答:
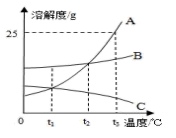 (1)、℃时,A、B两种物质在100g水中达到饱和状态时溶解的质量相等;(2)、若B中混有少量的A,最好采用的方法提纯B;(3)、现有接近饱和的C物质溶液,使其变成饱和溶液的方法有:
(1)、℃时,A、B两种物质在100g水中达到饱和状态时溶解的质量相等;(2)、若B中混有少量的A,最好采用的方法提纯B;(3)、现有接近饱和的C物质溶液,使其变成饱和溶液的方法有:①加入C物质;②;③;
(4)、t3℃时将20gA物质放入50g水中,充分搅拌,所得溶液的质量是;(5)、将t3℃时等质量的A、B、C三种物质的饱和溶液降温至t1℃时,所得溶液的质量由大到小的顺序是24. 溶液在生产、生活和实验中起着十分重要的作用。请回答下列问题:(1)、某同学配制100g溶质质量分数为5%的氯化钠溶液,请回答下列问题:①若用氯化钠固体和水配制,实验步骤为计算、 、量取、溶解。
②若用溶质质量分数为20%的氯化钠溶液和水配置,则需20%的氯化钠溶液质量为g。
(2)、向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示。
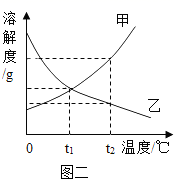
①图一烧杯中的溶液一定属于饱和溶液的是(填序号);要使NaNO3不饱和溶液变为饱和可以采取的方法是。
②图二能表示NaNO3溶解度曲线的是(填“甲”或“乙”);甲、乙两物质溶解度曲线的交点的含义是。
25. 如图是A,B两种固体的溶解度曲线,请回答下列问题: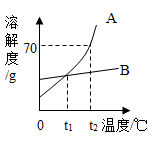 (1)、t2℃时,将80g固体A加到100g水中,充分溶解后所得溶液的质量是g。(2)、将t2℃时A、B的饱和溶液分别降温到t1℃,析出晶体A的质量与析出晶体B的质量的大小关系是(填“大于”“小于”“等于”或“无法确定”)。(3)、t2℃时,A的饱和溶液中含有少量B,提纯A常采用结晶的方法。
(1)、t2℃时,将80g固体A加到100g水中,充分溶解后所得溶液的质量是g。(2)、将t2℃时A、B的饱和溶液分别降温到t1℃,析出晶体A的质量与析出晶体B的质量的大小关系是(填“大于”“小于”“等于”或“无法确定”)。(3)、t2℃时,A的饱和溶液中含有少量B,提纯A常采用结晶的方法。