江苏省南京市2023-2024学年高二上学期期中学情调研化学试卷
试卷更新日期:2024-01-23 类型:期中考试
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
-
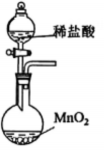
1. 2023年10月,清华大学突破芯片数据恢复技术难题,在世界上首次实现了对存储芯片的“诊疗一体化”。制作计算机芯片的含硅材料是指( )A、 B、 C、 D、2. 反应可用于野外制。下列说法正确的是( )A、中子数为2的氢原子可表示为 B、中为-1价 C、水的电子式为 D、为氧化产物3. 实验室在低温条件下将通入溶液制取溶液。下列实验装置和操作不能达到实验目的的是( )
甲
 乙
乙 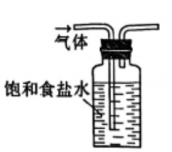 丙
丙 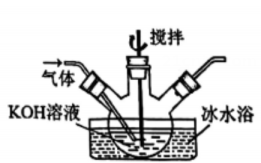 丁
丁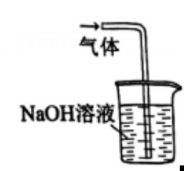 A、用装置甲制取 B、用装置乙除去中混有的 C、用装置丙制取溶液 D、用装置丁吸收尾气中的4. 、、、、为短周期主族元素。下列说法正确的是( )A、离子半径: B、热稳定性: C、酸性强弱: D、碱性强弱:5. 阅读下列材料,完成5-7题:氮是自然界各种生物体生命活动不可缺少的重要元素。人类通过控制条件将转化为含氮化合物。合成氨产生的可通过催化氧化等过程转化为 , 还可以与溶液反应制备肼。常温常压下,是无色液体,常用作火箭的燃料,其原理为与反应产生无色无污染的气体。(1)、下列说法不正确的是( )A、是共价化合物 B、转化为含氮化合物属于氮的固定 C、中既含离子键又含共价键 D、中原子之间以氮氮三键结合(2)、下列化学反应表示不正确的是( )A、与水反应: B、与反应: C、硝酸见光分解: D、与溶液反应制:6. 下列物质性质与用途具有对应关系的是( )A、无色无味,可用作焊接保护气 B、极易溶于水,液氨可用作制冷剂 C、易液化,可用于工业制硝酸 D、具有还原性,可用作火箭的燃料7. 在给定条件下,下列选项所示的物质间转化均能一步实现的是( )A、 B、 C、 D、8. 在熔融盐体系中,B电极为石墨,A电极上利用和获得电池材料硅钛合金(),装置如题图所示。下列说法正确的是( )
A、用装置甲制取 B、用装置乙除去中混有的 C、用装置丙制取溶液 D、用装置丁吸收尾气中的4. 、、、、为短周期主族元素。下列说法正确的是( )A、离子半径: B、热稳定性: C、酸性强弱: D、碱性强弱:5. 阅读下列材料,完成5-7题:氮是自然界各种生物体生命活动不可缺少的重要元素。人类通过控制条件将转化为含氮化合物。合成氨产生的可通过催化氧化等过程转化为 , 还可以与溶液反应制备肼。常温常压下,是无色液体,常用作火箭的燃料,其原理为与反应产生无色无污染的气体。(1)、下列说法不正确的是( )A、是共价化合物 B、转化为含氮化合物属于氮的固定 C、中既含离子键又含共价键 D、中原子之间以氮氮三键结合(2)、下列化学反应表示不正确的是( )A、与水反应: B、与反应: C、硝酸见光分解: D、与溶液反应制:6. 下列物质性质与用途具有对应关系的是( )A、无色无味,可用作焊接保护气 B、极易溶于水,液氨可用作制冷剂 C、易液化,可用于工业制硝酸 D、具有还原性,可用作火箭的燃料7. 在给定条件下,下列选项所示的物质间转化均能一步实现的是( )A、 B、 C、 D、8. 在熔融盐体系中,B电极为石墨,A电极上利用和获得电池材料硅钛合金(),装置如题图所示。下列说法正确的是( )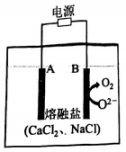 A、电极B和电源负极相连,发生氧化反应 B、电极A的电极反应式: C、电解时,向B电极迁移 D、理论上每转移电子,B电极上产生9. 汽车尾气在稀土催化剂作用下通过反应实现转化。下列说法正确的是( )A、该反应 B、反应的平衡常数可表示为 C、其他条件相同,越大,的平衡转化率越大 D、其他条件相同,使用催化剂,正反应速率增大,逆反应速率减小10. 室温下,下列实验方案不能达到探究目的的是( )
A、电极B和电源负极相连,发生氧化反应 B、电极A的电极反应式: C、电解时,向B电极迁移 D、理论上每转移电子,B电极上产生9. 汽车尾气在稀土催化剂作用下通过反应实现转化。下列说法正确的是( )A、该反应 B、反应的平衡常数可表示为 C、其他条件相同,越大,的平衡转化率越大 D、其他条件相同,使用催化剂,正反应速率增大,逆反应速率减小10. 室温下,下列实验方案不能达到探究目的的是( )选项
实验方案
探究目的
A
向盛有2mL 溶液的试管中滴加溶液,观察气泡产生的情况
探究的与的的大小
B
向盛有2mL 溶液的试管中滴加足量氯水,充分反应后滴加KSCN溶液,观察溶液颜色变化
比较与的还原性
C
用注射器收集一定体积气体,连接色度传感器,通过抽拉活塞改变气体体积,记录体系中气体颜色变化
探究压强对化学平衡的影响
D
在一支试管中加入2mL 盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化
探究Mg与盐酸反应的热效应
A、A B、B C、C D、D11. 是一种二元弱酸。常温下,通过下列实验探究溶液的性质。实验1:测得溶液的约为。
实验2:向酸性溶液中滴加过量溶液,溶液紫红色褪去。
实验3:向溶液中加入等体积等浓度溶液,溶液变浑浊。
实验4:向溶液中滴加少量等浓度溶液,无明显现象。
若忽略溶液混合时的体积变化,下列说法正确的是( )
A、依据实验1推测: B、依据实验2推测:溶液具有漂白性 C、依据实验3推测: D、依据实验4推测:反应后溶液中存在12. 催化重整制的主要反应为:Ⅰ:
Ⅱ:
将一定比例的、和的混合气体。以一定流速通过装有催化剂的反应管,若仅考虑上述反应,转化率、氢酸比[]与温度的关系如题图所示。下列说法正确的是( )
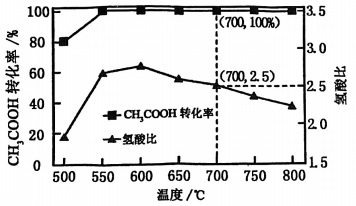 A、用该催化剂催化重整反应的最佳温度范围约为700~800℃ B、700℃时,出口气中 C、600℃后氢酸比下降的主要原因为温度升高反应Ⅰ、Ⅱ正向进行的程度减小 D、该过程深入研究的方向之一是寻找对反应Ⅱ选择性更高的催化剂
A、用该催化剂催化重整反应的最佳温度范围约为700~800℃ B、700℃时,出口气中 C、600℃后氢酸比下降的主要原因为温度升高反应Ⅰ、Ⅱ正向进行的程度减小 D、该过程深入研究的方向之一是寻找对反应Ⅱ选择性更高的催化剂二、非选择题:共4题,共61分。
-
13. 以废镁镍催化剂(主要成分为、、、)为原料制备和碱式碳酸镁[],其工艺流程如图所示:
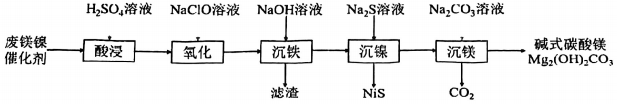
已知:25℃时,溶液中相关金属离子生成氢氧化物沉淀的pH见下表。
开始沉淀
完全沉淀
(1)、“酸浸”时,不宜使用溶液作为浸取液,其原因是;保持温度、各物质投料量及浓度不变,能提高镍元素和镁元素浸出率的措施有(填字母)。A.将废催化剂粉碎 B.适当提高搅拌速率 C.适当缩短酸浸时间
(2)、“氧化”时,NaClO发生反应的离子方程式为;该步骤中,检验氧化完全的操作为。(3)、“沉铁”时,需加入NaOH溶液调节pH的范围为。(4)、“沉镁”时发生反应的离子方程式为。14. 过氧化氢()是一种环境友好的氧化剂。(1)、的电化学合成。两电极反应产生的离子在多孔介质中生成的原理如图所示,正极的电极反应式为。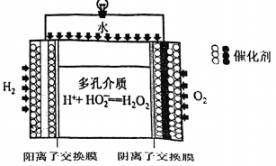 (2)、含量的测定。取溶液样品配制成250mL溶液,取mL待测液于碘量瓶中,加入适量溶液和过量KI溶液,发生反应 , 密封在暗处静置;用溶液滴定至溶液呈微黄色,加入适量淀粉溶液,继续滴定至终点。滴定时发生反应。重复实验两次,平均消耗溶液的体积为。
(2)、含量的测定。取溶液样品配制成250mL溶液,取mL待测液于碘量瓶中,加入适量溶液和过量KI溶液,发生反应 , 密封在暗处静置;用溶液滴定至溶液呈微黄色,加入适量淀粉溶液,继续滴定至终点。滴定时发生反应。重复实验两次,平均消耗溶液的体积为。①判断达到滴定终点的标志为。
②通过上述数据,计算样品中的质量分数。(写出计算过程)
(3)、分解的探究。①已知分解放出的热,在含少量的溶液中,的分解机理为:
Ⅰ.(慢),Ⅱ.(快)。
下列说法正确的是____(填字母)。
A、反应的速率与的浓度有关 B、是该反应的催化剂 C、反应Ⅰ的活化能小于反应Ⅱ的活化能 D、的总能量比的高(4)、为比较和对分解的催化效果,研究小组设计了如图所示的实验。该实验能否达到实验目的,若不能,请提出改进意见。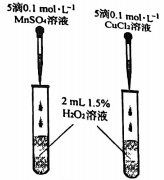 15. 实验室制备的装置如图所示。
15. 实验室制备的装置如图所示。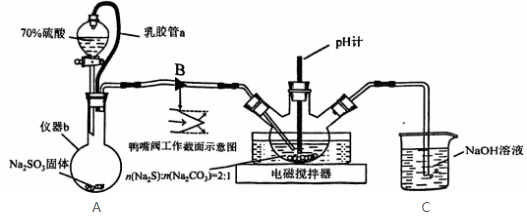 (1)、装置A中乳胶管a的作用为;仪器b的名称为。(2)、装置B为鸭嘴阀,尖嘴处为弹性可开合橡胶,结构如图所示,其作用为。(3)、装置C中的反应分三步:第一步、第二步(用化学方程式表示)、第三步。(4)、装置C中约为7时停止通入气体,过高或过低均使的产量下降,其原因为。(5)、用饱和溶液制备(水溶液中、、的物质的量分数随的分布如图1所示,的溶解度曲线如图2所示)。
(1)、装置A中乳胶管a的作用为;仪器b的名称为。(2)、装置B为鸭嘴阀,尖嘴处为弹性可开合橡胶,结构如图所示,其作用为。(3)、装置C中的反应分三步:第一步、第二步(用化学方程式表示)、第三步。(4)、装置C中约为7时停止通入气体,过高或过低均使的产量下降,其原因为。(5)、用饱和溶液制备(水溶液中、、的物质的量分数随的分布如图1所示,的溶解度曲线如图2所示)。图1
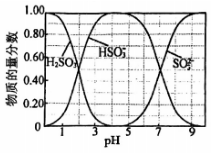 图2
图2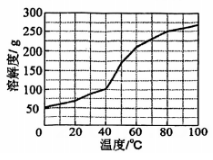
请补充完整实验方案:边搅拌边向饱和溶液中加入 , 停止滴加后在加热条件下,边搅拌边向其中加入硫粉至不再溶解,过滤, , 用无水乙醇洗涤晶体2~3次,低温干燥。(须使用试剂:NaOH溶液)
16. 利用可以制备合成气(和CO)。(1)、与重整。①已知:燃烧热;燃烧热;燃烧热。
则反应Ⅰ:。
②在基催化剂作用下,该反应的可能机理如图所示。已知转化的表达式为 , 写出转化为的表达式:。
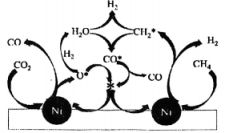
③与重整反应制备合成气中的主要副反应为:
Ⅱ.
Ⅲ.
Ⅳ.
在、进气流速相同、时,做催化剂,反应相同时间测得与的转化率随温度变化如图所示(仅考虑上述反应)。
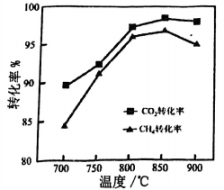
不同温度下转化率始终大于转化率的主要原因为。 , 随温度升高与转化率均下降的可能原因为。
(2)、部分氧化重整。反应原理为;。与该方法相比,和重整的优点是。
(3)、与、、三重整。在密闭容器中,、时,与的平衡转化率、与的平衡产率随温度变化如图所示。

在时,平衡转化率为负值的可能原因为(用化学方程式表示)、。