山西省实验顶级名校2023-2024学年高一上学期期中考试化学试卷
试卷更新日期:2024-01-19 类型:期中考试
一、单选题2分×20=40分,每小题只有一个选项符合题意)
-
1. 辛勤劳动才能创造美好生活。如图所示劳动场景中,不涉及氧化还原反应的是( )
A
B
C
D




海水晒盐
冶炼钢铁
古法酿酒
用过氧乙酸消毒
A、A B、B C、C D、D2. 下列分类正确的是( )选项
单质
酸
碱
盐
胶体
A
水银
硝酸
纯碱
氯化钠
蛋白质溶液
B
银
磷酸
烧碱
火碱
烟
C
红磷
醋酸
熟石灰
胆矾
雾
D
臭氧
硫酸
氢氧化铜
氯化铵
氢氧化铁沉淀
A、A B、B C、C D、D3. 纳米材料是指在三维空间中至少有一维处于纳米尺寸(1~100nm)或由它们作为基本单元构成的材料。科学家曾研制出一种臂长7nm的不锈钢纳米镊子。若将很多这种镊子分散到水中,关于形成的体系说法正确的是( )A、这种不锈钢镊子很活泼,能够和水迅速反应 B、可以通过过滤的方法分离出镊子 C、用平行光照射,在侧面可以看见一条光亮的通路 D、静置后,镊子很快会沉到底部4. 下列离子能大量共存的是( )A、使无色酚酞试液显红色的溶液中: B、无色透明的溶液中: C、含有大量的溶液中: D、使紫色石蕊试液呈红色的溶液中:5. NA代表阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,2.24 L N2和O2的混合气体中气体分子总数为0.2NA B、39 g Na2O2中含有的离子总数为1.5NA C、1 mol Cl2与足量的Fe反应,转移电子数为3NA D、1 mol OH-所含电子数为9NA6. 做焰色反应时,下列操作事项正确的是( )①先把铂丝灼烧到与原来的火焰颜色相同,再蘸取被检物质
②钾的火焰颜色,要透过蓝色钴玻璃观察③每次实验后,要用盐酸把铂丝洗净
④最好选择火焰颜色较浅的煤气灯⑤也可以用光洁无锈的铁丝代替
A、仅④不正确 B、仅③不正确 C、仅②不正确 D、全部正确7. 下列说法正确的是( )A、Na2O、Na2O2的组成元素相同,二者分别与CO2反应的产物也相同 B、在反应2Na2O2+2H2O=4NaOH+O2↑中,Na2O2 氧化剂,H2O是还原剂
C、Na2O2溶于水产生O2的离子方程式为Na2O2+H2O=2Na++2OH-+O2↑
D、Na2O2用作呼吸面具供氧剂时,一部分氧元素被氧化,另一部分氧元素被还原
8. 如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
氧化剂,H2O是还原剂
C、Na2O2溶于水产生O2的离子方程式为Na2O2+H2O=2Na++2OH-+O2↑
D、Na2O2用作呼吸面具供氧剂时,一部分氧元素被氧化,另一部分氧元素被还原
8. 如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )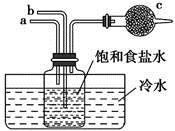 A、a通入CO2 , 然后b通入NH3 , c中放碱石灰 B、b通入NH3 , 然后a通入CO2 , c中放碱石灰 C、a通入NH3 , 然后b通入CO2 , c中放蘸稀硫酸的脱脂棉 D、b通入CO2 , 然后a通入NH3 , c中放蘸稀硫酸的脱脂棉9. 将少量Na2O2分别放入盛有下列溶液的小烧杯中,最终会有白色沉淀产生的是( )
A、a通入CO2 , 然后b通入NH3 , c中放碱石灰 B、b通入NH3 , 然后a通入CO2 , c中放碱石灰 C、a通入NH3 , 然后b通入CO2 , c中放蘸稀硫酸的脱脂棉 D、b通入CO2 , 然后a通入NH3 , c中放蘸稀硫酸的脱脂棉9. 将少量Na2O2分别放入盛有下列溶液的小烧杯中,最终会有白色沉淀产生的是( )①MgSO4溶液②FeCl3溶液③Ca(HCO3)2溶液④饱和澄清石灰水
A、①③ B、①④ C、①③④ D、①②③④10. 标准状况下,V L中含有a个原子,则阿伏加德罗常数的值为( )A、 B、 C、 D、11. 某兴趣小组用下列装置探究Na与CO2的反应产物,已知PdCl2+CO+H2O=Pd↓(黑色)+CO2+2HCl。下列说法正确的是( )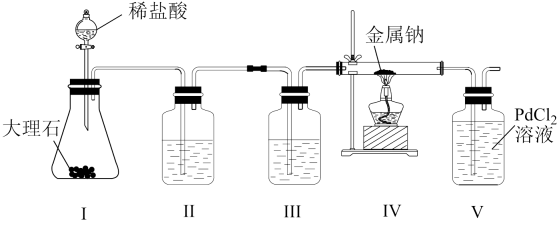 A、为了避免生成的CO2中混有HCl,最好用稀硫酸代替稀盐酸 B、装置III的目的是除去HCl C、实验时先点燃酒精灯,再打开活塞a D、装置V出现黑色沉淀,则装置IV发生反应可能为:2Na+2CO2=Na2CO3+CO12. 用新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图。下列说法正确的是( )
A、为了避免生成的CO2中混有HCl,最好用稀硫酸代替稀盐酸 B、装置III的目的是除去HCl C、实验时先点燃酒精灯,再打开活塞a D、装置V出现黑色沉淀,则装置IV发生反应可能为:2Na+2CO2=Na2CO3+CO12. 用新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图。下列说法正确的是( )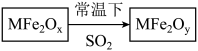 A、x﹥y B、SO2是该反应的催化剂 C、MFe2Ox是还原剂 D、SO2发生了分解反应13. 下列指定反应的离子方程式正确的是( )A、向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性: B、饱和滴入沸水中加热煮沸制备胶体:胶体 C、在强碱溶液中次氯酸钠与反应生成: D、向含有 的溶液中通入充分反应:14. 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示。则下列说法中不正确的是(已知:还原性:I->Fe2+>Br-)( )
A、x﹥y B、SO2是该反应的催化剂 C、MFe2Ox是还原剂 D、SO2发生了分解反应13. 下列指定反应的离子方程式正确的是( )A、向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性: B、饱和滴入沸水中加热煮沸制备胶体:胶体 C、在强碱溶液中次氯酸钠与反应生成: D、向含有 的溶液中通入充分反应:14. 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示。则下列说法中不正确的是(已知:还原性:I->Fe2+>Br-)( )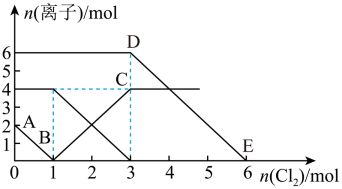 A、DE线段的反应方程式:2Br-+Cl2=Br2+2Cl- B、原混合溶液中FeBr2的物质的量为3mol C、线段AB表示Fe2+被氯气氧化 D、原溶液中:n(Fe2+):n (I-):n (Br-)=2:1:315. 将amol Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应.当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,值可能为( )A、0.5 B、0.65 C、0.85 D、1.016. 向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图所示。下列判断正确的是( )
A、DE线段的反应方程式:2Br-+Cl2=Br2+2Cl- B、原混合溶液中FeBr2的物质的量为3mol C、线段AB表示Fe2+被氯气氧化 D、原溶液中:n(Fe2+):n (I-):n (Br-)=2:1:315. 将amol Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应.当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,值可能为( )A、0.5 B、0.65 C、0.85 D、1.016. 向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图所示。下列判断正确的是( )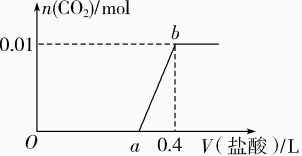 A、Oa段只发生中和反应 B、ab段发生反应的离子方程式为:HCO+H+=CO2↑+H2O C、a=0.2 D、原混合溶液中NaOH与Na2CO3的物质的量之比为 1∶217. 用作食盐中的补碘剂,具有氧化性,可用“氯酸钾氧化法”制备,该方法的第一步反应为。下列说法正确的是( )A、产生22.4L(标准状况)时,反应中转移 B、反应中氧化剂和还原剂的物质的量之比为6:11 C、可用石灰水吸收反应产生的制备漂白粉 D、能在酸性条件下氧化 , 因此可用酸化的淀粉碘化钾溶液检验食盐中的存在18. 同温同压下,用两个体积均为1L的圆底烧瓶分别收集HCl,将两烧瓶倒立在水槽中,a烧瓶内迅速充满水,b烧瓶内水充满 , 溶质均未向水槽内扩散,所得盐酸的物质的量浓度分别记为a和b(单位mol/L),则a、b关系为( )A、a>b B、a=b C、a<b D、不能确定19. 利用锥形瓶及CO2传感器测定密闭装置中的分压,采集数据如下:
A、Oa段只发生中和反应 B、ab段发生反应的离子方程式为:HCO+H+=CO2↑+H2O C、a=0.2 D、原混合溶液中NaOH与Na2CO3的物质的量之比为 1∶217. 用作食盐中的补碘剂,具有氧化性,可用“氯酸钾氧化法”制备,该方法的第一步反应为。下列说法正确的是( )A、产生22.4L(标准状况)时,反应中转移 B、反应中氧化剂和还原剂的物质的量之比为6:11 C、可用石灰水吸收反应产生的制备漂白粉 D、能在酸性条件下氧化 , 因此可用酸化的淀粉碘化钾溶液检验食盐中的存在18. 同温同压下,用两个体积均为1L的圆底烧瓶分别收集HCl,将两烧瓶倒立在水槽中,a烧瓶内迅速充满水,b烧瓶内水充满 , 溶质均未向水槽内扩散,所得盐酸的物质的量浓度分别记为a和b(单位mol/L),则a、b关系为( )A、a>b B、a=b C、a<b D、不能确定19. 利用锥形瓶及CO2传感器测定密闭装置中的分压,采集数据如下:
实验a:在锥形瓶内装入饱和溶液,加热,数据显示为图①;实验b:在锥形瓶内加入少量蒸馏水,加入固体后可形成饱和溶液,数据显示为图②。下列叙述不正确的是( )
A、实验a,溶液温度在50℃之前,溶液温度升高使CO2分压增大 B、实验a,温度升高到50℃之后,NaHCO3分解生成CO2使分压增大 C、实验b,NaHCO3与CaCl2反应为:2NaHCO3+CaCl2=Ca(HCO3)2+2NaCl D、实验b,CO2分压增大,发生反应离子方程式为:Ca2++2=CaCO3↓+CO2↑+H2O20. 下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )A、取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 B、取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 C、取a克混合物充分加热,减重b克 D、取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体二、填空题(本题共5个小题,共60分)
-
21. 回答下列问题:(1)、用20 g NaOH 配制成500 mL溶液,其物质的量浓度为mol/L,从中取出1 mL,其物质的量浓度为mol/L,含溶质g。若将这1 mL溶液用水稀释到100 mL,所得溶液中溶质的物质的量浓度为moI/L。(2)、在一定温度和压强下,0.4 mol某气体的体积为9.8 L,则该条件下的气体摩尔体积为。(3)、有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为。(4)、标准状况下,1.7g NH3与LH2S气体含有的氢原子数相同。22. 某化学兴趣小组在实验室用如下装置制备氯气:

请回答下列问题:
(1)、装置A中发生反应的化学方程式为。(2)、若要制备纯净、干燥的氯气,需在A、B之间添加净化装置D、E,其中导管连接的顺序是(填写数字编号)。(3)、D装置的作用是;E装置的作用是。(4)、C装置中发生反应的离子方程式为。23. 用98%的浓硫酸(ρ=1.84g⋅cm-3)配制1mol·L-1稀硫酸480mL。(1)、实验中应选用的玻璃仪器除了量筒、烧杯、玻璃棒外还只需要(填仪器名称)。(2)、实验操作:a.用量筒量取98%的浓硫酸;
b.将稀释后的浓硫酸转移到容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至距离刻度线1~2cm处;
f.盖上容量瓶瓶塞,摇匀,装瓶,贴标签;
g.用胶头滴管小心加蒸馏水至刻度线。
实验分析:
①步骤a中应该取浓硫酸mL。
②正确的操作顺序是(填序号)。
③下列操作使所配溶液的浓度偏高的有(填字母)。
A.使用容量瓶配制溶液时,俯视刻度线定容
B.取用敞口放置过长时间的浓硫酸
C.容量瓶用蒸馏水洗净后还剩有少量水
D.量取浓硫酸的量筒用蒸馏水洗涤两次并将洗涤液转入容量瓶
E.量取浓硫酸时俯视刻度线
24. 甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、CO32-、SO42-中的不同阳、阴离子各一种组成已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L乙溶液中c(H+)>0.1mol/L;
③向丙容器中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。
(1)、甲是 , 乙是 , 丙是 , 丁是。(2)、50mL含Na2SO4、Na2CO3的混合溶液中加入过量的甲溶液,得到14.51g白色沉淀,向白色沉淀中加入过量的稀HNO3充分反应后,沉淀减少到4.66g,并有气体产生。①写出产生气体的离子方程式:;
②混合溶液中Na+的物质的量的浓度是。
25.(1)、Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:
已知NaHCO3在低温下溶解度较小。
反应Ⅰ的化学方程式为。(2)、Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。
检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若 , 说明装置不漏气。
(3)、装置A中的试剂为 , 装置C中的试剂为。装置E的作用是。(4)、实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为(保留一位小数);若缺少E装置,会使测定结果(填“偏高”或“偏低”)。