山西省晋城市名校2023-2024学年高三上学期期中考试化学试题
试卷更新日期:2024-01-19 类型:期中考试
一、选择题(本题共20小题,1-10题每题2分,11-20题每题3分。在下列各题的四个选项中,只有一项是最符合题意的。)
-
1. 化学与生活密切相关,下列说法正确的是( )A、氢氧化铝胶体可用来对自来水净化和杀菌消毒 B、“血液透析”利用了胶体丁达尔效应 C、BaSO4常用来作胃镜中的“钡餐” D、为了消除碘缺乏病,在食用盐中加入一定量的碘单质2. 两种溶液相互滴加,反应过程中现象完全相同但离子方程式不同的是( )A、NaHCO3溶液与Ca(OH)2溶液 B、Na2CO3溶液与稀盐酸 C、Ca(HCO3)2溶液与Ca(OH)2溶液 D、AlCl3溶液与NaOH溶液3. 欲配制100mL1.0mol·L-1硫酸钠溶液,不正确的方法是( )A、将14.2g硫酸钠溶于100mL水中 B、将32.2gNa2SO4·10H2O溶于少量水中,再加水稀释至100mL C、将20mL5.0mol·L-1硫酸钠溶液用水稀释至100mL D、将14.2g硫酸钠溶于水中得到100mL溶液4. 已知拆开1molH-H键,1molN=N键分别需要吸收的能量为436kJ、946kJ;形成1molN-H键,会放出能量391kJ,在反应中,每生成3molN-H键( )A、吸收92kJ热量 B、放出46kJ热量 C、放出209kJ热量 D、吸收209kJ热量5. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、一定量的钠与8g氧气反应,若两者均无剩余,转移电子的数目为NA B、等物质的量的14NO和13CO气体中所含中子数均为15NA C、1mol丙烯酸(CH2=CHCOOH)中含有双键的数目为NA D、常温下,100mLpH=1的醋酸溶液中含有的氢离子数目为0.01NA6. 关于化合物2-苯基丙烯
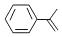 ,下列说法正确的是( ) A、不能使稀高锰酸钾溶液褪色 B、可以发生加成聚合反应 C、分子中所有原子共平面 D、易溶于水及甲苯7. 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193R,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是( )A、S2Cl2是含有极性键和非极性键的非极性分子 B、固态时S2Cl2属于共价晶体 C、S2Cl2与NaOH的化学方程式可能为: D、S2Cl2的电子式为8. CO2与SO2都是酸性氧化物,有许多相似的化学性质。用X表示C或S元素,下列反应的离子方程式一定正确的是( )A、使用过量的氨水吸收: B、将少量的XO2通入漂白粉溶液中: C、XO2溶于水: D、将过量的XO2通入NaOH溶液中:9. C4H8BrCl的同分异构体有( )A、9种 B、8种 C、12种 D、10种10. 甲~庚等元素在周期表中的相对位置如下表。己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
,下列说法正确的是( ) A、不能使稀高锰酸钾溶液褪色 B、可以发生加成聚合反应 C、分子中所有原子共平面 D、易溶于水及甲苯7. 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193R,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是( )A、S2Cl2是含有极性键和非极性键的非极性分子 B、固态时S2Cl2属于共价晶体 C、S2Cl2与NaOH的化学方程式可能为: D、S2Cl2的电子式为8. CO2与SO2都是酸性氧化物,有许多相似的化学性质。用X表示C或S元素,下列反应的离子方程式一定正确的是( )A、使用过量的氨水吸收: B、将少量的XO2通入漂白粉溶液中: C、XO2溶于水: D、将过量的XO2通入NaOH溶液中:9. C4H8BrCl的同分异构体有( )A、9种 B、8种 C、12种 D、10种10. 甲~庚等元素在周期表中的相对位置如下表。己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )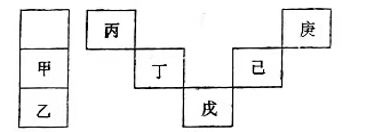 A、丙与戊的原子序数相差28 B、气态氢化物的稳定性:庚<己<戊 C、常温下,甲和乙的单质均能与水剧烈反应 D、丁的最高价氧化物可用于制造半导体材料11. 某无色澄清溶液可能含有Na+、Mg2+、Al3+、Ba2+、Fe3+、Cl-、SO42-、CO32-中的若干种,取样分别进行如下实验:
A、丙与戊的原子序数相差28 B、气态氢化物的稳定性:庚<己<戊 C、常温下,甲和乙的单质均能与水剧烈反应 D、丁的最高价氧化物可用于制造半导体材料11. 某无色澄清溶液可能含有Na+、Mg2+、Al3+、Ba2+、Fe3+、Cl-、SO42-、CO32-中的若干种,取样分别进行如下实验:①逐滴加入NaOH溶液,有白色沉淀生成,继续滴加至过量,沉淀部分溶解。
②加足量BaCl2溶液,产生白色沉淀,再向沉淀中加入过量稀盐酸,沉淀质量不变。
下列说法错误的是( )
A、原溶液中一定存在SO42-、Mg2+、Al3+ B、原溶液中可能存在Na+、Ba2+、Cl- C、原溶液中一定不存在Ba2+、Fe3+、CO32- D、原溶液中可能存在Na+、Cl-12. 某工厂拟综合处理含NH4+的废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计如图所示流程: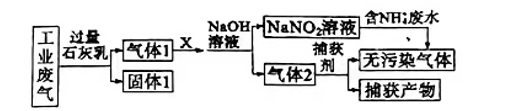
下列说法不正确的是( )
A、固体I中主要含有CaCO3、CaSO3、Ca(OH)2 B、X可以是空气,但不能过量 C、捕获剂所捕获的气体主要是CO、N2 D、处理含NH4+废水时,发生的反应为13. 我国科学家在合成气直接制烯烃方面的研究获重大突破。已知:下列说法不正确的是( )
A、△H1-△H2<0 B、反应②为吸热反应 C、 D、14. 为确定Fe2O3和Cu混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入30.0mL某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。下列说法不正确的是( )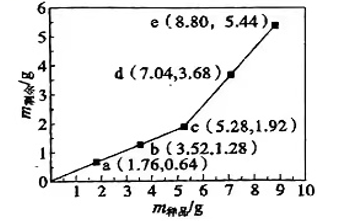 A、各组样品均发生反应:、 B、1.76g样品充分反应后,溶液中一定存在Fe2+和Cu2+ , 一定不存在Fe3+ C、该混合物中n(Fe2O3):n(Cu)=3:1 D、稀硫酸的浓度为1.5mol·L-115. 金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示。下列说法不正确的是( )
A、各组样品均发生反应:、 B、1.76g样品充分反应后,溶液中一定存在Fe2+和Cu2+ , 一定不存在Fe3+ C、该混合物中n(Fe2O3):n(Cu)=3:1 D、稀硫酸的浓度为1.5mol·L-115. 金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示。下列说法不正确的是( )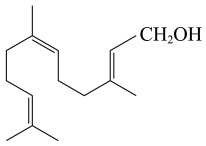 A、金合欢醇的同分异构体中不可能有芳香烃类 B、金合欢醇可发生加成反应、取代反应、氧化反应 C、金合欢醇分子的分子式为C15H26O D、1 mol金合欢醇与足量Na反应生成0.5 mol氢气, 与足量NaHCO3溶液反应生成1 mol CO216. 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
A、金合欢醇的同分异构体中不可能有芳香烃类 B、金合欢醇可发生加成反应、取代反应、氧化反应 C、金合欢醇分子的分子式为C15H26O D、1 mol金合欢醇与足量Na反应生成0.5 mol氢气, 与足量NaHCO3溶液反应生成1 mol CO216. 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: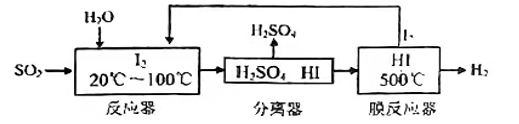
下列说法正确的是( )
A、分离器中的物质分离操作为过滤 B、膜反应器中,加入催化剂可以改变该反应的焓变 C、该工艺中I2和HI的相互转化体现了“碘循环” D、碘循环工艺的总反应为17. 将0.1molCl2通入100mL含等物质的量的HBr与H2SO3的混合溶液中,有一半的HBr被氧化,则下列说法正确的是( )A、物质的还原性:HBr>H2SO3>HCl B、HBr与H2SO3的物质的量浓度均为0.6mol·L-1 C、通入0.1molCl2发生反应的离子方程式为 D、若再通入0.05molCl2 , 恰好能将HBr和H2SO3完全氧化18. 已知:溴化铁在200℃以上易分解,煮沸水溶液也会使其分解,生成溴化亚铁和溴单质。实验室里利用如图装置制取纯净的无水FeBr3。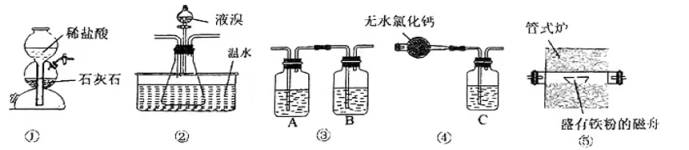
下列说法正确的是( )
A、A、B、C分别盛有饱和Na2CO3溶液、浓硫酸和烧碱溶液 B、实验结束时,先停止加热并停止滴入液溴,继续通入CO2至室温 C、实验开始时,先加热管式炉,再打开装置①中活塞 D、装置②中温水的作用是降低装置①中生成的CO2在液溴中的溶解度19. 某化工厂制备净水剂硫酸铁铵晶体【NH4Fe(SO4)2·6H2O】的一种方案如下:
下列说法不正确的是( )
A、滤渣A的主要成分是CaSO4 B、“合成”反应要控制温度,温度过高,产率会降低 C、“系列操作”包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等 D、相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强20. 某种固体消毒剂广泛用于游泳池消毒,其结构如图所示,其中W、X、Y、7是原子序数依次增大的四种短周期元素,Y的最外层电子数是内层电子数的3倍。下列叙述错误的是( )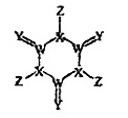 A、W和Z组成的化合物可以作灭火剂 B、原子半径:W>X>Y C、氧化物对应的水化物的酸性:Z>X D、该化合物中X、Y、Z均满足8电子稳定结构
A、W和Z组成的化合物可以作灭火剂 B、原子半径:W>X>Y C、氧化物对应的水化物的酸性:Z>X D、该化合物中X、Y、Z均满足8电子稳定结构二、非选择题
-
21.(1)、(I)工业合成氨的反应:是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1molH一H、1molN一H、1mol放出的能量分别为436kJ、391kJ、946kJ。则:
工业上合成2molNH3共放出能量kJ;实验室模拟工业合成氨时,在容积为2L的密闭容器内,开始投入N220mol、H230mol,反应经过10min后,生成10 mol NH3 , 则用N2表示的化学反应速率是mol·L-1·min-1。(2)、如果将1molN2和3molH2混合,使之充分反应,反应放出的热量总小于上述数值,为什么?。(3)、(Ⅱ)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案,已知:实验
0.1 mol.L-1酸性KMnO4溶液的体积/mL
0.6mol.L-1H2C2O4溶液的体积/mL
H2O的体积/mL
实验温度/℃
溶液褪色所需时间/min
1
10
V1
35
25
②
10
10
30
25
③
10
10
V2
50
表中V1=mL。
探究温度对化学反应速率影响的实验编号是(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是。
实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=mol·L-1·min-1。
22. 四氯化锡(SnCl4)是一种重要的化工原料,主要用于有机锡化合物的制造,也可用作分析试剂、有机合成脱水剂等。已知锡单质在加热时可直接与氯气化合生成,某实验小组用如下装置对其进行合成。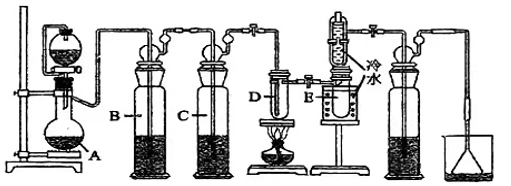
【相关药品性质】
药品
颜色、状态
熔点(℃)
沸点(℃)
其他性质
Sn
银白色固体
231
2260
较活泼金属能与O2、HCl等气体发生反应
SnCl4
无色液体
-33
114
极易水解产生SnO2.xH2O溶胶
请回答下列问题:
(1)、仪器A的名称是。(2)、写出SnCl4水解的化学方程式。将少量SnCl4置于空气中可观察到的现象是。(3)、检验装置气密性后,向A中装入KMnO4固体,小试管D内装入Sn片,恒压滴液漏斗中加入浓盐酸,(填“操作”及“现象”),点燃酒精灯开始反应;(4)、若无洗气瓶B,可能会导致的问题是;洗气瓶C中所盛放的药品是。(5)、试验结束后,小试管E内收集到的液体呈淡黄色,其原因是。23. 氧化铈(CeO2)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示: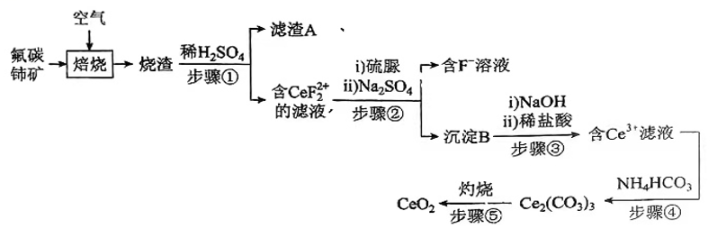
已知:①稀土离子易与SO42-形成复盐沉淀,Ce3+和SO42-发生反应:;
②硫脲:具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+ , 两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
(1)、滤渣A的主要成分是(填写化学式)。(2)、在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式。(3)、焙烧后加入稀硫酸浸出,为提高Ce的浸出率,需控制硫酸浓度不能太大的原因是。(4)、加入硫脲的目的是将CeF22+还原为Ce3+ , 反应的离子方程式为。(5)、步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为。(6)、下列关于步骤④的说法正确的是____(填字母)。A、该步骤发生的反应是 B、可以用Na2CO3溶液代替NH4HCO3溶液,不影响产品纯度 C、过滤时选择减压过滤能够大大提高过滤效率 D、过滤后的滤液中仍含有较多Ce3+ , 需要将滤液循环以提高产率(7)、取所得产品7.00gCeO2溶解后配成250mL溶液。取25.00mL该溶液用0.20mol.L-1硫酸亚铁铵【(NH4)2Fe(SO4)2】溶液滴定,滴定时发生反应 , 达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为。(保留三位有效数字)。24. 已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个国家的石油化工发展水平。下列是有机物A~G之间的转化关系: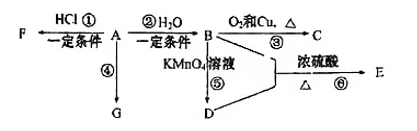
请回答下列问题:
(1)、A的官能团的名称是;C的结构简式是;G是一种高分子化合物,其最简式是。(2)、E是一种具有香味的液体,B+D→E的反应方程式为 , 该反应类型是;比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27℃)进行应急处理。写出由A制F的化学反应方程式;E的同分异构体能与NaHCO3溶液反应,写出该同分异构体的结构简式(一种即可)。