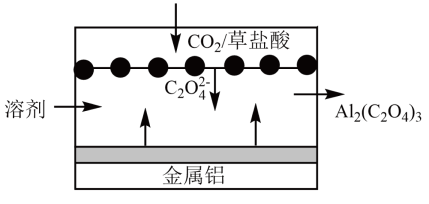
内蒙古部分名校2023-2024学年高三上学期期中联考化学试题
试卷更新日期:2024-01-17 类型:期中考试
一、选择题:本题共14小题,每小题3分,共42分,在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 文物凝结了人类智慧的结晶,也是历史进步的标志。下列文物的材质为合金的是( )




A.清光绪千金猴王砚
B.西周兽面纹青铜盉
C.木雕罗汉坐像
D.雪梅双鹤图
A、A B、B C、C D、D2. 下列化学用语表述正确的是( )A、聚丙烯酸乙酯的结构简式: B、中子数为8的碳原子: C、羟基的电子式: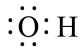 D、熔融状态下的电离方程式:
3. 化学是人类利用自然资源和应对环境问题的重要科学依据。下列说法正确的是( )A、煤的干馏过程中主要发生化学变化 B、长期使用DDT不会导致残留污染 C、工业冶炼Ag常用电解法 D、石油裂化和裂解的目的都是生产汽油4. 下列有关物质的性质与用途不具有对应关系的是( )
D、熔融状态下的电离方程式:
3. 化学是人类利用自然资源和应对环境问题的重要科学依据。下列说法正确的是( )A、煤的干馏过程中主要发生化学变化 B、长期使用DDT不会导致残留污染 C、工业冶炼Ag常用电解法 D、石油裂化和裂解的目的都是生产汽油4. 下列有关物质的性质与用途不具有对应关系的是( )选项
物质
性质
用途
A
硬度大
可制作砂轮磨料
B
具有还原性
可用于水处理中脱氧
C
受热易分解
可用作氮肥
D
不溶于水和酸,不易被X射线透过
可用作钡餐造影剂
A、A B、B C、C D、D5. 化学上,将质量数相同、质子数不同的核素称为同量素。某核聚变方程为。下列说法错误的是( )A、在NaOH溶液中X的金属性比Y的强 B、和互为同量素 C、与互为同位素 D、X、Y最外层电子数之比为6. 下列物质的转化在给定条件下不能实现的是( )A、 B、 C、 D、7. 通过测定混合气中含量可计算已变质的(含)纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是( )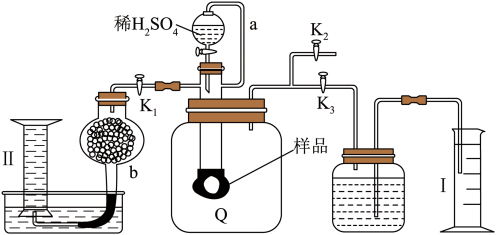 A、Q气囊中产生的气体主要成分为、 B、测定气体总体积必须关闭、 , 打开 C、读完气体总体积后,关闭 , 缓缓打开 , 可观察到Q气囊慢慢缩小 D、量筒I用于测二氧化碳的量,干燥管b中装入碱石灰,量筒Ⅱ用于测氧气的量8. 异硫氰酸荧光素酯()能和各种抗体蛋白结合,广泛应用于医学、农学和畜牧等方面,其结构简式如图所示。下列有关的说法正确的是( )
A、Q气囊中产生的气体主要成分为、 B、测定气体总体积必须关闭、 , 打开 C、读完气体总体积后,关闭 , 缓缓打开 , 可观察到Q气囊慢慢缩小 D、量筒I用于测二氧化碳的量,干燥管b中装入碱石灰,量筒Ⅱ用于测氧气的量8. 异硫氰酸荧光素酯()能和各种抗体蛋白结合,广泛应用于医学、农学和畜牧等方面,其结构简式如图所示。下列有关的说法正确的是( )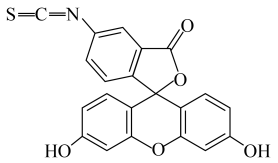
已知:连有四个不同的基团或原子团的碳原子称为手性碳原子。
A、分子中含有18个碳原子 B、分子中所有原子可能共平面 C、能发生取代反应和加成反应 D、分子中含有手性碳原子9. 属于钠的化合物,具有很强的氧化性。少量与溶液能发生如下反应:(方程式未配平),设为阿伏加德罗常数的值,下列说法错误的是( )A、1L 1 溶液含的数目为2 B、1mol 可制得的胶粒数为 C、78g 含有共价键的数目为 D、每生成1mol X,转移的电子数为10. 下列方程式正确的是( )A、向溴的四氯化碳溶液中通入乙烯,溶液褪色: B、向明矾溶液中加入过量氨水: C、用稀硝酸除去铜粉中的少量铁粉: D、向溴水中通入 , 溶液褪色:11. 下列实验操作或做法正确且能达到目的的是( )选项
实验操作或做法
目的
A
向盛有固体的锥形瓶中滴加稀盐酸,产生无色气体
证明氯元素的非金属性强于硫元素
B
实验室将生成的乙酸乙酯导入饱和的溶液中,分液
使乙酸乙酯产品更加纯净
C
向2支盛有5 mL不同浓度溶液的试管中同时加入2 mL 5%的溶液,观察实验现象
探究浓度对反应速率的影响
D
向淀粉水解液中直接加入新制银氨溶液并水浴加热,未形成银镜
说明淀粉未发生水解
A、A B、B C、C D、D12. 由W、X、Y、Z四种原子序数依次增大的短周期主族元素组成的化合物M可作肥料,W、X、Y、Z分属三个短周期,其中X、Z位于同一主族,Y是地壳中含量最多的元素,且四种元素的原子序数之和为31,下列说法正确的是( )A、由W、X组成的某种化合物与水可形成分子间氢键 B、最简单氢化物的稳定性:X>Z>Y C、简单离子半径:X>Z>Y D、Z的最高价氧化物对应的水化物为二元强酸13. 某温度下,在2L恒容密闭容器中加入3.0molX,发生反应 , 反应过程中有关数据如下表:时间/min
0
5
10
15
20
25
Z的物质的量/mol
0
0.1
0.18
0.25
025
0.25
下列说法错误的是( )
A、5min时,Y的浓度为 B、0~10min内,Y的平均反应速率为 C、当容器内的值不变时,该反应达到平衡状态 D、当混合气体的密度不再改变时,该反应达到最大限度14. 某固体混合物可能由、、FeS、、、中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是( )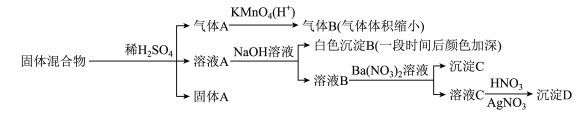 A、气体A中一定含有 B、固体A中一定含有S和 C、该固体混合物至少含和FeS中的一种 D、该固体混合物中一定含有、、
A、气体A中一定含有 B、固体A中一定含有S和 C、该固体混合物至少含和FeS中的一种 D、该固体混合物中一定含有、、二、非选择题:本题共4小题,共58分。
-
15. 主族元素A、B、C、D、E、F、G、H在元素周期表中的相对位置如图所示。已知上述8种元素的原子最外层电子数之和等于47,C与H的质子数之和为43.请回答下列问题:
A
B
C
D
E
F
G
H
(1)、G在元素周期表中位于第周期第族。(2)、在C、D、G的最简单氢化物中,最不稳定的是(填化学式),常温下,B的最简单氢化物的水溶液的pH(填“>”、“<”或“=”)7.(3)、单质A(填“能”或“不能”)与B的最高价氧化物对应的水化物的浓溶液发生反应。(4)、E的简单氢化物通入胆矾溶液中,产物含红色单质和两种最高价含氧酸,该反应的离子方程式为。(5)、3molF单质通入热KOH溶液中完全反应,共转移5mol电子。在该反应中,氧化剂与还原剂的质量之比为。(6)、一定条件下,AC、BC和熔盐(能传导)能形成原电池(产物为无污染气体),其中负极通入的是(填化学式),正极的电极反应为。16. 生物地球氮化学循环模式图的一部分如图,请根据所学知识回答问题。已知:硝化作用是在有氧的条件下,氨或铵根经亚硝酸细菌和硝酸细菌的作用转化为硝酸的过程。铵根浓度或pH过大,都会使硝化作用减弱。
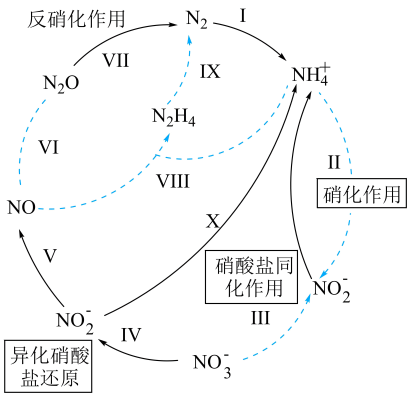 (1)、属于氮的固定的是(填标号)。(2)、利用如图装置可以制备、检验和收集NO。
(1)、属于氮的固定的是(填标号)。(2)、利用如图装置可以制备、检验和收集NO。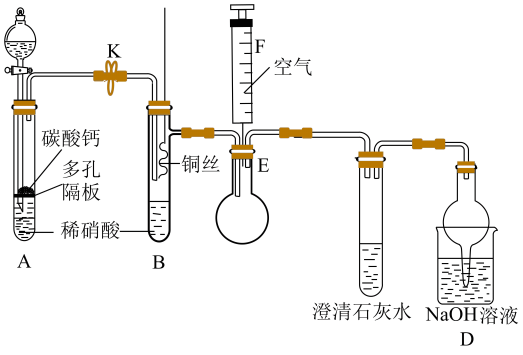
①实验前先打开开关K通入一段时间,其目的是。采用抽拉铜丝与稀硝酸反应的优点为。
②检验生成的气体为NO的操作是。
③装置D的作用是。
(3)、NO与反应生成的离子方程式为 , 该反应中氧化产物与还原产物的物质的量之比为。(4)、写出铵根经硝化作用直接转化为硝酸根的离子方程式: , 铵根浓度或pH过大,都会使硝化作用减弱的可能原因为。17. 宏观辨识与微观探析是化学学科核心素养之一、根据所学知识,回答下列问题:(1)、拟卤离子主要有、、 , 性质与卤离子相似,它们相应的中性分子性质与卤素单质也相似。①已知还原性; , 写出酸性条件下加热时,和KSCN(aq)反应的离子方程式:。
②与水反应生成的含氧酸的结构式为。氰化提金工艺在黄金生产领域仍占主导地位,但会产生大量含氰()废水,含氰废水中加入足量的 , 发生反应的离子方程式为。理论上处理含氰废水(含),需要消耗g(保留2位小数)。按照理论值投放,含氰废水处理效果并不理想,请分析原因:。
(2)、酒精仪中酸性重铬酸钾(稀硫酸酸化)可将乙醇氧化成乙酸,本身被还原成。写出该反应的离子方程式:;在该反应中还原剂是(填化学式)。氧化23g乙醇时转移电子的物质的量为。(3)、和都属于离子型化合物,前者跟水反应生成和 , 写出跟水反应的化学方程式:。18. 研究化学反应中的能量和速率变化对生产、生活有着重要意义。(1)、I.某些常见化学键的键能(将气体分子AB断裂为中性气态原子A和B所需的能量或A和B合成1molAB气体所放出的能量)数据如下表:
完全燃烧生成和气态水放出的能量为kJ。该反应中反应物的总能量(填“>”、“<”或“=”)生成物的总能量。化学键
键能/()
414
803
463
498
(2)、II.实验室模拟热气循环法合成尿素,与在一定条件下发生反应:。为了验证反应温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
实验编号
初始浓度/()
初始浓度/()
催化剂的比表面积/()
①
280
82
②
③
350
a
82
控制变量是科学研究的重要方法,因此表中数据: , 。
(3)、对比实验①③,目的是验证(填“反应温度”或“催化剂的比表面积”)对化学反应速率的影响规律。(4)、一定温度下,向1L密闭容器中充入和发生反应: , 若起始压强为 , 反应2min后该反应达到化学平衡状态,平衡时的压强是起始时的0.8倍,则0~2min内, , 的平衡转化率为%。(5)、下列情况中,一定能说明上述反应达到平衡的是____(填标号)。A、的体积分数保持不变 B、反应体系中气体的密度保持不变 C、反应消耗 , 同时生成 D、的质量保持不变(6)、“碳呼吸电池”是一种新型化学电源,其工作原理如图。当得到时,电路中转移的电子的物质的量为mol。