辽宁省大连市第二十四名校2023-2024学年高一上学期期中考试化学试题
试卷更新日期:2024-01-17 类型:期中考试
一、选择题(包括15小题,每小题3分,共45分。每小题只有1个选项符合题意)
-
1. 中国古代诗词和书籍中蕴含着化学知识。下列说法错误的是( )A、《天工开物》中“凡石灰,经火焚炼为用”涉及的反应类型是分解反应 B、《神农本草经》中提到:“白青得铁化为铜”,其中白青属于碱 C、“墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”是一种分散系 D、《本草纲目》:“水银乃至阴之票物,因火煅丹砂而出”,其中发生了氧化还原反应2. 下列物质的转化,不能由一步反应实现的是( )A、 B、 C、 D、3. 下列反应的离子方程式中,书写正确的是( )A、将稀硫酸滴在铁片上: B、溶于过量的溶液中: C、硝酸银溶液与铜反应: D、用小苏打治疗胃酸过多:4. 下列关于钠及其化合物的叙述不正确的是( )A、实验室应将少量钠保存在煤油中 B、金属钠着火时,可用干燥的细沙覆盖灭火 C、钠切开后,光亮的表面迅速变暗,是因为生成了Na2O2 D、用加热的方法可除去Na2CO3粉末中含有的少量NaHCO35. 下列实验装置或操作与微粒的大小无直接关系的是( )
A
B
C
D
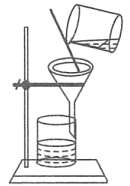


过滤
渗析
蒸发
丁达尔效应
A、A B、B C、C D、D6. 如表所示,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )陈述Ⅰ
陈述Ⅱ
判断
A
中的少量杂质可将气体通入饱和溶液除去
可与反应
Ⅰ对,Ⅱ对,有
B
用洁净的铂丝蘸取某溶液进行焰色试验,火焰为黄色
该溶液一定是钠盐的溶液
Ⅰ对,Ⅱ对,有
C
金属钠具有强还原性
高压钠灯发出透雾性强的黄光
Ⅰ对,Ⅱ对,有
D
过氧化钠可为航天员供氧
能与和反应生成
Ⅰ对,Ⅱ对,有
A、A B、B C、C D、D7. 铋(Bi)元素价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如下表所示:加入溶液
①适量铋酸钠溶液
②过量的双氧水
③适量KI•淀粉溶液
实验现象
溶液呈紫红色
紫红色消失,产生气泡
得到蓝色溶液
则下列说法错误的是( )
A、②中产生的气体为O2 B、③中Mn2+做氧化剂 C、氧化性:NaBiO3>KMnO4>H2O2>I2 D、还原性:Mn2+>Bi3+8. 图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极,X与电源正极相连,Y与电源负极相连)微观示意图。下列说法正确的是( )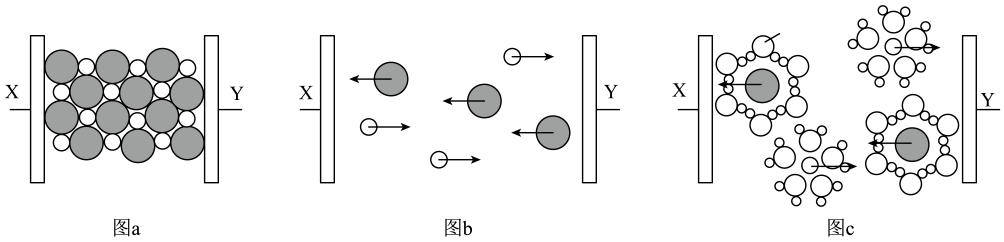 A、图示中
A、图示中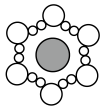 代表的是水合钠离子
B、氯化钠只有在通电条件下才能电离
C、图b表示熔融状态下氯化钠的导电过程
D、氯化钠在不同状态下均能导电
9. 取和组成的混合气体 , 通入到盛足量固体粉末的容器中,并同时加入足量的 , 电火花引燃,充分反应后,称重发现固体粉末的质量增加了3.6g,则原混合气体中和质量比为( )A、7:2 B、6:5 C、2:3 D、1:410. 阿伏加德罗常数的值为 , 下列叙述中错误的是( )
代表的是水合钠离子
B、氯化钠只有在通电条件下才能电离
C、图b表示熔融状态下氯化钠的导电过程
D、氯化钠在不同状态下均能导电
9. 取和组成的混合气体 , 通入到盛足量固体粉末的容器中,并同时加入足量的 , 电火花引燃,充分反应后,称重发现固体粉末的质量增加了3.6g,则原混合气体中和质量比为( )A、7:2 B、6:5 C、2:3 D、1:410. 阿伏加德罗常数的值为 , 下列叙述中错误的是( )①标准状况下,水中含有个水分子
②常温常压下,含有的分子数约为
③的摩尔质量为
④的气体摩尔体积约为
⑤标准状况下,由和组成的混合气体中,所含氮原子的物质的量为
⑥的溶液中的数目为
⑦常温常压下,氦气含有的原子数为
A、①③④⑥ B、③⑤⑥⑦ C、①②③⑤ D、②④⑥⑦11. 酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有、、、等。已知(亚磷酸)与足量的NaOH反应生成一种盐 , 则下列说法正确的是( )A、属于一元酸 B、属于三元酸 C、属于酸式盐 D、属于酸式盐12. 甲、乙两种溶液中分别含有大量的、、、、、这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )A、、、 B、、、 C、、、 D、、、13. 侯氏制碱原理中涉及的反应有反应Ⅰ: . 反应Ⅱ: , 下列图示装置能达到实验目的的是( ) A、图1是制取 B、图2是分离与水 C、图3是除去中的HCl D、图4是制取固体14. 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在室温下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复室温后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
A、图1是制取 B、图2是分离与水 C、图3是除去中的HCl D、图4是制取固体14. 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在室温下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复室温后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )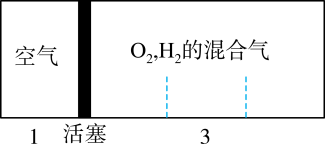 A、5:2 B、4:5 C、4:7 D、2:715. 下列说法不正确的是( )A、某硝酸密度为 , 质量分数为 , 此硝酸物质的量浓度为 B、将的氨水和的氨水等体积混合后,所得溶液的质量分数可能为小于或等于 C、浓度为的硫酸中加入一定的水稀释成 , 则加入水的体积大于 D、将标准状况下的氯化氢气体溶于水中,得到的盐酸的密度为 , 则该盐酸的物质的量浓度是
A、5:2 B、4:5 C、4:7 D、2:715. 下列说法不正确的是( )A、某硝酸密度为 , 质量分数为 , 此硝酸物质的量浓度为 B、将的氨水和的氨水等体积混合后,所得溶液的质量分数可能为小于或等于 C、浓度为的硫酸中加入一定的水稀释成 , 则加入水的体积大于 D、将标准状况下的氯化氢气体溶于水中,得到的盐酸的密度为 , 则该盐酸的物质的量浓度是二、非选择题(包含4小题,共55分)
-
16. 按要求回答下列问题(1)、在我们的日常生活中蕴含如下化学知识:
①纯碱去油污
②明矾可以净水
③醋酸作为调味剂
④铜锈的主要成分为
⑤可以杀菌
上述涉及的物质成分中,属于弱电解质的有(填写化学式),写出其电离方程式。
(2)、现有物质①铜、②干冰、③固体、④溶液、⑤蔗糖、⑥熔融。在相应状态下能导电的是:(填序号,下同)属于电解质但相应状态下不导电的是。将③固体溶于水,其电离方程式。(3)、向溶液中逐滴滴加溶液至恰好完全沉淀,发生反应的离子方程式为;恰好沉淀后继续滴加溶液时,发生反应的离子方程式为。17. 氧化还原反应是中学化学中常见的反应类型,请按要求完成下列问题:(1)、I.及均可将溶液中的还原为银,从而可用于化学镀银。中,P元素的化合价为。(2)、利用进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为(填化学式)(3)、取的溶液与一定量的酸性溶液(在反应中生成)恰好反应,生成等物质的量的和 , 则消耗的物质的量的是mol。(4)、II.高铁酸钾是一种新型绿色消毒剂,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。干法制备:
先制备得到 , 反应为 , 该反应中,氧化剂是 , 氧化产物是。
(5)、配平湿法制备的离子方程式并用双线桥表示出电子转移的方向和数目:。(6)、取少量溶液,滴加盐酸,有产生,该反应表明氧化性:(填“>”或“<”)。18. 某化学兴趣小组甲、乙两位同学为测定和混合物中的质量分数,分别进行实验。回答下列问题:(1)、甲同学用如图装置进行测定。
称取一定质量的待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的 , 然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗a的活塞,打开弹簧夹,再通入一段时间的 , 然后取下干燥管称得其质量为。
①洗气瓶b中盛放的液体是(写名称)。
②锥形瓶中发生反应的离子方程式为。
③第二次通入的目的是。如果没有进行第一次通操作,测量的结果将会(填“偏大”“偏小”或“不变”)。
④甲同学设计的实验装置中存在一不合理之处,会导致测定结果出现误差。如何改进?。
(2)、乙同学用下图所示方法和步骤进行实验:
乙同学测得样品中的质量分数为(用含x和y的代数式表示)
19. 按要求完成下列填空:(1)、I.配制溶液的实验步骤如下:a.计算需要氢氧化钠固体的质量
b.用滤纸称量氢氧化钠固体;
c.用适量的蒸馏水溶解称量好的氢氧化钠固体,直接注入容量瓶;
d.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液也注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀
e.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切:
f.盖好瓶塞,反复上下颠倒,摇匀;
g.将配制好的溶液倒入试剂瓶中,并贴好标签。
下图所示的仪器中,配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器有烧杯、玻璃棒和(填仪器名称)。 (2)、所需称量的氢氧化钠固体的质量是。(3)、配制上述溶液的操作不正确的是(填序号)。(4)、配制过程中,其他操作均正确,下列能引起所得溶液浓度偏高的是____(填序号)。A、定容时,俯视刻度线 B、定容摇匀后,发现液面低于刻度线,又用胶头滴管滴加蒸馏水至刻度线 C、转移前,发现容量瓶内含有少量蒸馏水 D、称量时使用的砝码生锈(5)、II.化学实验和科学研究中常需要用一定溶质质量分数的溶液配制一定物质的量浓度的溶液。
(2)、所需称量的氢氧化钠固体的质量是。(3)、配制上述溶液的操作不正确的是(填序号)。(4)、配制过程中,其他操作均正确,下列能引起所得溶液浓度偏高的是____(填序号)。A、定容时,俯视刻度线 B、定容摇匀后,发现液面低于刻度线,又用胶头滴管滴加蒸馏水至刻度线 C、转移前,发现容量瓶内含有少量蒸馏水 D、称量时使用的砝码生锈(5)、II.化学实验和科学研究中常需要用一定溶质质量分数的溶液配制一定物质的量浓度的溶液。现用质量分数为98%、密度为的浓硫酸来配制500mL、的稀硫酸。计算所需浓硫酸的体积为mL(保留1位小数),现有①10mL②25mL③50mL④100mL四种规格的量筒,你选用的量筒是(填代号)。
(6)、在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所配溶液浓度(填“偏大”、“偏小”或“无影响”)。