辽宁省大连市滨城高中联盟 2023-2024学年高二上学期11月期中考试化学试题
试卷更新日期:2024-01-17 类型:期中考试
一、单选题(本题共15小题,每题3分)
-
1. 下列叙述正确的是( )A、已知P(白磷,s)=P(红磷,s) , 则白磷比红磷稳定 B、已知 , , 则 C、已知 , 向密闭容器中加入2mol 和2mol (g),充分反应后放出的热量小于2a kJ D、已知 , 则含1mol NaOH的稀溶液与足量稀醋酸,完全中和,放出的热量等于57.3kJ2. 下列说法正确的是( )A、铵盐的溶解、酸碱中和反应、电解熔融氧化铝都是自发过程 B、常温下自发,说明反应放热,且化学反应速率快 C、室温下,(g)和(g)混合无液态水生成,说明 D、已知 , T=980K时, , 则当温度低于980K时,CO将发生分解3. 用0.65g锌粒与10mL 1.0mol/L硫酸反应制氢气,下列措施能加快反应速率且不改变氢气的产量,下列操作可行的有几项( )
①用等质量的锌粉代替锌粒
②将反应溶液适当加热
③向反应液中滴入少量溶液
④用10mL 98%硫酸代替10mL 1.0mol/L的硫酸
⑤再加入10mL 2.0mol/L盐酸
⑥向反应液中加入少量固体
A、2 B、3 C、4 D、54. Burns和Dainton研究发现与CO合成的反应机理如下:① 快
② 快
③ 慢
其中反应②存在;。下列说法正确的是( )
A、反应②的平衡常数 B、反应①②的活化能均大于反应③ C、增加CO(g)浓度能增加活化分子百分数,加快反应速率 D、COCl·是该反应的催化剂5. 标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下,已知(g)和(g)的相对能量为0,下列说法正确的是( )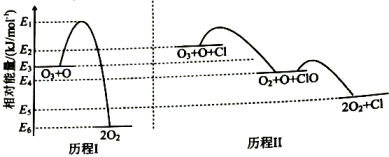 A、ClO在历程Ⅱ中作催化剂 B、相同条件下,的平衡转化率:历程Ⅱ>历程Ⅰ C、的 D、历程Ⅱ中速率最慢的一步反应的执化学方程式为6. 按如图所示的实验装置或方案进行实验,能达到相应实验目的的是( )
A、ClO在历程Ⅱ中作催化剂 B、相同条件下,的平衡转化率:历程Ⅱ>历程Ⅰ C、的 D、历程Ⅱ中速率最慢的一步反应的执化学方程式为6. 按如图所示的实验装置或方案进行实验,能达到相应实验目的的是( )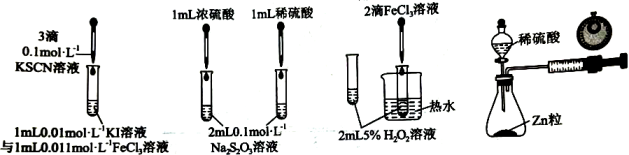
甲 乙 丙 丁
A、用甲证明KI与的反应存在一定的限度 B、用乙探究浓度对化学反应速率的影响 C、用丙验证对分解反应有催化作用 D、用丁比较不同浓度的稀硫酸与锌反应的速率大小7. 在恒温恒容条件下,发生反应: , 测得与时间关系如图,下列叙述错误的是( ) A、a~b段CO平均速率 B、其他条件不变,相对甲曲线,乙曲线加入催化剂 C、不同时刻均存在 D、b点逆反应速率小于c点正反应速率8. 常温下,下列说法正确的是( )A、pH=8的溶液中,水电离产生的 B、pH相等的、NaOH和三种溶液: C、将等体积等物质的量浓度的和NaF溶液混合: D、0.1mol/L 溶液与0.1mol/L 溶液中:前者小9. 部分弱电解质的电离常数如下表:
A、a~b段CO平均速率 B、其他条件不变,相对甲曲线,乙曲线加入催化剂 C、不同时刻均存在 D、b点逆反应速率小于c点正反应速率8. 常温下,下列说法正确的是( )A、pH=8的溶液中,水电离产生的 B、pH相等的、NaOH和三种溶液: C、将等体积等物质的量浓度的和NaF溶液混合: D、0.1mol/L 溶液与0.1mol/L 溶液中:前者小9. 部分弱电解质的电离常数如下表:弱电解质
HCOOH
HCN
电离常数(25℃)
、
下列说法错误的是( )
A、根据电离常数,可判断酸性 B、等体积、等浓度的HCOONa和NaCN溶液中离子总数:前者小于后者 C、向NaCN溶液中通入少量 , 离子方程式为: D、25℃时,反应的化学平衡常数为10. 下列图示与对应的叙述不相符的是( )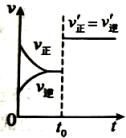
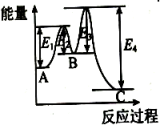
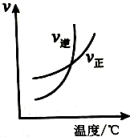
表示达平衡的某反应,在时改变条件后反应速率随时间变化,改变的条件可能是增大压强
表示平衡在时迅速将体积缩小后的变化
表示的反应的
可判断某可逆反应的正反应是放热反应
A
B
C
D
A、A B、B C、C D、D11. 下列实验操作、实验现象及根据现象得出的结论,都正确的是( )选项
实验操作
实验现象
结论
A
常温下,测饱和NaA溶液和饱和NaB溶液的pH
前者大于后者
常温下水解程度:
B
等体积、pH=3的两种酸HA和HB,分别与足量的Zn反应
酸HA放出的氢气多
酸性:HA>HB
C
向滴有酚酞的氨水中加入少量固体
溶液红色变浅
是弱电解质
D
用广泛pH试纸测定一定物质的量浓度NaClO溶液的pH
pH=9
次氯酸是弱酸
A、A B、B C、C D、D12. 利用制备甲醇是温室气体资源化重要途径。在某催化加氢制甲醇的反应体系中主要存在如下反应:反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
向恒压、密闭容器中通入1mol 和3mol , 平衡时CO、和的物质的量分数随温度变化如图所示。下列说法不正确的是( )
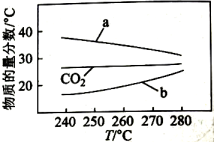 A、 B、曲线b表示的物质的量分数随温度的变化 C、在不改变反应时间和温度条件下,增大压强能提高的产量 D、在240~270℃内,温度改变对反应Ⅰ和反应Ⅱ平衡影响相反且程度接近13. 可作为水溶液中歧化反应( )的催化剂。某实验小组为探究浓度、催化剂和溶液酸性对歧化反应速率的影响,分别在盛有反应物的试管中加入2mL相应试剂,密闭放置观察现象。
A、 B、曲线b表示的物质的量分数随温度的变化 C、在不改变反应时间和温度条件下,增大压强能提高的产量 D、在240~270℃内,温度改变对反应Ⅰ和反应Ⅱ平衡影响相反且程度接近13. 可作为水溶液中歧化反应( )的催化剂。某实验小组为探究浓度、催化剂和溶液酸性对歧化反应速率的影响,分别在盛有反应物的试管中加入2mL相应试剂,密闭放置观察现象。实验编号
反应物
试剂组成
实验现象
①
18mL 饱和溶液
a
无明显现象
②
18mL 饱和溶液
0.4 KI
一段时间出现浑浊
③
18mL 稀溶液
0.4 KI
出现浑浊较②慢
④
18mL 饱和溶液
b KI、0.2
出现浑浊较②快
⑤
18mL 饱和溶液
0.2
无明显现象
下列说法不正确的是( )
A、a可能是 , b=0.4 B、实验②、③的目的是探究浓度对水溶液中歧化反应速率的影响 C、实验说明对水溶液中歧化反应速率一定有影响 D、实验说明存在时,可以加快水溶液中歧化反应速率14. 常温下,在10mL 0.1 MOH溶液中滴加pH=1的盐酸,溶液AG()与盐酸体积(V)之间的关系如图所示,下列说法不正确的是( )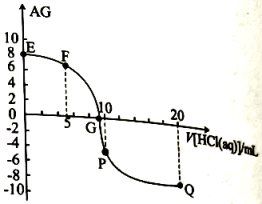 A、常温下,MOH的电离常数约为 B、F点溶液中: C、滴加盐酸过程中,水的电离程度:P点最大 D、Q点溶液中:15. 常温下,向某浓度的溶液中逐滴加入已知浓度的NaOH溶液,若pC表示溶液中溶质微粒的物质的量浓度的负对数,则所得溶液中、、与溶液pH的变化关系如图所示。已知: ; 。则下列说法正确的是( )
A、常温下,MOH的电离常数约为 B、F点溶液中: C、滴加盐酸过程中,水的电离程度:P点最大 D、Q点溶液中:15. 常温下,向某浓度的溶液中逐滴加入已知浓度的NaOH溶液,若pC表示溶液中溶质微粒的物质的量浓度的负对数,则所得溶液中、、与溶液pH的变化关系如图所示。已知: ; 。则下列说法正确的是( )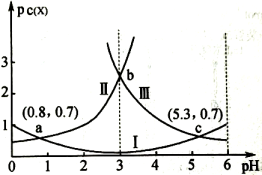 A、当pH=3时,溶液中 B、常温下,的数量级为 C、常温下,NaHA溶液呈碱性 D、常温下随着pH的增大,的值不变
A、当pH=3时,溶液中 B、常温下,的数量级为 C、常温下,NaHA溶液呈碱性 D、常温下随着pH的增大,的值不变二、非选择题(共4道题,55分)
-
16. 为保障人民健康,我国制定了十分严格的使用标准,《食品安全国家标准食品添加剂使用标准》(GB2760-2014)规定含硫类食品添加剂的最大使用量范围为0.01~0.4(以残留量计算)。某化学兴趣小组按照如下步骤测定去核大枣中的残留量。
ⅰ.准确称取10.00g去核大枣装入500mL圆底烧瓶中,将样品用硫酸酸化后加入300mL水并通入氮气,将氮气流速调至0.2并低于100℃加热,蒸出的用双氧水吸收,实验装置加图所示(夹持和加热装置已省略)。

ⅱ.充分反应后,合并乙、丙中的吸收液于锥形瓶中,煮沸一段时间后,冷却。
ⅲ.滴加几滴酚酞作指示液,用0.01的NaOH标准液滴定。重复实验四次,所得数据如表所示:
序号
1
2
3
4
标准液初始读数/mL
0.00
0.10
0.30
0.40
标准液滴定终点读数/mL
8.80
8.95
10.15
9.15
回答下列问题:
(1)、步骤ⅰ中持续通的作用是;双氧水吸收时的化学方程式为。(2)、步骤ⅲ中盛装0.01的NaOH标准液的仪器为(填标号),该仪器使用之前需要进行的操作为。A.
 B.
B. C.
C. D.
D. (3)、步骤ⅱ中煮沸的目的可能是。(4)、步骤ⅲ中滴定终点的现象为 , 下列操作会使测得的含量偏小的是(填标号)。
(3)、步骤ⅱ中煮沸的目的可能是。(4)、步骤ⅲ中滴定终点的现象为 , 下列操作会使测得的含量偏小的是(填标号)。a.滴定前尖嘴处无气泡,滴定后有气泡
b.盛装0.01的NaOH标准液的仪器未用标准液润洗
c.滴定前读数时俯视刻度线,滴定终点读数时仰视刻度线
d.氮气流速过快
(5)、该大枣中的残留量为(保留小数点后两位) , (填“符合”或“不符合”)国家标准。17.(1)、Ⅰ.碳酸及碳酸盐与自然界碳的循环有着密切的联系。为了维持正常的生理活动,人体各种体液的pH都要保持在一个较小的pH变化范围。血液的正常pH范围是7.35~7.45.当血浆pH低于7.2会引起酸中毒,高于7.5会引起碱中毒。血浆“”缓冲体系对稳定体系酸碱度有重要作用。该缓冲体系存在如下平衡:①向缓冲体系加入少量强碱时,上述平衡移动(填“正向”、“逆向”、“不移动”)
②当大量酸进入到缓冲体系时,体系中将(填“变大”、“变小”或者“不变”)
③若某温度下的 , 当血浆中时,人体发生(填“酸”或“碱”)中毒。(2)、Ⅱ.雌黄()和雄黄()都是自然界中常见的砷化合物,早期曾用作绘画颜料,因都有抗病毒疗效而入药。可转化为用于治疗白血病的亚砷酸()。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图(a)所示。

(a)
①人体血液的pH为7.35~7.45,用药后人体中含砷元素的主要微粒是。
②将KOH溶液滴入亚砷酸溶液,当pH调至11时,所发生反应的离子方程式是
③下列说法中,正确的是(填字母序号)。
a.当时,溶液呈碱性
b.pH=12时,溶液中
c.在溶液中,
(3)、工业含砷(Ⅲ)废水常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生胶粒,其表面带有正电荷,可吸附含砷化合物。测得不同pH条件下铁盐对含砷(Ⅲ)化合物的去除率,如图(b)所示。pH为5~9时,随溶液pH增大,铁盐混凝剂对含砷(Ⅲ)化合物的吸附效果增强。结合图(a)和图(b),解释可能的原因:。
(b)
18. 氨的用途十分广泛,是制造硝酸和氮肥的重要原料。(1)、Ⅰ.传统的“哈伯法”合成氨原理为:上述反应在常温下(填“能”或“不能”)自发进行。
(2)、一定条件下,在恒温恒容的密闭容器中充入等物质的量和发生反应生成 , 下列状态能说明反应达到平衡的是____(填标号)。A、容器内压强不变 B、的体积分数不变 C、气体的密度不再改变 D、 E、容器内气体的平均摩尔质量不变(3)、已知合成氨从反应的速率方程为: , 在合成氨过程中,需要不断分离出氨,可能的原因为。(4)、科字家推出合成氨反应在接近平衡时净反应速率方程式为: , , 分别为正、逆反应速率常数,p代表各组分的分压,如 , 其中为平衡体系中B的体积分数,p为平衡总压强16MPa,以铁为催化剂时 , 一定条件下,向容器中充入5mol 和15mol 的混合气体,平衡时氨气的体积分数为25%,试计算。(写出计算表达式,不考虑单位)(5)、Ⅱ.尿素()是一种非常重要的高效氮肥,工业上以、为原料生产尿素,该反应实际为两步反应:第一步:
第二步:
写出工业上以、为原料合成尿素的热化学方程式:。
某实验小组模拟工业上合成尿素的条件,在一体积为0.5L密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图所示:
 (6)、已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第步反应决定,总反应进行到min时到达平衡。19. 以乙苯催化脱氢来制取乙烯,是化工产业中常用的方法如下所示:
(6)、已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第步反应决定,总反应进行到min时到达平衡。19. 以乙苯催化脱氢来制取乙烯,是化工产业中常用的方法如下所示: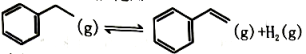 (1)、在催化作用下将乙苯加入三个恒容密闭容器发生上述反应。相关数据如下:
(1)、在催化作用下将乙苯加入三个恒容密闭容器发生上述反应。相关数据如下:容器
容积/L
温度/℃
起始量/mol
平衡量/mol
苯乙烯(g)
乙苯(g)
氢气(g)
苯乙烯(g)
甲
1
3
0
0
1
乙
1
4
3
2
x
丙
1
5
0
0
2.5
①时,向乙容器中按表格中数据投料,则此时(填写“>”“=”“<”);
②(填写“>”“=”“<”);请解释原因。
③乙苯脱氢经历如图所示:

该环节中,温度较低时,更有利于发生的“环节”是;该催化剂在使用过程中,失活现象比较严重,由此推断“脱氢环节”除了产生 , 还会生成离开催化剂表面。
(2)、为了节省能源,乙苯催化脱氢制苯乙烯的过程可以在气氛下进行。100kPa下,反应气组成 , 按照1∶0;1∶1;1∶5;1∶9投料,乙苯平衡转化率随反应温度变化关系如图。图中的曲线是(填曲线标号) (3)、工业乙苯催化脱氢生产苯乙烯时,会产生少量积碳,加入一定温度的水蒸气可较长时间保持催化剂活性,其原因是。
(3)、工业乙苯催化脱氢生产苯乙烯时,会产生少量积碳,加入一定温度的水蒸气可较长时间保持催化剂活性,其原因是。