江苏省南京市建邺区2023-2024学年高一上学期期中考试化学试卷
试卷更新日期:2024-01-17 类型:期中考试
一、单项选择题:共16题,每题3分,共48分。每小题只有一个选项最符合题意。
-
1. 2023年10月4日,化学家芒吉·G.巴文迪、化学家路易斯·E.布鲁斯和物理学家阿列克谢·I叶基莫夫因“发现和合成量子点”获得2023年诺贝尔化学奖。碳量子点是一类具有显著荧光性能的零维碳纳米材料,直径低于10nm。碳量子点通常是由无定型和晶态的碳核组成,在碳核表面含有不同的含氧官能团,例如羟基()等。下列说法正确的是( )A、碳量子点属于胶体 B、碳量子点具有丁达尔效应 C、碳蛋子点直径比分子大 D、碳量子点与石墨属于同素异形体2. 物质的量相同的甲烷和氨气,一定相等的是( )A、体积 B、质子数 C、质量 D、原子数3. 在标准状况下,1升某气体的质量为1.25g,则该气体不可能是( )A、 B、 C、 D、CO4. 白磷()暴露在空气中容易自燃,反应中渐次地生成和 , 相应结构如下所示。
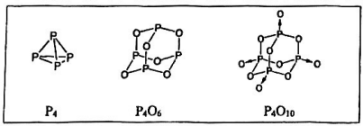
以等物质的量的和相比较,下列结论不正确的是( )
A、它们的分子数目相同10 B、它们含有的P-O-P键的数目相同 C、它们的质量相同 D、它们分子中间的4个P原子均构成正四面体的排列方式5. 水是进行化学反应的最重要溶剂,同时也时常参加化学反应。在下列反应中,水是氧化剂的是( )A、 B、 C、 D、6. 在高温下被C还原,这是“从沙滩到用户”的第一步反应: , 该反应中氧化剂与还原剂的物质的量之比为( )A、1∶2 B、2∶1 C、5∶2 D、2∶57. 在不同反应条件下,与不同反应物相遇,盐酸可以发生多种反应:①;②;
③。因此判断盐酸应当具有的性质是( )
A、只有酸性 B、只有氧化性 C、只有还原性 D、有酸性、有氧化性和还原性8. 如图为NaCl固体在水中的溶解并形成水合离子示意图。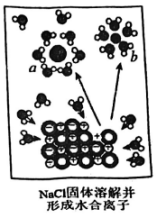
下列有关说法错误的是( )
A、在NaCl固体中和有序排列的 B、NaCl的溶解过程也是电离的过程,可表示为 C、图中的微粒a是水合钠离子 D、NaCl固体熔化过程也可表示为9. 下列溶液与100 mL 0.5 mol⋅L 溶液中的物质的量相等的是( )A、150 mL 1 mol·LNaCl溶液 B、100 mL1.0 mol·L 溶液 C、150 mL 1.5 mol·LKCl溶液 D、75 mL 1 mol⋅L 溶液10. 下列离子方程式书写不正确的是( )A、用稀硫酸除铁锈(主要成分是氧化铁): B、用小苏打与盐酸反应: C、硫酸铜溶液中滴加氢氧化钡溶液: D、大理石溶于醋酸中:11. 下列有关物质用途的说法错误的是( )A、可用于制作泡沫灭火剂 B、可用于制作烘培食品 C、具有强氧化性,可用于漂白 D、高压钠灯发出黄光,透雾能力强,常用于道路和广场照明12. 如图所示是某校实验室从化学试剂商店买回的硫酸试剂瓶上的标签,并用此浓硫酸配制500 mL 2.3 mol·L的稀硫酸。下列有关说法或操作错误的是( )硫酸
化学纯(CP)(500 mL)
品名:硫酸溶液
化学式:
相对分子质量:98
密度:1.84g·cm
质量分数:98%
A、试剂瓶中硫酸溶液的物质的量浓度为18.4 mol·L B、实验中需要取浓硫酸溶液的体积为62.5 mL C、实验中需选用500 mL的容量瓶 D、容量瓶用蒸馏水洗净后,一定需要烘干才能使用。13. 阅读下列文字,回答下面小题:实验室分别进行如下实验:①向蓝色的溶液中滴加酸性溶液,溶液由蓝色变为淡黄色();②向溶液中滴加浓盐酸产生黄绿色气体(),溶液变蓝。(1)、下列各物质中带点元素的化合价最高的是( )A、 B、 C、 D、(2)、下列有关说法正确的是( )A、①中还原剂与氧化剂物质的量之比为1∶5 B、由①②可知,酸性条件下氧化性: C、②中每生成1 mol 分子,转移2 mol电子 D、向溶液中滴加溶液发生反应14. 下列选项所示的物质间转化均能通过一步反应实现的是( )A、 B、 C、 D、15. 某溶液中大量存在五种离子:、、、、X,它们的物质的量之比为 , 则X可能为( )A、 B、 C、 D、二、非选择题(本题共6题,共52分)
-
16. 纯碱是重要的基本化工原料。工业上获得纯碱的方法(氨碱法)主要是将①、②通入NaCl③饱和溶液中,使溶解度小的④从溶液中析出,加热晶体即可获得⑤。我国化学家侯德榜于1943年创立了著名的侯氏制碱法,此法将⑥与⑦合成氨法、氨碱法联合起来,同时得到了纯碱和⑧两种产品,大大缩短了生产流程,降低了成本,实现了中国人自己制碱的梦想。(1)、属于酸性氧化物的是(填序号,下同),在水溶液中可以全部电离的物质是 , 属于非金属单质的是。(2)、实验室在模拟上述反应过程时,先制得饱和食盐水,然后先通入气体,当达到一定浓度后,再通入 , 一段时间以后,便可观察到有白色晶体析出。
写出发生反应的总方程式。
17. 钠是一种非常活泼、具有广泛应用的金属。(1)、金属钠非常活泼,通常保存在里,以隔绝空气。(2)、汽车安全气囊的气体发生剂可由金属钠生产。某汽车安全气囊内含、和等物质。①当汽车发生较严重的碰撞时,引发分解: , 从而为气囊充气。产生的Na立即与发生置换反应生成 , 化学方程式是。
②是冷却剂,吸收产气过程释放的热量。起冷却作用时发生反应的化学方程式为。
③如果安全气囊中装有78 g , 其完全分解所释放的在标准状况下的体积为L。
(3)、工业通过电解NaCl生产金属钠:2NaCl(爆炸) , 过程如下:
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入从而把熔点降至约580℃。粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是。
18. 请配平下列氧化还原反应的方程式,标出电子转移方向和数目,并按要求用“氧化剂”、“还原剂”、“氧化产物”或“还原产物”填空:(1)、过氧化钠曾经作为潜水艇中的供氧剂,其作用是吸收同时释放。反应中是。
(2)、在表现为酸性时,与有着相似的性质,可是遇到过氧化钠却发生了如下反应。反应中是。
19. 人们在认识自然的过程中所形成的化学知识和观念,都始于对实验的观察、想象和思考。(1)、两支盛有等量KI-淀粉溶液的试管,分别同时加入等浓度的溶液和溶液,实验中发现加入水的试管中溶液迅速变为蓝色,而加入溶液的试管却是在慢慢地、慢慢地变蓝。可以想象,当将KI溶液滴加到和的混合溶液中,首先发生的离子反应为 ,由此可以推知,将等物质的量的与在溶液中反应,发生反应的离子方程式为。
(2)、①将5 mL饱和(滴有酚酞试液)溶液迅速滴加到充满气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体。产生晶体的离子方程式为。②两支试管中分别放有1 g NaOH固体,现向两支试管中分别加入等体积(约10 mL)的水和饱和溶液。振荡,两试管中NaOH固体均完全溶解且有放热的现象,同时加入饱和溶液的试管的温度明显高于加水的试管。可见NaOH固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应。
20. 二氧化铈( , 相对分子质量为172)是一种重要的稀土化合物。提纯二氧化铈()一种工艺流程如图所示: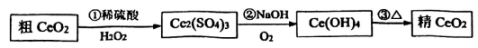 (1)、稀土化合物中Ce的化合价为。(2)、在反应①中体现(填“氧化性”或“还原性”),写出稀硫酸、与反应的化学方程式。(3)、由反应②可知氧化性:(填“>”或“<”或“=”),反应②中的氧化剂与还原剂的物质的量之比为 , 当消耗1 mol 转移电子的物质的量为mol。(4)、是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。
(1)、稀土化合物中Ce的化合价为。(2)、在反应①中体现(填“氧化性”或“还原性”),写出稀硫酸、与反应的化学方程式。(3)、由反应②可知氧化性:(填“>”或“<”或“=”),反应②中的氧化剂与还原剂的物质的量之比为 , 当消耗1 mol 转移电子的物质的量为mol。(4)、是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。
写出过程①发生反应的化学方程式。
的消除过程
(5)、取上述流程中得到的精产品0.4500 g,加硫酸溶解,经标准溶液测定以后,产品中含 0.0025 mol。该产品中的质量分数为(保留一位小数)。21. 称取5.40 g草酸亚铁晶体( , g/mol),用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示,已知400℃时,剩余固体是铁的一种氧化物。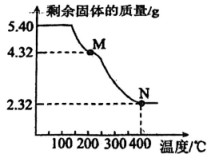
5.40 g草酸亚铁晶体的物质的量为mol,M点对应物质的化学式为 , N点对应的物质是 , M→N发生反应的化学方程式为。